Металлы обладают восстановительными свойствами, так как атомы большинства из них содержат на внешнем энергетическом уровне 1–2 электрона. В химических реакциях металлы отдают валентные электроны, т. е. окисляются.
В периодах Периодической системы химических элементов Д.И.Менделеева с увеличением порядкового (атомного) номера элемента восстановительные свойства электронейтральных атомов – простых веществ – уменьшаются, а окислительные – увеличиваются, достигая максимума у галогенов.
В главных подгруппах (А-группах) с повышением порядкового номера химического элемента восстановительные свойства электронейтральных атомов – атомов простых веществ – увеличиваются и ослабевают окислительные.
В побочных подгруппах (В-группах) электронейтральные атомы химических элементов содержат на внешнем энергетическом уровне 1-2 электрона и проявляют восстановительный характер. Простые вещества этих элементов являются металлами. Восстановительные или окислительные свойства сложных веществ определяются атомом элемента, который меняет степень окисления. Например, рассмотрим ряд соединений хрома:  ,
,  ,
,  и
и  . В дихромате калия К2Сr2О7 атом хрома имеет максимальную степень окисления и не может отдавать электроны, но может их принимать, следовательно, атом хрома может быть только окислителем. В оксиде хрома CrO степень окисления атома хрома минимальна, и атом хрома может быть только восстановителем.
. В дихромате калия К2Сr2О7 атом хрома имеет максимальную степень окисления и не может отдавать электроны, но может их принимать, следовательно, атом хрома может быть только окислителем. В оксиде хрома CrO степень окисления атома хрома минимальна, и атом хрома может быть только восстановителем.
Также окислителями являются сложные анионы, в состав которых входят атомы с высокой степенью окисления:  ,
,  ,
, 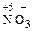 и т. п. Элементарные (простые) анионы проявляют только восстановительные свойства:
и т. п. Элементарные (простые) анионы проявляют только восстановительные свойства:  ,
,  ,
,  и т. п.
и т. п.
Таблица 2
Важнейшие окислители и восстановители
|
Восстановители
| Металлы, Н2, уголь, СО, Н2S, SО2, Н2SО3 и её соли, НI, НВr, НС1, SnС12, FеSО4, МnSО4, Сr2(SО4)3, НNО2, NН3, N2Н4 (гидразин), Н3РО3, альдегиды RCHO, спирты RОН, муравьиная НСООН и щавелевая (СООН)2 кислоты, глюкоза С6Н12О6, катод (при электролизе)
|
|
Окислители
| Галогены, КМnО4, К2МnО4, МnО2, К2Сr2O7, К2СrO4, НNO3, O2, O3, Н2O2, Н2SО4, СuО, Аg2О, РbО2, FеС13, гипохлориты (КСlO), хлораты (КСlO3 – бертоллетова соль) и перхлораты (КСlO4), царская водка – смесь концентрированных азотной и хлороводородной (соляной) кислот (при слиянии), анод (при электролизе)
|
СОСТАВЛЕНИЕ УРАВНЕНИЙ
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ.
Для составления уравнений окислительно-восстановительных реакций применяются метод электронного баланса и метод электронно-ионного баланса (метод полуреакций). Единый принцип этих методов: общее число электронов, присоединяемых окислителем, равно общему числу электронов, отдаваемых восстановителем.
Метод полуреакций применим только для окислительно-восстановительных процессов, протекающих в растворах.
Метод электронного баланса является более универсальным.
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
1. Записывают схему реакции. Например:
Н2S + SО2 → S + Н2О.
2. Определяют степени окисления атомов химических элементов и находят элементы, атомы которых изменяют степень окисления:
 .
.
Правила определения степени окисления атомов элементов
• атомы элементов в простых веществах (К, H2, Вr2 O2, O3, S8)
имеют нулевую степень окисления;
• в простых ионах степень окисления атомов элементов равна их
заряду (K+, Ca2+, Al3+, Сl-, S2- );
• атомы элементов-металлов в сложных веществах имеют
положительную степень окисления;
• атомы водорода в большинстве сложных веществ имеют степень
окисления +1, за исключением гидридов металлов (Na  , Сa , Сa  , Al , Al 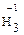 , NaB , NaB  . LiAl . LiAl  ;)
• атомы кислорода в сложных веществах имеют степень
окисления –2, за исключением: ;)
• атомы кислорода в сложных веществах имеют степень
окисления –2, за исключением:  , пероксидов ( , пероксидов ( , ,
 , ,  , ,  );
• в формульных единицах молекул и др. веществ, за исключением
сложных ионов, алгебраическая сумма степеней окисления
атомов элементов с учётом их числа равна нулю;
• в сложных ионах алгебраическая сумма степеней окисления
атомов элементов с учётом их числа равна их заряду
Примеры: );
• в формульных единицах молекул и др. веществ, за исключением
сложных ионов, алгебраическая сумма степеней окисления
атомов элементов с учётом их числа равна нулю;
• в сложных ионах алгебраическая сумма степеней окисления
атомов элементов с учётом их числа равна их заряду
Примеры:
 3(+1) + х + 4(–2) = 0 х = + 5 3(+1) + х + 4(–2) = 0 х = + 5  ;
[ N H4 ]+ х +4(+1)= +1 х = − 3 [N H3 ]+ ;
[ N H4 ]+ х +4(+1)= +1 х = − 3 [N H3 ]+
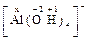 х + 4(–1) = –1 x = +3 х + 4(–1) = –1 x = +3  . .
|
3. Записывают электронные уравнения полуреакций восстановления и окисления.
 – процесс окисления;
– процесс окисления;
восстановитель
 – процесс восстановления.
– процесс восстановления.
окислитель
Мнемоническое[65] правило

|
4. Определяют основные стехиометрические коэффициенты при формулах окислителя и восстановителя. Для соблюдения принципа равенства количества принятых и отданных электронов вводят дополнительные множители, устанавливающие электронный баланс. Эти множители находятся по правилу определения наименьшего общего кратного и представляют собой стехиометрические коэффициенты при формулах окислителя и восстановителя. Так как в рассматриваемом примере в процессе окисления участвует 2 электрона, а в процессе восстановления – 4 электрона, наименьшее общее кратное будет равно 2. Поэтому коэффициенты перед формулами восстановителя и его окисленной формой будут равны 2:


5. Согласно закону сохранения массы расставляют стехиометри-ческие коэффициенты в схеме реакции:
2Н2S + SО2 = 3S + 2Н2О.
6. Проверяют число символов атомов водорода в обеих частях схемы, и если необходимо, то уравнивают их при помощи стехиометрических коэффициентов.
7. Окончательно правильность всех стехиометрических коэф-фициентов проверяют по числу символов атомов кислорода в левой и правой частях схемы. В уравнении реакции они должны быть равны.
Нередко встречаются процессы, в которых восстановитель одновременно выполняет функции солеобразователя. Например, взаимодействие хлороводородной (соляной) кислоты с дихроматом калия:
 ;
;
 – процесс окисления.
– процесс окисления.
восстановитель
В уравнении полуреакции окисления появляется множитель 2 перед символом атома хлора, так как в правой его части находится химическая формула молекулярного хлора, состоящая из символов двух атомов.
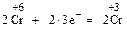 – процесс восстановления.
– процесс восстановления.
окислитель
Множитель 2 в полуреакции восстановления появляется потому, что исходным веществом является  формульная единица которого содержит 2 атома хрома.
формульная единица которого содержит 2 атома хрома.
Поскольку наименьшее общее кратное в данном случае равно 6, то 1 моль К2Сr2О7 расходуется на окисление 6 моль НСl:
6НС1 + К2Сr2О7 → 3С12 + 2СrСl3 + 2КСl + Н2О.
Но хлороводородная кислота расходуется также и на образование солей: хлоридов хрома СrСl3 и калия КСl. Так как стехиометрические индексы перед атомами К и Сr в исходном дихромате калия равны 2, то расчёт показывает, что на образование 2 моль СrСl3 идёт 6 моль НС1 и на образование 2 моль КС1 идёт 2 моль НС1, т. е. в общем 8 моль НС1:
14(6 + 8)НСl + К2Сr2О7 → 3С12 + 2СrС13 + 2КС1 + Н2О.
После уравнивания количества символов атомов водорода в левой и правой частях схемы получаем уравнение реакции:
14НСl + К2Сr2О7 = 3С12 + 2СrС13 + 2КС1 + 7Н2О,
правильность которого проверяем подсчётом символов атомов кислорода
в обеих его частях.



 ,
,  ,
,  и
и  . В дихромате калия К2Сr2О7 атом хрома имеет максимальную степень окисления и не может отдавать электроны, но может их принимать, следовательно, атом хрома может быть только окислителем. В оксиде хрома CrO степень окисления атома хрома минимальна, и атом хрома может быть только восстановителем.
. В дихромате калия К2Сr2О7 атом хрома имеет максимальную степень окисления и не может отдавать электроны, но может их принимать, следовательно, атом хрома может быть только окислителем. В оксиде хрома CrO степень окисления атома хрома минимальна, и атом хрома может быть только восстановителем. ,
,  ,
, 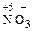 и т. п. Элементарные (простые) анионы проявляют только восстановительные свойства:
и т. п. Элементарные (простые) анионы проявляют только восстановительные свойства:  ,
,  ,
,  и т. п.
и т. п. .
. , Сa
, Сa  , Al
, Al 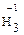 , NaB
, NaB  . LiAl
. LiAl  ;)
• атомы кислорода в сложных веществах имеют степень
окисления –2, за исключением:
;)
• атомы кислорода в сложных веществах имеют степень
окисления –2, за исключением:  , пероксидов (
, пероксидов ( ,
,
 ,
,  ,
,  );
• в формульных единицах молекул и др. веществ, за исключением
сложных ионов, алгебраическая сумма степеней окисления
атомов элементов с учётом их числа равна нулю;
• в сложных ионах алгебраическая сумма степеней окисления
атомов элементов с учётом их числа равна их заряду
Примеры:
);
• в формульных единицах молекул и др. веществ, за исключением
сложных ионов, алгебраическая сумма степеней окисления
атомов элементов с учётом их числа равна нулю;
• в сложных ионах алгебраическая сумма степеней окисления
атомов элементов с учётом их числа равна их заряду
Примеры:
 3(+1) + х + 4(–2) = 0 х = + 5
3(+1) + х + 4(–2) = 0 х = + 5  ;
[ N H4 ]+ х +4(+1)= +1 х = − 3 [N H3 ]+
;
[ N H4 ]+ х +4(+1)= +1 х = − 3 [N H3 ]+
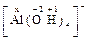 х + 4(–1) = –1 x = +3
х + 4(–1) = –1 x = +3  .
.
 – процесс окисления;
– процесс окисления; – процесс восстановления.
– процесс восстановления.


 ;
; – процесс окисления.
– процесс окисления.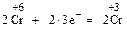 – процесс восстановления.
– процесс восстановления. формульная единица которого содержит 2 атома хрома.
формульная единица которого содержит 2 атома хрома.

