Вопрос №11
Механизм реакции электрофильного присоединения А E: галогенирование,гидрогалогенирование,гидратация. Правило Марковникова.Реакции нуклеофильног присоединения AN по карбонильной группе
Общее описание механизма реакции электрофильного присоединения AE. Присоединение к алкенам электрофильных реагентов НХ (Н2О, ННа1 и т.п.) протекает по гетеролитическому механизму. Электрофильной частицей в данном процессе служит простейший электрофил - протон.
В реакции выделяют две основные стадии:
• атаку алкена протоном с образованием карбокатиона (медленная стадия, определяющая скорость процесса в целом);
• атаку образовавшегося карбокатиона нуклеофилом; в реакции гидратации это молекула Н2О (быстрая стадия).
При гидратации алкенов в условиях кислотного катализа за двумя этими стадиями следует третья - быстрая стадия отщепления протона (возврат катализатора).

· Галогенирование.
Алкены в обычных условиях легко присоединяют галогены. Так, быстрое обесцвечивание бромной воды без выделения бромоводорода служит качественной пробой на двойную связь. Еще легче проходит присоединение хлора.

· Гидрогалогенирование
Алкены и циклоалкены в достаточно мягких условиях взаимодействуют с галогеноводородами, серной и другими сильными кислотами, способными к диссоциации с образованием протона.
В результате присоединения галогеноводородов образуются галогенопроизводные алканов и циклоалканов.

В реакции с концентрированной серной кислотой алкены образую гидросульфаты, в результате гидролиза которых получаются спирты.

Гидратация.
Присоединение воды к алкенам осуществляется только в присутствии катализатора, как правило, серной кислоты. Это известный способ получения спиртов.

несимметричные алкены образуют, как правило, один из воз можных структурных изомеров. В случае преимущественного обра зования одного из нескольких возможных структурных изомеров различным положением вводимой функциональной группы говоря о высокой региоселективности реакции.
Региоселективность - предпочтительное протекание реакции п одному из нескольких реакционных центров одинаковой химиче ской природы.
· В.В. Марковников (1869) сформулировал закономерность, опре деляющую направление присоединения, которая вошла в мировую химию под названием правила Марковникова.
При взаимодействии реагентов типа НХ с несимметричными алке нами атом водорода присоединяется к атому углерода, связанном с максимальным числом атомов водорода, т. е. к наиболее «гид рогенизированному» атому углерода двойной связи.
Так, при гидратации пропена (несимметричного алкена) в соот ветствии с правилом Марковникова преимущественным продукто реакции является пропанол-2:

Такое направление реакции объясняется совокупностью двух факторов. В статическом, т. е. нереагирующем, состоянии в несимметричных алкенах электронная плотность π-связи смещена под влиянием заместителя. Возникшие частичные заряды определяют место будущей атаки протоном. В пропене таким местом будет атом С-1 с частичным отрицательным зарядом (как следствие +/-эффекта метильной группы). Таким образом, статический фактор благоприятствует элек-
трофильной атаке по группе СН2 (путь а), что приводит к вторичному карбокатиону (I). При атаке по атому С-2 должен был бы образоваться менее стабильный первичный карбокатион (II) (путь б).
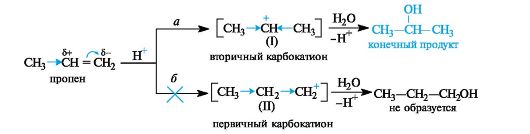
В динамическом состоянии, т. е. в ходе реакции, из двух возможных карбокатионов (I) или (II) будет образовываться более устойчивый. Во вторичном карбокатионе положительно заряженный атом угле- рода связан с двумя электронодонорными алкильными группами, в первичном - с одной. В результате во вторичном карбокатионе за счет +/-эффекта двух алкильных групп осуществляется более эффективное уменьшение положительного заряда. Таким образом, качественная оценка относительной устойчивости промежуточных частиц также говорит в пользу образования вторичного карбокатиона (путь а).
В рассмотренном примере оба фактора, статический и динамический, действуют согласованно. При несогласованном действии статического и динамического факторов последний играет решающую роль. В современной интерпретации правило Марковникова, определяющее региоселективность реакций ненасыщенных соединений, формулируется следующим образом.
Направление присоединения реагентов типа НХ к несимметричным алкенам определяется относительной устойчивостью проме- жуточно образующихся карбокатионов.
Правило Марковникова применяется без оговорок только к алкенам. Однако ненасыщенные соединения часто содержат при двойной связи электроноакцепторные группы (карбоксильную, альдегидную и др.). Учитывая поляризацию связи С=С под влиянием заместителя (статический фактор), можно предсказать иной характер присоединения, а именно, против правила Марковникова. Например, при гидратации α,β-ненасыщенных карбоновых кислот в сильно кислой среде образуются β-гидроксикарбоновые кислоты.

Такой результат можно объяснить и сравнением стабильности промежуточно образующихся карбокатионов (динамический фактор). Катион (I) с одноименными зарядами на соседних атомах углерода менее стабилен, чем катион (II), в котором заряды разделены.

· Реакции нуклеофильного присоединения АN по карбонильной группе
Для альдегидов и кетонов наиболее характерны реакции нуклеофильного присоединения AN.
Общее описание механизма нуклеофильного присоединения AN
Легкость нуклеофильной атаки по атому углерода карбонильной группы альдегида или кетона зависит от величины частичного
положительного заряда на атоме углерода, его пространственной доступности и кислотно-основных свойств среды.

С учетом электронных эффектов групп, связанных с карбонильным атомом углерода, величина частичного положительного заряда δ+ на нем в альдегидах и кетонах убывает в следующем ряду:

Пространственная доступность карбонильного атома углерода уменьшается при замене водорода более объемистыми органиче- скими радикалами, поэтому альдегиды более реакционноспособны, чем кетоны.

Общая схема реакций нуклеофильного присоединения AN к карбонильной группе включает нуклеофильную атаку по карбонильному атому углерода, за которой следует присоединение электрофила к атому кислорода.

В кислой среде активность карбонильной группы, как правило, увеличивается, поскольку вследствие протонирования атома кислорода на атоме углерода возникает положительный заряд. Кислотный катализ используют обычно тогда, когда атакующий нуклеофил обладает низкой активностью.

По приведенному выше механизму осуществляется ряд важных реакций альдегидов и кетонов.
Многие свойственные альдегидам и кетонам реакции протекают в условиях организма, эти реакции представлены в последующих разделах учебника. В настоящей главе будут рассмотрены наиболее важные реакции альдегидов и кетонов, которые в обзорном виде приведены на схеме 5.2.

Присоединение спиртов.
Спирты при взаимодействии с альдегидами легко образуют полуацетали. Полуацетали обычно не выделяют из-за их неустойчивости. При избытке спирта в кислой среде полуацетали превращаются в ацетали.

Применение кислотного катализатора при превращении полуацеталя в ацеталь становится понятным из приведенного ниже механизма реакции. Центральное место в нем занимает образование карбо- катиона (I), стабилизированного за счет участия неподеленной пары электронов соседнего атома кислорода (+M-эффект группы С2Н5О).

Реакции образования полуацеталей и ацеталей обратимы, поэтому ацетали и полуацетали легко гидролизуются избытком воды в кислой среде. В щелочной среде полуацетали устойчивы, так как алкоксидион является более трудно уходящей группой, чем гидроксид-ион.
Образование ацеталей часто используется как временная защита альдегидной группы.
Присоединение воды.
Присоединение воды к карбонильной группе - гидратация - обратимая реакция. Степень гидратации альдегида или кетона в водном растворе зависит от строения субстрата.
Продукт гидратации, как правило, в свободном виде выделить с помощью перегонки не удается, так как он разлагается на исходные компоненты. Формальдегид в водном растворе гидратирован более чем на 99,9%, ацетальдегид - приблизительно наполовину, ацетон практически не гидратирован.

Формальдегид (муравьиный альдегид) обладает способностью свертывать белки. Его 40% водный раствор, называемый формалином, применяется в медицине как дезинфицирующее средство и консервант анатомических препаратов.
Трихлороуксусный альдегид (хлораль) гидратирован полностью. Электроноакцепторная трихлорометильная группа настолько стабилизирует хлоральгидрат, что это кристаллическое вещество отщепляет воду только при перегонке в присутствии дегидратирующих веществ - серной кислоты и др.

В основе фармакологического эффекта хлоральгидрата СС1зСН(ОН)2 лежит специфическое действие на организм альдегидной группы, обусловливающее дезинфицирующие свойства. Атомы галогена усиливают ее действие, а гидратация карбонильной группы снижает токсичность вещества в целом.
Реакции полимеризации.
Эти реакции свойственны в основном альдегидам. При нагревании с минеральными кислотами полимеры альдегидов распадаются на исходные продукты.
Образование полимеров можно рассматривать как результат нуклеофильной атаки атомом кислорода одной молекулы альдегида карбонильного атома углерода другой молекулы. Так, при стоянии формалина выпадает в виде белого осадка полимер формальдегида - параформ.

Вопрос №12
Гомолитическое замещение по насыщенному атому углерода широко распространено, причем этот углерод может входить в состав различных классов соединений, включая алканы. Более того, поскольку связь С - Н в соединениях этого класса довольно прочна и недостаточно поляризована для атаки электрофилом или нуклео-филом, то гомолитическое замещение является основным типом реакций для алканов
Пример - реакция радикального замещения при хлорировании метана:
Общая схема реакции: CH4 + Cl2 ® CH3Cl + HCl
Стадии процесса:
Cl2 ® 2 Cl· (на свету)
Cl· + H–CH3 ® HCl + ·CH3
·CH3 + Cl2 ® CH3Cl + Cl· и так далее.
Механизм радикального замещения обозначается символом SR (по первым буквам английских терминов: S – substitution [замещение], R – radical [радикал]).
Реакции с участием свободных радикалов характерны для соединений с неполярными и слабополярными связями.
Такие связи (например, C–C, C–H, Cl–Cl, O–O и т.п.) склонны к гомолитическому разрыву.
Условия проведения радикальных реакций:
- повышенная температура (часто реакцию проводят в газовой фазе),
- действие света или радиоактивного излучения,
- присутствие соединений - источников свободных радикалов (инициаторов),
- неполярные растворители.
Вопрос №13
Спиртами называют производные углеводородов, содержащие вместо одного или нескольких атомов водорода одну или несколько гидроксигрупп (-OH). Общая формула спиртов, таким образом,R-OH.
Номенклатура спиртов
Номенклатура IUPAC
При наименовании спиртов по номенклатуре IUPAC находят самую длинную цепь атомов углерода, содержащую гидрокисльную группу, и нумеруют ее с края, к которому ближе гидроксильная группа. После перечисления заместителей добавляется название, соответствующее углеводороду главной цепи с добавлением окончания –ол и цифры, показывающей место гидроксильной группы в цепи
Заместительная номенклатура используется достаточно редко. По ней спирты называют, как производные карбинола (метанола). Например, фенилкарбинол- бензиловый спирт (оксиметилбензол), этилкарбинол- пропиловый спирт (или пропанол), винилкарбинол- пропен-2-ол-1, или аллиловый спирт.
Тривиальная номенклатура, напротив, до сих пор широко применяется. Метанол (метиловый спирт, муравьиный спирт), пропиловый спирт, группа амиловых спиртов (С5) и т.д. Не говоря уже о непредельных спиртах, которые практически только и называются тривиальными названиями- аллиловый и пропаргиловый спирты (см. выше).
Классификация спиртов
1. По числу гидроксильных групп в молекуле спирты разделяют на одноатомные, двухатомные, трехатомные и т.д. до многоатомных.

Многоатомные спирты
Среди многоатомных спиртов наиболее известен шестиатомный циклический спирт инозит:

Двухатомные спирты (диолы) с гидроксилами у одного атома углерода (геминальные диолы). Нестабильны в индивидуальном состоянии. Обнаруживаются в незначительных количествах только в водных растворах. Наиболее устойчивы двухатомные спирты (существует исключительно в растворе) хлоральгидрат CCl3-C(OH)2 и гексафторацетонгидрат (CF3) 2C(OH)2:

2. По строению углеводородной цепи спирты разделяют на предельные (насыщенные спирты), непредельные и ароматические( Ароматические спирты являются производными алифатических спиртов, в молекулах которых имеется бензольное кольцо, непосредственно не связанное с гидроксогруппами. Например:


3. По положению гидроксильной группы в цепи различают первичные, вторичные и третичные спирты:

Кислотные свойства
С активными щелочными металлами:
2C2H5OH + 2 Na → 2 C2H5ONa + H2
этилат натрия
Алкоголяты подвергаются гидролизу, это доказывает,
что у воды более сильные кислотные свойства
C2H5ONa + H2O ↔ C2H5OH + NaOH
Основные свойства
С галогенводородными кислотами:
C2H5OH + HBr H2SO4(конц) ↔ C2H5Br + H2O
бромэтан

Лёгкость протекания реакции зависит от природы галогенводорода и спирта – увеличение реакционной способности происходит в следующих рядах:
| первичные < вторичные < третичные
|
II. Окисление
1). В присутствии окислителей [O] – K2Cr2O7 или KMnO4 спирты окисляются до карбонильных соединений:
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.

При окислении вторичных спиртов образуются кетоны.

Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
В кислой среде:
Для первичных и вторичных одноатомных спиртов качественной реакцией является взаимодействие их с кислым раствором дихромата калия. Оранжевая окраска гидратированного иона Cr2O72- исчезает и появляется зеленоватая окраска, характерная для иона Cr3+. Эта смена окраски позволяет определять даже следовые количества спиртов.
CH3- OH + K2Cr2O7 + 4H2SO4 → CO2 + K2SO4 + Cr2(SO4)3 + 6H2O
3CH3-CH2-OH + K2Cr2O7 + 4H2SO4 → 3CH3COH + K2SO4 + Cr2(SO4)3 + 7H2O
В более жёстких условиях окисление первичных спиртов идёт сразу до карбоновых кислот:
3CH3-CH2-OH + 2K2Cr2O7 + 8H2SO4 t→ 3CH3COOH + 2K2SO4 + 2Cr2(SO4)3 + 11H2O
Третичные спирты устойчивы к окислению в щелочной и нейтральной среде. В жёстких условиях (при нагревании, в кислой среде) они окисляются с расщеплением связей С-С и образованием кетонов и карбоновых кислот.
В нейтральной среде:
CH3 – OH + 2KMnO4 →K2CO3 + 2MnO2 + 2H2O, а остальные спирты до солей соответствующих карбоновых кислот.
2). Качественная реакция на первичные спирты!
а) Окисление спирта оксидом меди.
Для этого пары спирта пропускают над раскаленным оксидом меди. Затем полученный альдегид улавливают фуксинсернистой кислотой, раствор становится фиолетовым:
CH3-CH2-OH + CuO —> CH3-CHO + Cu + H2O
б) Взаимодействие с натрием.
2CH3-CH2-OH + 2Na —> 2CH3-CH2-ONa + H2 ↑
 3). Горение (с увеличением массы углеводородного радикала – пламя становится всё более коптящим)
3). Горение (с увеличением массы углеводородного радикала – пламя становится всё более коптящим)
CnH2n+1-OH + O2 t → CO2 + H2O + Q
III. Реакции отщепления
IV. Реакции этерификации
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).

Вопрос №11
Механизм реакции электрофильного присоединения А E: галогенирование,гидрогалогенирование,гидратация. Правило Марковникова.Реакции нуклеофильног присоединения AN по карбонильной группе
Общее описание механизма реакции электрофильного присоединения AE. Присоединение к алкенам электрофильных реагентов НХ (Н2О, ННа1 и т.п.) протекает по гетеролитическому механизму. Электрофильной частицей в данном процессе служит простейший электрофил - протон.
В реакции выделяют две основные стадии:
• атаку алкена протоном с образованием карбокатиона (медленная стадия, определяющая скорость процесса в целом);
• атаку образовавшегося карбокатиона нуклеофилом; в реакции гидратации это молекула Н2О (быстрая стадия).
При гидратации алкенов в условиях кислотного катализа за двумя этими стадиями следует третья - быстрая стадия отщепления протона (возврат катализатора).

· Галогенирование.
Алкены в обычных условиях легко присоединяют галогены. Так, быстрое обесцвечивание бромной воды без выделения бромоводорода служит качественной пробой на двойную связь. Еще легче проходит присоединение хлора.

· Гидрогалогенирование
Алкены и циклоалкены в достаточно мягких условиях взаимодействуют с галогеноводородами, серной и другими сильными кислотами, способными к диссоциации с образованием протона.
В результате присоединения галогеноводородов образуются галогенопроизводные алканов и циклоалканов.

В реакции с концентрированной серной кислотой алкены образую гидросульфаты, в результате гидролиза которых получаются спирты.

Гидратация.
Присоединение воды к алкенам осуществляется только в присутствии катализатора, как правило, серной кислоты. Это известный способ получения спиртов.

несимметричные алкены образуют, как правило, один из воз можных структурных изомеров. В случае преимущественного обра зования одного из нескольких возможных структурных изомеров различным положением вводимой функциональной группы говоря о высокой региоселективности реакции.
Региоселективность - предпочтительное протекание реакции п одному из нескольких реакционных центров одинаковой химиче ской природы.
· В.В. Марковников (1869) сформулировал закономерность, опре деляющую направление присоединения, которая вошла в мировую химию под названием правила Марковникова.
При взаимодействии реагентов типа НХ с несимметричными алке нами атом водорода присоединяется к атому углерода, связанном с максимальным числом атомов водорода, т. е. к наиболее «гид рогенизированному» атому углерода двойной связи.
Так, при гидратации пропена (несимметричного алкена) в соот ветствии с правилом Марковникова преимущественным продукто реакции является пропанол-2:

Такое направление реакции объясняется совокупностью двух факторов. В статическом, т. е. нереагирующем, состоянии в несимметричных алкенах электронная плотность π-связи смещена под влиянием заместителя. Возникшие частичные заряды определяют место будущей атаки протоном. В пропене таким местом будет атом С-1 с частичным отрицательным зарядом (как следствие +/-эффекта метильной группы). Таким образом, статический фактор благоприятствует элек-
трофильной атаке по группе СН2 (путь а), что приводит к вторичному карбокатиону (I). При атаке по атому С-2 должен был бы образоваться менее стабильный первичный карбокатион (II) (путь б).

В динамическом состоянии, т. е. в ходе реакции, из двух возможных карбокатионов (I) или (II) будет образовываться более устойчивый. Во вторичном карбокатионе положительно заряженный атом угле- рода связан с двумя электронодонорными алкильными группами, в первичном - с одной. В результате во вторичном карбокатионе за счет +/-эффекта двух алкильных групп осуществляется более эффективное уменьшение положительного заряда. Таким образом, качественная оценка относительной устойчивости промежуточных частиц также говорит в пользу образования вторичного карбокатиона (путь а).
В рассмотренном примере оба фактора, статический и динамический, действуют согласованно. При несогласованном действии статического и динамического факторов последний играет решающую роль. В современной интерпретации правило Марковникова, определяющее региоселективность реакций ненасыщенных соединений, формулируется следующим образом.
Направление присоединения реагентов типа НХ к несимметричным алкенам определяется относительной устойчивостью проме- жуточно образующихся карбокатионов.
Правило Марковникова применяется без оговорок только к алкенам. Однако ненасыщенные соединения часто содержат при двойной связи электроноакцепторные группы (карбоксильную, альдегидную и др.). Учитывая поляризацию связи С=С под влиянием заместителя (статический фактор), можно предсказать иной характер присоединения, а именно, против правила Марковникова. Например, при гидратации α,β-ненасыщенных карбоновых кислот в сильно кислой среде образуются β-гидроксикарбоновые кислоты.

Такой результат можно объяснить и сравнением стабильности промежуточно образующихся карбокатионов (динамический фактор). Катион (I) с одноименными зарядами на соседних атомах углерода менее стабилен, чем катион (II), в котором заряды разделены.

· Реакции нуклеофильного присоединения АN по карбонильной группе
Для альдегидов и кетонов наиболее характерны реакции нуклеофильного присоединения AN.
Общее описание механизма нуклеофильного присоединения AN
Легкость нуклеофильной атаки по атому углерода карбонильной группы альдегида или кетона зависит от величины частичного
положительного заряда на атоме углерода, его пространственной доступности и кислотно-основных свойств среды.

С учетом электронных эффектов групп, связанных с карбонильным атомом углерода, величина частичного положительного заряда δ+ на нем в альдегидах и кетонах убывает в следующем ряду:

Пространственная доступность карбонильного атома углерода уменьшается при замене водорода более объемистыми органиче- скими радикалами, поэтому альдегиды более реакционноспособны, чем кетоны.

Общая схема реакций нуклеофильного присоединения AN к карбонильной группе включает нуклеофильную атаку по карбонильному атому углерода, за которой следует присоединение электрофила к атому кислорода.

В кислой среде активность карбонильной группы, как правило, увеличивается, поскольку вследствие протонирования атома кислорода на атоме углерода возникает положительный заряд. Кислотный катализ используют обычно тогда, когда атакующий нуклеофил обладает низкой активностью.

По приведенному выше механизму осуществляется ряд важных реакций альдегидов и кетонов.
Многие свойственные альдегидам и кетонам реакции протекают в условиях организма, эти реакции представлены в последующих разделах учебника. В настоящей главе будут рассмотрены наиболее важные реакции альдегидов и кетонов, которые в обзорном виде приведены на схеме 5.2.

Присоединение спиртов.
Спирты при взаимодействии с альдегидами легко образуют полуацетали. Полуацетали обычно не выделяют из-за их неустойчивости. При избытке спирта в кислой среде полуацетали превращаются в ацетали.

Применение кислотного катализатора при превращении полуацеталя в ацеталь становится понятным из приведенного ниже механизма реакции. Центральное место в нем занимает образование карбо- катиона (I), стабилизированного за счет участия неподеленной пары электронов соседнего атома кислорода (+M-эффект группы С2Н5О).

Реакции образования полуацеталей и ацеталей обратимы, поэтому ацетали и полуацетали легко гидролизуются избытком воды в кислой среде. В щелочной среде полуацетали устойчивы, так как алкоксидион является более трудно уходящей группой, чем гидроксид-ион.
Образование ацеталей часто используется как временная защита альдегидной группы.
Присоединение воды.
Присоединение воды к карбонильной группе - гидратация - обратимая реакция. Степень гидратации альдегида или кетона в водном растворе зависит от строения субстрата.
Продукт гидратации, как правило, в свободном виде выделить с помощью перегонки не удается, так как он разлагается на исходные компоненты. Формальдегид в водном растворе гидратирован более чем на 99,9%, ацетальдегид - приблизительно наполовину, ацетон практически не гидратирован.

Формальдегид (муравьиный альдегид) обладает способностью свертывать белки. Его 40% водный раствор, называемый формалином, применяется в медицине как дезинфицирующее средство и консервант анатомических препаратов.
Трихлороуксусный альдегид (хлораль) гидратирован полностью. Электроноакцепторная трихлорометильная группа настолько стабилизирует хлоральгидрат, что это кристаллическое вещество отщепляет воду только при перегонке в присутствии дегидратирующих веществ - серной кислоты и др.

В основе фармакологического эффекта хлоральгидрата СС1зСН(ОН)2 лежит специфическое действие на организм альдегидной группы, обусловливающее дезинфицирующие свойства. Атомы галогена усиливают ее действие, а гидратация карбонильной группы снижает токсичность вещества в целом.
Присоединение аминов и их производных.
Амины и другие азотсодержащие соединения общей формулы NH2X (X = R, NHR) реагируют с альдегидами и кетонами в две стадии. Сначала образуются продукты нуклеофильного присоединения, которые затем вследствие неустойчивости отщепляют воду. В связи с этим данный процесс в целом классифицируют как реакцию присоединения-отщепления.

В случае первичных аминов получаются замещенные имины (их называют также основаниями Шиффа).
Имины - промежуточные продукты многих ферментативных процессов. Получение иминов проходит через стадию образования аминоспиртов, которые бывают относительно устойчивы, например при взаимодействии формальдегида с α-аминокислотами (см. 12.1.4).

Имины являются промежуточными продуктами получения аминов из альдегидов и кетонов путем восстановительного аминирования. Этот общий способ заключается в восстановлении смеси карбонильного соединения с аммиаком (или амином). Процесс протекает по схеме присоединения-отщепления с образованием имина, который затем восстанавливается в амин.

При взаимодействии альдегидов и кетонов с производными гидразина получаются гидразоны. Эту реакцию можно использовать для выделения альдегидов и кетонов из смесей и их хроматографической идентификации.

Основания Шиффа и другие подобные соединения легко гидролизуются водными растворами минеральных кислот с образованием исходных продуктов.
В большинстве случаев для реакций альдегидов и кетонов с азотистыми основаниями необходим кислотный катализ, ускоряющий дегидратацию продукта присоединения. Однако если слишком повысить кислотность среды, то реакция замедлится в результате превращения азотистого основания в нереакционноспособную сопряженную кислоту XNH3+.
Реакции полимеризации.
Эти реакции свойственны в основном альдегидам. При нагревании с минеральными кислотами полимеры альдегидов распадаются на исходные продукты.
Образование полимеров можно рассматривать как результат нуклеофильной атаки атомом кислорода одной молекулы альдегида карбонильного атома углерода другой молекулы. Так, при стоянии формалина выпадает в виде белого осадка полимер формальдегида - параформ.

Вопрос №12
Гомолитическое замещение по насыщенному атому углерода широко распространено, причем этот углерод может входить в состав различных классов соединений, включая алканы. Более того, поскольку связь С - Н в соединениях этого класса довольно прочна и недостаточно поляризована для атаки электрофилом или нуклео-филом, то гомолитическое замещение является основным типом реакций для алканов
Пример - реакция радикального замещения при хлорировании метана:
Общая схема реакции: CH4 + Cl2 ® CH3Cl + HCl
Стадии процесса:
Cl2 ® 2 Cl· (на свету)
Cl· + H–CH3 ® HCl + ·CH3
·CH3 + Cl2 ® CH3Cl + Cl· и так далее.
Механизм радикального замещения обозначается символом SR (по первым буквам английских терминов: S – substitution [замещение], R – radical [радикал]).
Реакции с участием свободных радикалов характерны для соединений с неполярными и слабополярными связями.
Такие связи (например, C–C, C–H, Cl–Cl, O–O и т.п.) склонны к гомолитическому разрыву.
Условия проведения радикальных реакций:
- повышенная температура (часто реакцию проводят в газовой фазе),
- действие света или радиоактивного излучения,
- присутствие соединений - источников свободных радикалов (инициаторов),
- неполярные растворители.
Вопрос №13
Спиртами называют производные углеводородов, содержащие вместо одного или нескольких атомов водорода одну или несколько гидроксигрупп (-OH). Общая формула спиртов, таким образом,R-OH.
Номенклатура спиртов
Номенклатура IUPAC
При наименовании спиртов по номенклатуре IUPAC находят самую длинную цепь атомов углерода, содержащую гидрокисльную группу, и нумеруют ее с края, к которому ближе гидроксильная группа. После перечисления заместителей добавляется название, соответствующее углеводороду главной цепи с добавлением окончания –ол и цифры, показывающей место гидроксильной группы в цепи
Заместительная номенклатура используется достаточно редко. По ней спирты называют, как производные карбинола (метанола). Например, фенилкарбинол- бензиловый спирт (оксиметилбензол), этилкарбинол- пропиловый спирт (или пропанол), винилкарбинол- пропен-2-ол-1, или аллиловый спирт.
Тривиальная номенклатура, напротив, до сих пор широко применяется. Метанол (метиловый спирт, муравьиный спирт), пропиловый спирт, группа амиловых спиртов (С5) и т.д. Не говоря уже о непредельных спиртах, которые практически только и называются тривиальными названиями- аллиловый и пропаргиловый спирты (см. выше).
Классификация спиртов
1. По числу гидроксильных групп в молекуле спирты разделяют на одноатомные, двухатомные, трехатомные и т.д. до многоатомных.

Многоатомные спирты
Среди многоатомных спиртов наиболее известен шестиатомный циклический спирт инозит:

Двухатомные спирты (диолы) с гидроксилами у одного атома углерода (геминальные диолы). Нестабильны в индивидуальном состоянии. Обнаруживаются в незначительных количествах только в водных растворах. Наиболее устойчивы двухатомные спирты (существует исключительно в растворе) хлоральгидрат CCl3-C(OH)2 и гексафторацетонгидрат (CF3) 2C(OH)2:
![]()
|
|
|




































