Механизмы нарушения синаптической передачи нейротоксикантами. Формы токсического процесса.
Все вещества, нарушающие передачу нервных импульсов в холинергических и катехоламинергических синапсах периферического отдела нервной системы, вызывают рассматриваемые эффекты. Свойства большинства этих веществ хорошо известны из курса фармакологии. К числу наиболее токсичных из известных токсикантов относятся некоторые карбаматы (см. выше), нейротоксины, выделенные из яда змей, и ботулотоксин.
Яды змей, относящихся к семейству Elapidae (тигровая змея, тайпан, морские змеи), содержат нейротоксины, избирательно действующие на механизмы передачи нервного импульса в холинэргических нервно-мышечных синапсах (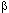 -бунгаротоксин, Кротоксин, Нотексин, Тайпоксин)
-бунгаротоксин, Кротоксин, Нотексин, Тайпоксин)
Все перечисленные в таблице токсины проявляют активность фосфолипаз А2, причем каталитический центр энзимов является функционально значимым для реализации их токсического действия. Интересно отметить, что большинство известных фосфолипаз А2, выделяемых из других источников (поджелудочной железы млекопитающих, пчелиного яда и т.д.), не смотря на высокую специфическую энзиматическую активность, не обладают нейротоксичностью.
Полагают, что нейротоксические фосфолипазы специфически связываются с определенными сайтами пресинаптической мембраны, а затем вызывают неспецифическое разрушение фосфоглицеридов мембраны вокруг сайта, инактивируя тем самым важные в функциональном плане структуры синапса. Опыты, выполненные на изолированных синаптосомах указывают, что одной из таких структур может являться система эффлюкса Са2+ в клетку и клеточные органеллы или каналы для других ионов, в частности К+. Полагают также, что для реализации токсического действия токсины должны попасть внутрь нервных терминалий с помощью механизма специфического эндоцитоза, где и вызывают повреждение синаптосом и митохондрий, нормальная функциональная активность которых необходима для экзоцитоза ацетилхолина. Поскольку нетоксичные фосфолипазы А2 неспецифически связываются с фосфоглицеридами любых, в том числе и несинаптических, биологических мембран, они не обладают свойствами нейротоксикантов.
Различные токсины, вероятно, связываются с различными сайтами пресинаптических структур. Так, одновременная инкубация биопрепарата с двумя нейротоксическими фосфолипазами А2 вызывает блок проведения импульса со значительно большей скоростью, чем с двойной дозой каждого из нейротоксинов в отдельности.
За исключением бетта-бунгаротоксина рассматриваемые нейротоксины обладают также миотоксическим действием на скелетную мускулатуру млекопитающих. Внутримышечное введение веществ сопровождается острой некротической миопатией в области инъекции.
В настоящее время бунгаротоксин, кротоксин, тайпоксин широко используются в практике лабораторных исследований физиологии и биохимии синапсов.
Инкапаситанты: определение, классификация, основные формы токсического процесса. Медико-тактическая характеристика очагов поражения. Специфическая профилактика поражений. Принципы организации оказания неотложной помощи.
Инкапаситанты – вещества, временно выводящие из строя живую силу противника и не уничтожающие ее;
1) Ирританты (стерниты и лакриматоры) – на минуты или до суток;
2) Вещества калечущего действия (микстоксин Т2);
3) Дисрегуляторы (психотомиметики – 7-10 дней (симпатомиметики, гликолаты, фентанил и его наркопроизводные); физиканты (нейролептики, треморогены, эметики – рвотогенетики));
Общие действия:
- разница между LCt50 и ICt50, LD50 и ID50 в несколько порядков;
- эффективность малых доз;
- действие на ЦНС первично и не сопровождается соматическими изменениями;
- вызывает вегетативные расстройства;
- действие обратимо у психически здоровых людей;
Формы токсического процесса:
Ирританты:
Психотомиметики: извращают психические процессы, делают поведение людей неадекватным ситуации;
Физиканты: обездвиживающее действие;
Очаг: нестойкий (стойкий), несмертельный, быстрого действия.
Профилактика: противогаз, ЧСО ИПП, изъятие оружия у пораженных, успокоить их.
Помощь: галантамин (0,5%-2 мл), эзерин (0,05%-2 мл) – ингибиторы холинэстеразы, проникающие через ГЭБ, симптоматическое лечение – бета-адреноблокаторы (анаприлин), пирроксан, периферические антихолинэстеразы (прозерин), борьба с психомоторным возбуждением – трифтазин (0,2% - 1,0 мл), коррекция АД.
Гипоксия как лидирующий фактор токсического процесса. Характеристика гипоксий, формирующихся при интоксикации: классификация, общие механизмы. Принципы оказания помощи. Порядок проведения оксигенотерапии.
Гипоксия является одним из наиболее общих патогенетических факторов в процессах, нарушающих то или иное звено внешнего или внутреннего (тканевого) дыхания. Первичная причина гипоксии — абсолютный или относительный недостаток кислорода в клетках, что приводит к расстройству электрогенеза в возбудимых мембранах и разобщению окислительного фосфорилирования. При этом возникают вторичные изменения, которые характеризуются нарушением гемодинамики и микроциркуляции, потерями ферментов клетками, повреждением мембран лизосом с выходом аутолитических энзимов. Активация свободнорадикальных реакций приводит к окислению липидов мембран и дальнейшему нарушению их функции. В 1948 г. предложена Питерсом и Ван-Слайком классификация различных форм гипоксии по патогенетическому принципу:
1. Гипоксическая гипоксия: а) от понижения парциального давления кислорода во вдыхаемом воздухе; б) в результате затруднения поступления кислорода в кровь через дыхательные пути; в) вследствие расстройства дыхания.
2. Гемическая гипоксия: а) анемический тип; б) в результате инактивации гемоглобина (характеризуется уменьшением кислородной емкости крови).
3. Циркуляторная гипоксия: а) застойная форма; б) ишемическая форма.
4. Тканевая гипоксия, при которой нарушаются процессы потребления кислорода тканями в связи с подавлением функциональной активности различных дыхательных ферментов.
Наряду с указанным, И. Р. Петров и др. выделяют смешанную форму гипоксии. По течению гипоксию делят на молниеносную (например при вдыхании чистых инертных газов), острую и хроническую.
При снижении содержания кислорода в артериальной крови и в тканях включаются компенсаторные механизмы, направленные на устранение кислородной недостаточности. К ним относятся дыхательные, сердечно-сосудистые, кровяные и тканевые реакции, которые устраняют возникшее понижение рО2. При максимальном напряжении всех этих механизмов снабжение тканей кислородом может увеличиться в сравнении с нормой в 16—18 раз.
В развитии гипоксии различают две стадии компенсации и декомпенсации. В стадии декомпенсации кислородного голодания развиваются патологические изменения в важнейших системах и органах, наиболее чувствительных к недостатку кислорода. Так, при гипоксической гипоксии нарушение функции центральной нервной системы представляет непосредственную опасность для жизни человека. Как правило, вслед за изменениями в центральной нервной системе при острой гипоксии наблюдаются нарушения функций сердечно-сосудистой и дыхательной систем.
Изменение метаболизма при гипоксии характеризуется активацией анаэробного окисления, что приводит к нарушению кислотно-основного состояния, повышению содержания недоокис-ленных продуктов в крови и в моче (ацетоновые тела, молочная и пировиноградная кислоты, аминокислоты и т. д.). Эти изменения наступают в результате нарушения углеводного, белкового и жирового обменов.
При интоксикациях наблюдаются практически все типы кислородного голодания, которые могут проявляться в различных сочетаниях.
Так, гипоксическая гипоксия возникает при действии инертных газов, не оказывающих влияния на кровь (метан, азот); как следствие поражения дыхательных путей кислотами и щелочами, оксидами азота, удушающими ОВ и другими ядовитыми веществами, вызывающими отек легких; при действии ядовитых веществ, вызывающих угнетение функции дыхательного центра (например хлорированные углеводороды); при действии ядовитых веществ, вызывающих бронхоспазм (например ФОС и др.).
Гемическая гипоксия развивается как при уменьшении количества гемоглобина в результате действия гемолитических ядов (например мышьяковистый водород), так и при инактивации гемоглобина при отравлении оксидом углерода и метге-моглобинообразователями.
Циркуляторная гипоксия возникает при действии различных ядовитых веществ в результате нарушения сердечно-сосудистой деятельности (токсический шок, коллапс).
Тканевая гипоксия развивается вследствие паралича дыхательной функции клеток при отравлении цианидами, сероводородом и другими ядами.
Во всех случаях гипоксия сразу же начинает приобретать смешанный характер, так как при общих расстройствах функций организма страдают и другие звенья внешнего и внутреннего дыхания.
В случаях интоксикаций, протекающих с явлениями кислородного голодания, возникает необходимость в проведении рациональной терапии, направленной на ликвидацию гипоксии.
Лечебные мероприятия при гипоксии в основном сводятся к повышенной доставке кислорода тканям. Наиболее распространенным методом кислородной терапии является ингаляционный. Существующие методы ингаляции кислорода при нормальном барометрическом давлении, хотя и создают условия для относительно большего насыщения организма кислородом, не могут полностью устранить кислородное голодание при таких патологических состояниях, когда дефицит кислорода слишком велик. В этих случаях значительное преимущество имеет метод применения кислорода под давлением (оксигенобаротерапия). При этом появляется возможность резко увеличить содержание кислорода в организме п в значительной степени обеспечить его утилизацию независимо от количества активного гемоглобина.
Клинические и экспериментальные данные позволяют считать, что оксигенобаротерапия при различных отравлениях имеет неравнозначную ценность. Так, при кислородном голодании гемического типа (отравление СО, метгемоглобинообразователями) лечение кислородом под давлением дает положительные результаты даже без применения дополнительных средств помощи. При острых интоксикациях, приводящих к тканевой и циркуляторной гнпоксемии (отравление цианидами, ФОС), оксигенобаротерапию проводят с применением антидотов.
ОВТВ раздражающего действия: физико-химические свойства, токсичность, токсикокинетика, механизм токсического действия, формы токсического процесса. Медико-тактическая характеристика очагов поражения. Специфическая профилактика поражений. Принципы оказания неотложной помощи.
Лакриматоры (слезоточивые) и стерниты (чихательные). Большинство не растворимо в воде, не летучи – искусственные аэрозоли. Токсичность возрастает от фтора к йоду. К слезоточивым – алифатические (бромпропанон) и ароматические (хлорацетофенон – «черемуха»), азотсодержащие (бромбензилцианид). Все стерниты – производные трехвалентного мышьяка.
Поражение легкой степени: жжение в глазах, блефароспазм, боль, светобоязнь.
Поражение средней степени: раздражение дыхательных путей, ринорея, саливация, диспноэ, кашель.
Тяжелое отравление: тошнота, рвота.
Механизм токсического действия: 1) прямое действие яда на нервные волокна (вызывает глубокие нарушения метаболических процессов в окончаниях чувствительных волокон – развитие импульсации по волокну), 2) опосредованное действие через активацию процессов синтеза в покровных тканях брадикинина и простогландинов, других БАВ.
Очаг: нестойкий (стойкий, если осело на листьях или траве, а потом поднялось в воздух), несмертельный, быстрого действия.
Профилактика: противогаз, СИЗ кожи.
Помощь: 1) прерывание ноцицептивной афферентной импульсации в любом из звеньев проведения и восприятия нервных сигналов (1% дикаин, 2% новокаин), 2) активация системы подавления ноцицептивного чувства (промедол), 3) прерывание эфферентного сигнала (М-холинолитики) – противодымная смесь (фициллин).
ОВТВ удушающего действия: определение, классификация. Патогенез токсического отека легких. Медико-тактическая характеристика очагов поражения. Специфическая профилактика поражений. Обоснование лечебно-эвакуационных мероприятий.
Вещества с преимущественно удушающим действием (хлор, фосген, хлорпикрин, оксид азота); вызывают острое нарушение внешнего дыхания (токсический отек легких), в основе патогенеза – гипоксическая гипоксия.
Вещества замедленного действия: фосген и его производные;
Вещества быстрого действия: хлор, хлорпикрин, оксиды азота;
Патогенез отека: снижается жизнеспособность и метаболитическая активность эндотелиальных клеток кровеносных капилляров легких, повышается содержание вазоактивных веществ в малом кругу кровообращения, спазм, повышение гидростатического давления, увеличение транссудации жидкости, увеличение транссудации форменных элементов крови в интерстиций, снижение лимфооттока в 5-10 раз, сдавление малого круга кровообращения, интерстициальный отек легких, снижение оксигенации крови и снижение общего метаболизма организма.
Профилактика: противогаз, удаление из зараженной зоны, вдыхание фициллина, обеспечение физического покоя и согревание. Транспортируют только лежа. Оксигенотерапия КИ-4М и И-2 кислородно-воздушной смесью с содержанием О2 не более 60%. Противоспенивающие – этиловый спирт, 10% коллоидного силикона раствор, 10% спиртовой раствор антифомсилана – все это ингаляционно.
Глюкокортикоиды для повышения уровня аденилатциклазы (дексаметазон в больших дозах длительно ингаляционно). Если все хреново, то выписывают преднизолон. Помимо этого вводят дибутирил цАМФ, простогландин Е и теофиллин. В начальных стадиях отека легких – кровопускания (до 450 мл) с последующим введением раствора 40% глюкозы или полиглюкин.
При ССС-расстройствах – строфантин, коргликон.
Противопоказано введение норадреналина (вызывает отек легких), барбитуратов, аналептиков, атропина и антигистаминных средств.
18. Военно-профессиональные яды: определение, классификации, источники контакта военнослужащих. Принципы специфической профилактики поражений в условиях повседневной деятельности войск (сил Флота).
ВПЯ – высокотоксичные вещества, воздействующие на л\с при авариях или при эксплуатации техники.
Вредные примеси – ядовитые вещества в атмосфере корабля.
Классификация: 1) Неэлектролиты: предельные углеводороды (бензин, керосин); спирты (этиловый, метиловый, этиленгликоль); галогенированные водороды (дихлорэтан, фреоны, тетрахлоруглерод); ароматические соединения (бензол, толуол).
2) Вещества прижигающего действия: кислоты (азотная, уксусная); щелочи (едкий натр, едкое кали, нашатырь, гидразин); окислители (фтор, перекись водорода).
3) Вещества с преобладающим специфическим действием на организм: тетраэтилсвинец, трикрезилфосфат.
Источники: 1) Системы вооружения (жидкое ракетное топливо и его компоненты);
2) Технические средства – агрегаты и механизмы на корабле (ГЭУ, аккумуляторные батареи – кислоты, щелочи, сурьмянистый и мышьяковистый водород), гидравлика (этиленгликоль), холодовые агрегаты, ЛОХ (лодочная объемная химическая система пожаротушения) – источники фреонов;
3) Полимерные материалы (обшивка корабля);
4) Антропотокисны (ядовитые продукты жизнедеятельности человека).
Профилактика: выполнение требований безопасности, руководящих документов, внимательное выполение работ с ядовитыми веществами, при возникновении опасных ситуаций – системы защиты (изолирующие или шланговые противогазы, СИЗ), устранение аварийных ситуаций, при отравлениях – антидотная терапия, симптоматическое лечение, предупреждение осложнений, восстанавливающая терапия.
Общая токсикологическая характеристика компонентов жидких ракетных топлив: физико-химические свойства, токсичность, токсикокинетика, механизмы токсического действия, формы токсического процесса, специфическая профилактика, принципы оказания неотложной помощи.
Компоненты ракетных топлив.
- Твердые РТ;
- Жидкие РТ (очень токсичные, но более эффективные);
Жидкие: горючее + окислитель;
Горючее (керосин, гидразин – диазосоединения N-N);
Окислитель (фтор, О2, HNO3);
До 80% ракет морского базирования содержат гидразин и азотную кислоту.
Все компоненты ракетного топлива – мощные окислители и восстановители, все летучие, все токсичные, все опасные.
Несмотря на то, что КРТ принадлежат к разным классам ОВ, клиника проявляется одинаковыми чертами:
- химический ожог;
- поражение ВДП (ожог ВДП – ларингоспазм, тяжелые фарингиты, бронхиты);
- возможность развития токсического отека легких;
- спецэффект: метгемоглобинообразование.
Гидразин вызывает судорожный синдром (истощение ГАМК),
Антидотом является 25 мг\кг В6;
Токсикологическая характеристика ФОВ: физико-химические свойства, токсичность, токсикокинетика, механизмы токсического действия, формы токсического процесса, Медико-тактическая характеристика очага. Специфическая профилактика. Принципы оказания неотложной помощи.
Впервые синтезированы Тенаром; Отечественный ученый – Арбузов; В основном – жидкости, боевое состояние – аэрозоль, пар; Характеристики: бессимпотмный контакт, короткий скрытый период;
Основное токсическое действие: антихолинэстеразное; Неантихолинэстеразное действие: холинолитическое, холиносенсибилизирующее, холиномиметическое; Нехолинэстеразные нехолинергические механизмы: нарушение внутриклеточного кальциевого гомеостаза, активация процессов перикисного окисления липидов, иммуносупрессия; Реакции: фосфорилирование, окисление (Vx), гидролиз (зоман, зарин); высокая реакционная способность за счет двойной связи между фосфором и кислородом;
Яды антихолинэстеразного действия: карбофос, армин, зарин, зоман, хлорофос, фофакол; ФОВ действуют на холинореактивные синапсы; ФОВ относятся к конвульсантам, ингибиторам ацетилхолинэстеразы;
В основе их токсического воздействия лежит первичное повреждение передачи нервного импульса;
Очаг стойкий, смертельный, быстродействующий; Зарин: его гидролиз усиливают добавлением щелочей, период его полустарения от 5 часов до суток; Зоман: его гидролиз усиливают содой и щелочью, период полустарения до 10 минут; Связанная с Vx ацетилхолинэстераза не стареет, Vx наиболее токсичен;
Клиника ФОС наступает через несколько минут (перкутанно – через 2-3 часа); При ингаляции ФОС и его поступлении через ожоги и раны наблюдается миоз (с загрудинным синдромом → легкое отравление, ранние признаки);
Среднее отравление: максимальный миоз, миофибрилляции, бронхоспазм; Тяжелое отравление: судороги, кома, ОДН При транскутанном поступлении: локальный гипергидроз, пилоэрекция, миофибрилляция;
Перорально: рвота, боли в животе, диарея; Из-за бронхоспазма, нарушения проведения нервного импульса, торможением дыхательного центра, судорог, бронхореи развивается гипоксическая гипоксия (а вообще-то развивается смешанная гипоксия); Признаки никотиноподобного действия: миофибрилляции, тахикардии, повышение АД.
Признаки мускариноподобного действия: миоз и спазм аккомодации, бронхоспазм, бронхорея, брадикардия;
Профилактические методы: изолирующие средства кожи, противогаз, антидот: П-10М (обратимый ингибитор холинэстеразы), принимают за 30 минут до входа в очаг;
Антидоты при ФОВ: афин, АЛ-85, их применяют при первых признаках поражения;
Механизм действия антидотов: дефосфорилирование холинэстеразы, дефосфорилирование холинорецепторов;
Врачебные антидоты: атропин, дипироксим; Центральные М и Н-холинолитики назначают в начальный период интоксикации Переатропинизация: мидриаз, тахикардия, сухость кожи и слизи;
Скорость и уровень реактивации холинэстеразы зависят от строения ФОВ, строения оксима, времени существования фермент-ингибиторного комплекса; Тактика применения периферических холинолитиков: повторное применение, частое введение, использование больших доз, ведение парентерально;
На старение холинэстеразы влияет: длина, пространственная конфигурация, «тяжесть» радикалов;
Биотрансформация за счет: взаимодействия с псевдохолинэстеразой, карбоксилэстеразой крови и тканей, конъюгация, микросомальное окисление;
Общая токсикологическая характеристика спиртов: физико-химические свойства, токсичность, токсикокинетика, механизм токсического действия, формы токсического процесса, принципы оказания неотложной помощи.
Спирты - органические в-ва, содержащие гидроксильную группу соединенную с каким-либо углеводородным радикалом;
Токсикологические особенности спиртов: меньшая токсичность, чем у других углеродов, способны растворяться в воде, способны равномерно распределяться в организме;
С увеличением количества углеродных атомов способность к растворимости снижается, спирты с С>16 - твердые вещества, <16 - бесцветные летучие жидкости легче воды;
Замыкание углеродной цепи делает их более токсичными;
Пути поступления в организм: пероральный, перкутанный (long), ингаляционный (long);
При пероральном поступлении большая часть всасывается в тонкой кишке;
Поступая в кровь, они не связываются с белками и находятся в свободном состоянии, равномерно распределясь между эритроцитами и плазмой;
Основная часть спиртов из организма выводится через легкие;
Окисление первичных спиртов идет по схеме: спирт-альдегид-кислота, вторичных: спирт-кетон-кислота;
На ранних этапах метаболизма в окислении спиртов участвуют: алкогольдегидрогеназа, каталаза, микросомальная этанол-окислительная система (возрастает при хроническом воздействии), ксантиноксидаза;
Чем медленнее идет биотрансформация спиртов, тем они токсичней;
Акцептором водородов, отрываемых от спиртов является НАД, соотношение НАДН\НАД увеличивается, что свидетельствует о нарастани внутриклеточного ацидоза из-за накопления в клетке кислых валентностей;
Наркотический эффект присущ всем спиртам;
Помощь: прекращение поступления + промывание ЖКТ, усиление элиминации (форсированный диурез), нормализация метаболических нарушений (глюкоза), функций ССС (кофеин) и ДС (аналептики).
Токсикологическая характеристика оксида углерода: физико-химические свойства, токсичность, токсикокинетика, механизм токсического действия, формы токсического процесса, специфическая профилактика, принципы оказания неотложной помощи.
СО - бесцветный газ без запаха; Общеядовитого действия, 4й класс опасности, токсичность увеличивается при горении веществ;
Отравление вызывается ингаляционно (первично - гемическая гипоксия, затем смешанная), вступает в реакцию с гемоглобином, миоглобином, цитохромоксидазой, цитохромом Р-450, негемоглобинным Fe;
Эффект Бора: повышение скорости диссоциации окси- и карбоксигемоглобина;
Эффект Холдена: снижение диссоциации оксигемоглобина (при одновременном связывании СО и О2);
Типичная форма отравления: асфиктическая;
Нетипичные формы: синкопальная, эйфорическая, апоплексическая;
В основе индикации карбоксигемоглобина: медленная скорость его диссоциации;
Кооперативность связывания оксигемоглобина означает, что присоединение О2 к одному гему облегчает его присоединение к остальным гемам того же тетрамера;
Легкая степень отравления: 20-30%;
Средняя степень: 30-50%;
Тяжелая степень: свыше 50%;
Гиповолемия при тяжелом отравлении вызвана:
- рефлекторным распределением крови от периферии к центру,
- торможением сосудодвигательного центра,
- гипокапнией;
На начальных этапах интоксикации характерно рефлекторное усиление деятельности;
На терминальных этапах угнетается функция сердца с делятацией, увеличивается остаточный объем крови, наличие ретроградного застоя в крупных венах.
Острое отравление - гемоглобин, миоглобин;
Хроническое отравление - цитохромоксидаза;
Профилактика: ацизол, при СО меньше 1% - фильтрующий противогаз с гопкалитовым патроном + дополнительный патрон, при СО больше 1% - изолирующий противогаз;
Антидоты: кислород, ацизол;
Токсикологическая характеристика цианидов: физико-химические свойства, токсичность, токсикокинетика, механизм токсического действия, формы токсического процесса. Медико-тактическая характеристика очага.
Общая токсикологическая характеристика ботулотоксина, тетанотоксина, сакситоксина: физико-химические свойства, токсичность, токсикокинетика, механизм токсического действия, формы токсического процесса, специфическая профилактика,
Ботулотоксин - белок, продуцируемый микроорганизмами Clostridium botulinum. Ботулотоксин - табельное отравляющее вещество армии США.
Он избирательно захватывается нервными терминалиями холинэргических волокон; часть введенного токсина путем ретроградного аксонального тока транспортируется в тела нервных клеток. Избирательно блокирует высвобождение ацетилхолина в нервно-мышечных синапсах, действие ботулотоксина приводит к угнетению как спонтанного, так и вызванного выброса нейромедиатора. Чувствительность постсинаптического рецептора к ацетилхолину не изменяется. Блокада передачи сигнала не сопровождается вмешательством токсиканта в процессы синтеза и хранения ацетилхолина. По расчетам, для блокады синапса достаточно 10 молекул токсина. Чем выше нервная активность, тем быстрее происходит развитие интоксикации. Морфологические изменения в пораженных синапсах не выявляются методами световой и электронной микроскопии.
Действие вещества продолжительно, до нескольких недель, и потому характер взаимодействия токсина с пресинаптическими структурами-мишенями можно рассматривать как необратимое. Полагают, что восстановление нормальной иннервации мышц происходит в результате формирования новых синаптических контактов.
Периоду клинических проявлений предшествует скрытый период, во время которого и происходит связывание токсиканта с нервными окончаниями. Выделяют четыре периода действия токсина на синапс:
- связывание с плазматической мембраной холинергических нервных окончаний;
- интернализации токсина путем эндоцитоза;
- проникновение в цитозоль синапса при участии pH-зависимой транслоказы;
- внутриклеточное расщепление токсина под влиянием метал-зависимых эндопротеаз с высвобождением действующей части белковой молекулы.
Молекулярный механизм действия токсина до настоящего времени не выяснен. Вероятно, в основе эффекта лежит нарушение токсином механизма взаимодействия синаптических везикул, в которых депонирован ацетилхолин, с аксолемой, - необходимый этап процесса Ca2+-зависимого экзоцитоза медиатора.
Тетанотоксин - поступает по механизму ретроградного тока, транссинаптически. Блокирует высвобождение ГАМК из нервных окончаний. Тетанотоксин продуцируется анаэробными бактериями Clostridium tetani. Неустойчив при нагревании. Для людей смертельная одноразовая доза токсина составляет 0,2 - 0,3 мг.
После действия токсина скрытый период может продолжаться в течение нескольких суток. Вслед за общими проявлениями недомогания развивается тризм жевательной мускулатуры, а затем и других групп мышц. Смерть наступает от остановки дыхания в результате тонического сокращения дыхательной мускулатуры. У млекопитающих токсин также вызывает приступы тонических судорог. Установлено, что при этом блокируется выброс тормозных нейромедиаторов ГАМК и глицина пресинаптическими структурами. ГЭБ для тетанотоксина не проницаем. В ряде исследований показано наличие в нервных окончаниях специфических сайтов связывания токсина. Эти структуры представляют собой ганглиозиды или углеводные комплексы, близкие по строению ганглиозидам. Сиаловая кислота, как полагают, - важнейший компонент этих сайтов. Тетанотксин не связывается с ненейрональными клеточными мембранами и в этом одна из причин его высокой токсичности. Структурно рецептор тетанотоксина вероятно напоминает рецептор тиреотропина. Токсин способен связываться с препаратом мембран, приготовленных из ткани щитовидной железы, при этом тиреотропин блокирует это связывание. Вместе с тем in vivo гормон потенцирует связывание токсина мембранами нервных клеток.
Сакситоксин - "паралитический яд моллюсков" - одного из наиболее токсичных веществ небелковой природы. По названию одного из моллюсков, употребляемых в пищу, из ткани которого токсикант также выделялся (Saxidomus), вещество получило название сакситоксин. Позже было установлено, что в организм моллюсков сакситоксин поступает с одноклеточными животными вида Conyaulax catenella, являющимися для них продуктом питания.
Сине-зелёные водоросли пресноводных водоемов также синтезируют сакситоксин.
Сакситоксин (МВ - 372) - аморфный, хорошо растворимый в воде, спирте, метаноле, ацетоне порошок. В 60х - 70х годах свойства сакситоксина активно изучались военным ведомством США. Молекулы сакситоксина, выделенные из разных источников, не полностью идентичны.
Смертельная доза сакситоксина для человека составляет по разным данным 0,004 - 0,01 мг/кг.
Вещество быстро абсорбируется в кишечнике и столь же быстро выводится из организма с мочой. Детально токсикокинетика токсиканта не изучена.
Выделяют три варианта течения отравления сакситоксином: гастро-энтеральный, аллергический, паралитический. Аллергическая (эритематозная) форма отравления появляется у отдельных лиц с повышенной чувствительностью к токсину. Типичной является паралитическая форма.
Обычно симптомы появляются в течение 30 минут после поступления вещества в организм. Первыми признаками поражения являются парестезии в области рта, губ, языка, десен, распространяющиеся на область шеи, конечности. Ощущение покалывания, жжения сменяются онемением. Позже присоединяется атаксия, возникает ощущение невесомости тела. При тяжелой интоксикации появляются признаки бульбарных нарушений: затруднение глотания, речи (иногда - афония), изменение ширины зрачка, временное нарушение зрения. Частыми проявлениями отравления являются: понос, рвота, тошнота, потливость, головная боль, слабость мускулатуры, тахикардия, чувство жажды, саливация, анурия, боли в животе. Паралич двигательной мускулатуры, начавшись в области конечностей, распространяется на другие группы мышц. Смерть наступает через 1 - 24 часа от паралича дыхательной мускулатуры и асфиксии.
Специфических средств терапии нет. Целесообразно перевести пострадавшего на искусственную вентиляцию легких. В случае сохранения жизни прогноз благоприятный: выздоровление бывает быстрым и полным.
Место токсического действия сакситоксина - возбудимые мембраны нервных клеток и миоцитов, причем до конца не определено, какие из структур являются более чувствительными. При введении вещества в смертельной доза, проведение нервных импульсов по диафрагмальному нерву регистрируются, когда электромиограмма диафрагмальной мышцы уже безмолвствует. Развивающееся снижение артериального давления связывают с блокадой проведения нервных импульсов по симпатическим нервным волокнам, параличом гладкомышечных клеток сосудистой стенки.
Механизмы нарушения синаптической передачи нейротоксикантами. Формы токсического процесса.
Все вещества, нарушающие передачу нервных импульсов в холинергических и катехоламинергических синапсах периферического отдела нервной системы, вызывают рассматриваемые эффекты. Свойства большинства этих веществ хорошо известны из курса фармакологии. К числу наиболее токсичных из известных токсикантов относятся некоторые карбаматы (см. выше), нейротоксины, выделенные из яда змей, и ботулотоксин.
Яды змей, относящихся к семейству Elapidae (тигровая змея, тайпан, морские змеи), содержат нейротоксины, избирательно действующие на механизмы передачи нервного импульса в холинэргических нервно-мышечных синапсах (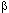 -бунгаротоксин, Кротоксин, Нотексин, Тайпоксин)
-бунгаротоксин, Кротоксин, Нотексин, Тайпоксин)
Все перечисленные в таблице токсины проявляют активность фосфолипаз А2, причем каталитический центр энзимов является функционально значимым для реализации их токсического действия. Интересно отметить, что большинство известных фосфолипаз А2, выделяемых из других источников (поджелудочной железы млекопитающих, пчелиного яда и т.д.), не смотря на высокую специфическую энзиматическую активность, не обладают нейротоксичностью.
Полагают, что нейротоксические фосфолипазы специфически связываются с определенными сайтами пресинаптической мембраны, а затем вызывают неспецифическое разрушение фосфоглицеридов мембраны вокруг сайта, инактивируя тем самым важные в функциональном плане структуры синапса. Опыты, выполненные на изолированных синаптосомах указывают, что одной из таких структур может являться система эффлюкса Са2+ в клетку и клеточные органеллы или каналы для других ионов, в частности К+. Полагают также, что для реализации токсического действия токсины должны попасть внутрь нервных терминалий с помощью механизма специфического эндоцитоза, где и вызывают повреждение синаптосом и митохондрий, нормальная функциональная активность которых необходима для экзоцитоза ацетилхолина. Поскольку нетоксичные фосфолипазы А2 неспецифически связываются с фосфоглицеридами любых, в том числе и несинаптических, биологических мембран, они не обладают свойствами нейротоксикантов.
Различные токсины, вероятно, связываются с различными сайтами пресинаптических структур. Так, одновременная инкубация биопрепарата с двумя нейротоксическими фосфолипазами А2 вызывает блок проведения импульса со значительно большей скоростью, чем с двойной дозой каждого из нейротоксинов в отдельности.
За исключением бетта-бунгаротоксина рассматриваемые нейротоксины обладают также миотоксическим действием на скелетную мускулатуру млекопитающих. Внутримышечное введение веществ сопровождается острой некротической миопатией в области инъекции.
В настоящее время бунгаротоксин, кротоксин, тайпоксин широко используются в практике лабораторных исследований физиологии и биохимии синапсов.



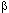 -бунгаротоксин, Кротоксин, Нотексин, Тайпоксин)
-бунгаротоксин, Кротоксин, Нотексин, Тайпоксин)

