О.А. Журавская
ОСНОВЫ БИООРГАНИЧЕСКОЙ ХИМИИ
Учебно-методическое пособие
для студентов медицинских вузов
Самара 2010
УДК
Ж 91
Рецензенты:
– кандидат химических наук, доцент А.А. Данилин;
– кандидат химических наук, доцент О.К. Шаховкина.
Журавская О.А. Основы биоорганической химии:Учебно-методическое пособие для студентов медицинских вузов. – Самара, НОУ ВПО «Самарский медицинский институт «РеаВиЗ», 2010 − 52 с.
Изучение биоорганической химии в медицинских вузах связано с усвоением большого объема материала при малом количестве аудиторных часов.
В учебном пособии изложены ключевые моменты биоорганической химии, материал представлен в текстуальной форме, таблицах, схемах и рисунках, что позволяет оптимизировать процесс запоминания.
Пособие предназначено для студентов медицинских вузов, обучающихся по специальностям «Лечебное дело» и «Стоматология» очной и очно-заочной формы обучения.
© НОУ ВПО СМИ «РеаВиЗ», 2010
Раздел 1. Основы строения и факторы, определяющие реакционную способность органических соединений
1.1. Введение в биоорганическую химию.
Основные понятия и термины
Биоорганическая химия изучает строение и свойства веществ, участвующих в процессах жизнедеятельности, в непосредственной связи с познанием их биологических функций.
 Объекты биоорганической химии
Объекты биоорганической химии
| Биополимеры
| Биорегуляторы −
|
| (их структурные компоненты) –
Высокомолекулярные природные соединения, служащие структурной основой живых организмов (пептиды, белки, углеводы, нуклеиновые кислоты, липиды).
| Соединения, регулирующие обмен веществ (витамины, гормоны, синтетические БАВ, лекарственные средства).
|
Некоторые понятия и термины
Метаболизм (обмен веществ) – совокупность химических реакций, протекающих в организме; дает энергию и вещества, необходимые для функционирования организма.
Катаболизм – реакции распада (выделение энергии, окисление [O]).
Анаболизм – реакции биосинтеза (затрата энергии, восстановление [H]).
Биосинтез – химические реакции, приводящие в условиях организма к получению конкретного класса соединений.
Для обозначения химического процесса, протекающего вне организма используется латинское название – in vitro, внутри организма – in vivo.
Ациклические углеводороды
Алканы – ациклические углеводороды, содержащие максимальное количество атомов водорода. Первые четыре представителя имеют полусистематические названия – метан, этан, пропан, бутан. Остальные алканы называют с помощью корня соответствующего греческого числительного с добавлением суффикса – ан:
| n
| CnH2n+2
| n
| CnH2n+2
|
|
| CH4 - метан
|
| C12H26 - додекан
|
|
| C2H6 - этан
|
| C15H32 - пентадекан
|
|
| C3H8 - пропан
|
| C18H38 - октадекан
|
|
| C4H10 - бутан
|
| C20H42 - эйкозан
|
|
| C5H12 - пентан
|
| C21H44 - генэйкозан
|
|
| C6H14 - гексан
|
| C28H58 - октакозан
|
|
| C7H16 - гептан
|
| C30H62 - триаконтан
|
|
| C8H18 - октан
|
|
|
|
| C9H20 - нонан
|
|
|
|
| C10H22 - декан
|
|
|
Одновалентные радикалы, производимые от насыщенных ациклических углеводородов, называют путем замены окончания –ан на –ил:
CH3 – метил-
C2H5 – этил-
CH3–CH2–CH2 – пропил-
H3  C
C
 CH– изопропил-
CH– изопропил-
H3C
CH3–CH2–CH–CH3 – втор-бутил-
|
H3  C
C
 CH– CH2– изобутил- и т.д.
CH– CH2– изобутил- и т.д.
H3C
Наиболее длинная С-цепь (родоначальная структура) нумеруется так, чтобы номера были наименьшими:
 2,3,5 – триметилпентан
2,3,5 – триметилпентан
|  3,3 – диметил – 4 – этилгептан
3,3 – диметил – 4 – этилгептан
|
Непредельные ациклические углеводороды содержат кратные связи, наличие которых обозначают путем замены суффикса - ан на - ен (при двойной связи С=С), на - ин (при тройной связи С≡С).
Соединения, имеющие как двойные, так и тройные связи, получают названия путем замены суффикса –ан в названии соответствующего алкана на - енин, - адиенин, - атриенин, - ендин и т.п. Кратным связям должны соответствовать низкие цифровые обозначения, а двойным связям присваивают наименование номера:
 3,4 – диметилгексен -1
3,4 – диметилгексен -1
|
|  4,6-диметил-3-этилгептин-1
4,6-диметил-3-этилгептин-1
|
|
 пентен-1-ин-4
пентен-1-ин-4
|
| |
Одновалентные радикалы непредельных ациклических углеводородов:
CH2=CH– винил-
CH2=CH–CH2– аллил-
HC≡C– этенил
Циклопропан
 циклогексен
циклогексен
|
Одновалентные радикалы, образованные из циклоалканов, называют, заменяя суффикс – ан на – ил. Атом углерода, несущий свободную валентность, обозначают номером 1.
 циклопропил- циклобутил- циклопентил-
циклопропил- циклобутил- циклопентил-
|
Моноциклические и полициклические ароматические углеводороды (арены) имеют тривиальные названия, использование которых разрешено правилами ИЮПАК:
 бензол
бензол
| CH3
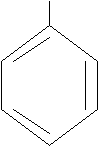 толуол
толуол
|  CH3
ксилол CH3
ксилол
|  CH=CH2
стирол CH=CH2
стирол
|
Прочие моноциклические ароматические углеводороды называют как производные бензола. Положения заместителей указывают цифрами, за исключением случаев, когда при наличии двух заместителей вместо
1,2-; 1,3- и 1,4- могут быть использованы обозначения о- (орто-); м- (мета-); п- (пара-) соответственно:
CH3
 CH3
1,2 – диметилбензол
(о-ксилол)
CH3
1,2 – диметилбензол
(о-ксилол)
|  CH=CH2
CH2–CH3
4-этилстирол
(п-этилстирол) CH=CH2
CH2–CH3
4-этилстирол
(п-этилстирол)
|
Одновалентные радикалы моноциклических ароматических углеводородов:
 фенил-
фенил-
|
| 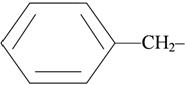 бензил-
бензил-
|
|
 стирил-
стирил-
|
| 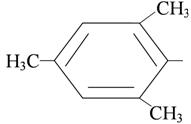 мезитил-
мезитил-
|
|
 n-толил-
n-толил-
|
|
и т.д.
|
Спирты и фенолы
При назывании спиртов по заместительной номенклатуре группа –OH рассматривается как главная и обозначается суффиксом – ол (- диол, - триол, -т етраол и т.д.), нумерация осуществляется с таким расчетом, чтобы группа –OH получила меньший номер:
 пропанол-1
пропанол-1
|
|  бутандиол-1,3
бутандиол-1,3
|
| 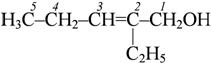 2-этилпентен-2-ол-1
2-этилпентен-2-ол-1
|
|
 циклогексен-2-ол-1
циклогексен-2-ол-1
|
Для некоторых спиртов сохранены тривиальные названия:
CH2=CH–CH2OH - аллиловый спирт
C6H5–CH2OH - бензиловый спирт
 OH
CH2OH - салициловый спирт OH
CH2OH - салициловый спирт
|
CH2 (OH)–CH2OH - этиленгликоль
CH2 (OH) – CH (OH)–CH2OH - глицерин
Для простых фенолов сохранены тривиальные названия:
OH
 фенол
фенол
| OH
 CH3
о-,м-, н-крезолы
CH3
о-,м-, н-крезолы
| CH3
 OH
OH
  CH
CH3 CH3
тимол CH
CH3 CH3
тимол
|
OH
 OH
пирокатехин
OH
пирокатехин
| OH
 OH
резорцин
OH
резорцин
| OH
 OH
гидрохинон
OH
гидрохинон
|
OH
 HO OH
пирогаллол
HO OH
пирогаллол
| OH
 HO OH
флороглюцин
HO OH
флороглюцин
|
Карбоновые кислоты
Карбоксильная группа в молекулах алифатических кислот должна получать наименьший номер и обозначается она суффиксом – овая кислота:
 гептандиовая кислота
гептандиовая кислота
|
 2,3-диметилгексановая кислота
2,3-диметилгексановая кислота
|
Если группа –COOH рассматривается как заместитель (и не входит в родоначальную структуру), то она получает название – карбоновая кислота:
 2-метилциклогексанкарбоновая кислота
2-метилциклогексанкарбоновая кислота
|
Карбоксигруппу обозначают приставкой карбокси - если в соединении присутствует другая группа, имеющая преимущество в перечислении:
 п-карбоксифенилуксусная кислота
п-карбоксифенилуксусная кислота
|
1.3. Электронное строение органических соединений
В составе органических соединений чаще всего находят следующие элементы: C, O, H, N, S, P, которые получили название элементов – органогенов.
Электронное состояние углерода (невозбужденное) – 1S2 2S2 2P2, при переходе в возбужденное состояние - 1S2 2S1 2P3.
Интерес представляют S и P орбитали, поскольку валентные электроны углерода и элементов-органогенов находятся на них.

Гибридизация орбиталей – смешение нескольких атомных орбиталей различной формы и близкой энергии с образованием такого же числа новых гибридных орбиталей, расположение которых в пространстве соответствует геометрии молекулы. Гибридные орбитали за счет более эффективного перекрывания образуют более прочные связи по сравнению с негибридными.
В органических соединениях углерод может находиться в одном из трех валентных состояний:
I валентное состояние – sp3-гибридизация, при которой происходит смешивание I S и 3 p-орбиталей, с возникновением 4-х гибридизованных орбиталей, расположенных в пространстве под углом 109º28´ по отношению друг к другу. Углерод в таком состоянии получил название тетрагонального атома углерода и встречается в предельных органических соединениях.

sp3-гибридные орбитали направлены в пространстве к вершинам тетраэдра (тетраэдрическая конфигурация).
II валентное состояние – sp2-гибридизация, при которой происходит смешивание I S и 2 p-орбиталей, с возникновением 3-х гибридизованных орбиталей, расположенных в одной плоскости под углом 120º по отношению друг к другу. Негибридизованная p-орбиталь расположена перпендикулярно плоскости гибридизованных орбиталей. Углерод в таком состоянии называют тригональным и встречается он в соединениях с двойными связями (атом C в алкенах, карбонильной и карбоксильной группах).

III валентное состояние – sp-гибридизация, при которой происходит смешивание I S и 1p-орбитали с возникновением 2-х гибридизованых орбиталей, расположенных в пространстве под углом 180º (линейно), а две негибридизованые p-орбитали расположены взаимно перпендикулярно друг другу. Sp-гибридизация характерна для углерода, связанного тройной связью или двумя двойными связями.

Если углерод образует одну углерод-углеродную связь, то его называют первичным, если две углерод-углеродные связи − то вторичным; если три углерод-углеродные связи – то третичным; если четыре углерод-углеродные связи – то четвертичным.
Например:
1-й и 5-й углероды – первичные; 4-й – вторичный; 3-й – третичный;
2-ой – четвертичный.
Кратные связи

Сопряжение
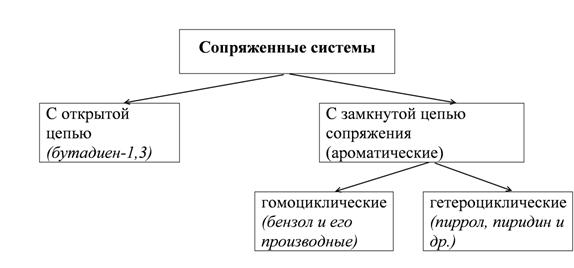
Молекулы с чередующимися двойными π и простыми σ связями называют сопряженными системами.
Сопряжение – это перераспределение электронной плотности в системе π – связей, приводящее к стабилизации молекулы.
Энергия сопряжения – это уменьшение энергии молекулы благодаря сопряжению.
Открытые системы сопряжения
Бутадиен-1,3, каждый из четырех углеродов в состоянии sp2-гибридизации, у каждого углерода – по одной свободной p-орбитали. В результате бокового перекрывания орбиталей происходит сопряжение двух локализованных двойных связей с образованием делокализованной четырехцентровой молекулярной орбитали. Этот вид сопряжения называют π-π-сопряжение. Есопряж. = 250 кДж/моль – 235 кДж/моль = 15 кДж/моль. Наблюдается выравненность электронных плотностей в результате делокализации электронов, создание единого электронного облака.
Делокализация электронов в циклических соединениях приводит к возникновению ароматических систем.
Правила ароматичности.
1. Наличие плоского цикла (кольца), состоящего из sp2-гибридизованных атомов, образующих σ-скелет (молекула копланарна).
2. Делокализация электронов, приводящая к образованию единого электронного облака (π-секстет).
3. Подчинение правилу Э. Хюккеля, т.е. электронное облако должно насчитывать (4n+2) π-электронов, где n=1,2,3,4…
4. Высокая степень термодинамической устойчивости (энергия сопряжения).
Гомоциклические ароматические системы.
 бензол
n=1
6ē делокализовано в
π- секстет
бензол
n=1
6ē делокализовано в
π- секстет
| 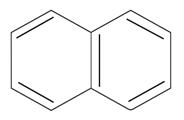 нафталин
n=2
10ē делокализовано
нафталин
n=2
10ē делокализовано
| |
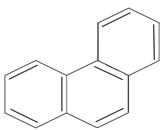 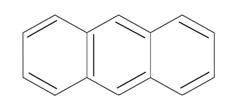 антрацен
фенантрен
n=3 14ē делокализовано
антрацен
фенантрен
n=3 14ē делокализовано
|
Виды изомерии
| структурная
|
| пространственная
|
| · цепи (скелета)
· положения заместителей или кратных связей
· взаимного расположения заместителей в кольце
· межклассовая
|
| · геометрическая
· оптическая (стереоизомерия)
· поворотная
|
Пространственная изомерия
· геометрическая – обусловлена различным расположением заместителей вокруг двойных связей или относительно плоскости циклов).
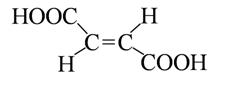 транс-форма
(фумаровая кислота)
транс-форма
(фумаровая кислота)
|
 цис-форма
(малеиновая кислота)
цис-форма
(малеиновая кислота)
|
Это конфигурационные изомеры, которые не могут быть превращены друг в друга без разрыва ковалентных связей.
· Оптическая изомерия
Стереоизомерия связана с различным расположением в пространстве атомов и атомных групп вокруг асимметрического углеродного атома.
Асимметрический атом углерода – это углерод, все четыре валентности которого замещены различными заместителями.
Хиральность – свойство предмета быть неидентичным своему зеркальному отображению (от греч. cheir – рука). Молекулы тоже могут быть хиральными и ахиральными.
Простейший случай хиральности – наличие в молекуле центра хиральности, которым является асимметрический атом углерода.
Вследствие хиральности некоторые молекулы существуют в виде пары стереоизомеров – энантиомеров.
Энантиомеры – это стереоизомеры, относящиеся друг к другу как предмет и его зеркальное отражение, различные по абсолютной и относительной конфигурации, биологическим свойствам, но обладающие одинаковыми физическими и химическими свойствами.
Гомолиз связи
v Образующиеся промежуточные частицы – свободные радикалы
Гетеролитический (ионный)

Гетеролиз связи
v Образующиеся органические промежуточные частицы
- карбокатионы (с положительным зарядом на атоме углерода) или
- карбоанионы (с отрицательным зарядом на атоме углерода)
Классификация реакций
1. По характеру изменения связей в субстрате и реагенте
(а) Гомолитические реакции
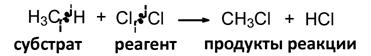
(б) Гетеролитические реакции
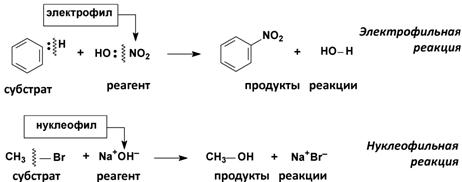
2. По направлению (конечному результату)
v Изменение степени окисления углерода, выступающего в роли
реакционного центра
3. По числу молекул (частиц), участвующих в стадии, определяющей общую скорость реакции
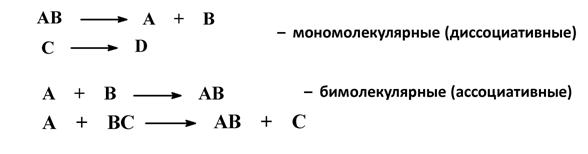
Методики выполнения общих качественных реакций
на функциональные группы
Бромирование бромной водой
В пробирку поместите 2 капли бромной воды, добавьте 2–3 капли исследуемого раствора, встряхните пробирку.
Внешние признаки:
Наблюдается обесцвечивание желтого раствора бромной воды.
2. Реакция гидроксилирования (реакция Вагнера)
В пробирку поместите 2 капли 0,1н KMnO4, добавьте 2–3 капли исследуемого раствора, встряхните пробирку.
Внешние признаки:
Наблюдается обесцвечивание розового раствора KMnO4 и выпадение бурого осадка MnO2.
Углеводы. Моносахариды.
40. Классификация, биологическая роль углеводов. Моносахариды. Стереоизомерия моносахаридов. D- и L-ряды, формулы Фишера. Энантиомерия, диастереомерия, эпимерия. Структура важнейших представителей пентоз и гексоз, производных моносахаридов: дезоксисахаров, аминосахаров.
41. Цикло-оксо (окси- оксо-) − таутомерия моносахаридов. На примере D-глюкозы и D-фруктозы формулы Хеуорса (пиранозы, фуранозы). Аномерия. Конформации моносахаридов, наиболее устойчивые конформации гексоз.
42. Реакционные центры ациклических и циклических форм моносахаридов, нуклеофильное замещение у аномерного центра в циклических формах моносахаридов. Механизм SN. O- и N- гликозиды. Гидролиз гликозидов.
43. Реакции нуклеофильных центров моносахаридов: алкилирование и ацилирование. Гидролиз продуктов. Значение реакций для структурных исследований. Биологически важные фосфаты моносахаридов.
44. Окисление моносахаридов, в кислой нейтральной и щелочной средах, восстановительные свойства альдоз. Гликоновые, гликаровые, гликуроновые кислоты. Реакция эпимеризации моносахаридов, ендиольная форма. Восстановление моносахаридов в глициты (ксилит, сорбит, маннит).
Природные a-аминокислоты.
49. Классификация, стереохимия и строение природных a-аминокислот. Структура природных аминокислот: гидрофобных, гидрофильных, отрицательно и положительно заряженных.
50. Биосинтетические пути образования a-аминокислот из кетонокислот, реакции восстановительного аминирования и переаминирования. Пиридоксалевый катализ. Незаменимые аминокислоты.
51. Кислотно-основные свойства аминокислот, биполярный ион, ионные формы аминокислот в растворах, в зависимости от значения рН, изоэлектрическая точка. (Примеры).
52. Характерные и качественные реакции аминокислот, образование внутрикомплексных солей, нингидриновая, ксантопротеиновая реакции.
53. Реакции, лежащие в основе количественного анализа аминокислот: образование сложных эфиров, реакции с азотистой кислотой, формальдегидом, фенилизотиоцианатом. Реакционные центры, вступающие во взаимодействие, тип и механизм реакции.
54. Метаболизм аминокислот в организме: декарбоксилирование и переход к биогенным аминам, неокислительное и окислительное дезаминирование, трансаминирование. Реакции гидроксилирования.
Омыляемые липиды.
66. Классификация липидов, их биологическое значение. Простые липиды. Нейтральные жиры. Насыщенные и ненасыщенные природные высшие жирные кислоты, входящие в состав липидов. Особенности ненасыщенных жирных кислот. b-окисление высших жирных кислот.
67. Реакционные центры и свойства омыляемых простых и сложных липидов. Щелочной и кислотный гидролиз, реакции присоединения, окисления.
68. Сложные липиды. Фосфолипиды. Глицерофосфолипиды: фосфатидовая кислота, фосфатидилхолины, фосфатидилсерины. Сфингомиелины. Липидный бислой в структуре биологических мембран.
69. Пероксидное окисление фрагментов ненасыщенных жирных кислот в клеточных мембранах, его механизм. Роль пероксидного окисления липидов мембран в действии малых доз радиации на организм. Системы антиоксидантной защиты.
70. Сложные липиды. Гликолипиды: цереброзиды, ганглиозиды, их строение. Свойства, биологическая роль.
Библиографический список
1. Грандберг И. И. Органическая химия: учебник для студентов, обучающихся по агрохимическим специальностям. – М.: Дрофа, 2002. - 672 с.
2. Зурабян С. Е. Основы органической химии. М.: Дрофа, 2006. - 576 с.
3. Оганесян Э. Т. Важнейшие понятия и термины химии: справочное пособие. – М.: Высшая школа, 1993. - 352 с.
4. Проскурина И. К. Биохимия: учебное пособие для студентов высших учебных заведений. – М.: Издательство Владос-Пресс, 2004. - 70 с.
5. Солдатенков А. Т. Основы органической химии лекарственных веществ. М.: Мир; БИНОМ. Лаборатория занятий, 2007. - 191 с.
6. Сорочинская Е. И. Биоорганическая химия. Поли- и гетерофункциональные соединения. Биополимеры и их структурные компоненты. Учебное пособие. – СПб.: Издательство С.Петербургского университета, 1998. - 148 с.
7. Сорочинская Е. И. Биоорганическая химия. Биологически важные классы соединений. Учебное пособие. – СПб: Издательство С.Петербургского университета. - 1998.
8. Тюкавкина Н. А. Биоорганическая химия: учебник для вузов. – М.: Дрофа, 2005. – 542 с.
9. Тюкавкина Н. А. Органическая химия. – м.: Дрофа, 2003. – Кн.1: Основной курс. – 640 с.
О.А. Журавская
ОСНОВЫ БИООРГАНИЧЕСКОЙ ХИМИИ
Учебно-методическое пособие
для студентов медицинских вузов
Самара 2010
УДК
Ж 91
Рецензенты:
– кандидат химических наук, доцент А.А. Данилин;
– кандидат химических наук, доцент О.К. Шаховкина.
Журавская О.А. Основы биоорганической химии:Учебно-методическое пособие для студентов медицинских вузов. – Самара, НОУ ВПО «Самарский медицинский институт «РеаВиЗ», 2010 − 52 с.
Изучение биоорганической химии в медицинских вузах связано с усвоением большого объема материала при малом количестве аудиторных часов.
В учебном пособии изложены ключевые моменты биоорганической химии, материал представлен в текстуальной форме, таблицах, схемах и рисунках, что позволяет оптимизировать процесс запоминания.
Пособие предназначено для студентов медицинских вузов, обучающихся по специальностям «Лечебное дело» и «Стоматология» очной и очно-заочной формы обучения.
© НОУ ВПО СМИ «РеаВиЗ», 2010



 Объекты биоорганической химии
Объекты биоорганической химии C
C CH– изопропил-
CH– изопропил- 2,3,5 – триметилпентан
2,3,5 – триметилпентан
 3,3 – диметил – 4 – этилгептан
3,3 – диметил – 4 – этилгептан
 3,4 – диметилгексен -1
3,4 – диметилгексен -1
 4,6-диметил-3-этилгептин-1
4,6-диметил-3-этилгептин-1
 пентен-1-ин-4
пентен-1-ин-4
 циклогексен
циклогексен
 циклопропил- циклобутил- циклопентил-
циклопропил- циклобутил- циклопентил-
 бензол
бензол
 толуол
толуол
 CH3
ксилол
CH3
ксилол
 CH=CH2
стирол
CH=CH2
стирол
 CH3
1,2 – диметилбензол
(о-ксилол)
CH3
1,2 – диметилбензол
(о-ксилол)
 CH=CH2
CH2–CH3
4-этилстирол
(п-этилстирол)
CH=CH2
CH2–CH3
4-этилстирол
(п-этилстирол)
 фенил-
фенил-
 бензил-
бензил-
 стирил-
стирил-
 мезитил-
мезитил-
 n-толил-
n-толил-
 пропанол-1
пропанол-1
 бутандиол-1,3
бутандиол-1,3
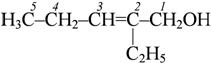 2-этилпентен-2-ол-1
2-этилпентен-2-ол-1
 циклогексен-2-ол-1
циклогексен-2-ол-1
 OH
CH2OH - салициловый спирт
OH
CH2OH - салициловый спирт
 фенол
фенол
 CH3
о-,м-, н-крезолы
CH3
о-,м-, н-крезолы
 OH
OH

 OH
пирокатехин
OH
пирокатехин
 OH
резорцин
OH
резорцин
 OH
гидрохинон
OH
гидрохинон
 HO OH
пирогаллол
HO OH
пирогаллол
 HO OH
флороглюцин
HO OH
флороглюцин
 гептандиовая кислота
гептандиовая кислота
 2,3-диметилгексановая кислота
2,3-диметилгексановая кислота
 2-метилциклогексанкарбоновая кислота
2-метилциклогексанкарбоновая кислота
 п-карбоксифенилуксусная кислота
п-карбоксифенилуксусная кислота







 бензол
n=1
6ē делокализовано в
π- секстет
бензол
n=1
6ē делокализовано в
π- секстет
 нафталин
n=2
10ē делокализовано
нафталин
n=2
10ē делокализовано

 антрацен
фенантрен
n=3 14ē делокализовано
антрацен
фенантрен
n=3 14ē делокализовано


 бутен-2-диовая кислота
бутен-2-диовая кислота
 транс-форма
(фумаровая кислота)
транс-форма
(фумаровая кислота)
 цис-форма
(малеиновая кислота)
цис-форма
(малеиновая кислота)








