Основные понятия и законы химии
Химический элемент – совокупность атомов с одинаковым зарядом ядра.
Атом - электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Молекула - это наименьшая частица вещества, обладающая его химическими свойствами
Относительная атомная масса (Ar) – это отношение средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C.
Относительная молекулярная масса (Mr) — величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Моль – это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится атомов в 12 г изотопа углерода 12С.
Молярная масса (M) показывает массу 1 моля вещества и равна отношению массы вещества к соответствующему количеству вещества.
Молярный объем газа равен 22,4 л/моль.
Закон сохранения массы – масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения энергии – при любых взаимодействиях, имеющих место в изолированной системе, энергия этой системы остается постоянной, и возможны лишь переходы одного вида энергии в другой в эквивалентных соотношениях.
Законы сохранения массы и энергии были открыты и экспериментально подтверждены М.В. Ломоносовым.
Закон постоянства состава – любые химически индивидуальные соединения имеют один и тот же количественный состав независимо от способа его получения.
Закон Авогадро – в равных объемах любых газов при одинаковых условиях содержится одно и то же число молекул. В газах расстояния между отдельными молекулами настолько велики, что собственный размер молекул практически не влияет на общий объем газа. На практике широко применяется следствие из закона Авогадро – один моль любого газа при нормальных условиях (0 оС, 1 атм) занимает объем 22,4 л (мольный объем).
Закон эквивалентов – числа моль эквивалентов всех веществ, участвующих и образующихся в реакции, одинаковы.
Для уравнения реакции, записанного в общем виде аА + вВ = сС, выполняется следующее соотношение:
n[fэкв.(А)А] = n[fэкв.(В)В] = n[fэкв.(С)С]
На практике широко применяются следствия из закона эквивалентов:
1) Массы реагирующих веществ прямо пропорциональны молярным массам эквивалентов этих веществ:
2) Объемы реагирующих веществ обратно пропорциональны их нормальным концентрациям:
В 1803 г Д.Дальтон открыл Закон кратных отношений, заключающийся в том, что если два химических элемента образуют несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же весовую долю второго элемента, относятся между собой как небольшие целые числа.
В 1808 г Гей-Люссак сформулировал Закон объемных отношений:
«Объемы газов, вступающих в химические реакции, и объемы газов, являющихся продуктами реакции, соотносятся между собой как небольшие целые числа».
закон Гей-Люссака при P = const: V1 / T1 = V2 / T2;
закон Бойля-Мариотта при Т= const:P1V1 = P2V2;
закон Шарля при V = const:P1 / T1 = P2 / T2
При объединении этих трех законов получаем: P1V1 / T1 = P2V2 / T2
Если условия отличаются от нормальных, то применяют уравнение Клапейрона – Менделеева: pV = nRT = (m/M)RT
Строение вещества.
2.1
Атом – наименьшая частица химического элемента является носителем его хим. свойств.
Атом состоит из положительно заряженного ядра, в состав которого входят протоны и нейтроны и отрицательно заряженные электроны.
Электрон имеет двойственную (корпускулярно-волновую) природу. Благодаря волновым свойствам электроны в атоме могут иметь только строго определенные значения энергии, которые зависят от расстояния до ядра. Электроны, обладающие близкими значениями энергии образуют энергетический уровень. Он содержит строго определенное число электронов - максимально 2n2. Энергетические уровни подразделяются на s-, p-, d- и f- подуровни; их число равно номеру уровня.  кг [1] — масса электрона.
кг [1] — масса электрона.  Кл [1] — заряд электрона.
Кл [1] — заряд электрона.
Нейтрон — элементарная частица, не имеющая электрического заряда. Нейтрон является фермионом и принадлежит к классу барионов. Атомные ядра состоят из нейтронов и протонов. Нейтрон (n) – нейтральная частица с массой покоя mn = 1,675·10–27кг = 1839 me, нулевой заряд.
Протоны (вместе с нейтронами) являются основными составляющими атомных ядер. Порядковый номер химического элемента в периодической таблице (и, соответственно, все его химические свойства) полностью определяются зарядом ядра его атомов, который, в свою очередь, равен количеству протонов в ядре (протонному числу). Протон имеет положительный заряд е+=1,06·10–19 Кл и массу покоя mp = 1,673·10–27кг = 1836 me
Заряд ядра атома элемента равен количеству протонов в ядре и определяется порядковым номером элемента в периодической системе. En=A-Z(кол-во нейтронов), где А-атомная масса Z-порядковый номер элемента A=E(1Р++1n0) (масса ядра атома) Число протонов = числу n0(нейтронов)
Квантовое излучение и поглощение энергии
Лучистая энергия испускается и поглощается телами не непрерывно, а дискретно, то есть отдельными порциями или квантами. При этом энергия каждой такой порции и связана с частотой излучения соотношением, получившим название уравнения ПланкаE=hv (h-постоянная планка =6,62 на 10 в минус 34
Атомные спектры состоят из отдельных спектральных линий. Каждая спектральная линия характеризуется определенной частотой колебаний света и соответствует строго определенному энергетическому квантовому переходу между различными уровнями энергии:
h= Е2 – Е1.
Атомные спектры возникают при переходах между энергетическими уровнями внешних электронов атомов.
Каждому элементу отвечает свой спектр, т.е. каждому виду атомов присущ свой характеризующий его прерывистый (дискретный) ряд значений внутренней энергии. Отсюда следует невозможность для атома непрерывно изменять свое состояние и в связи с этим невозможность как поглощать, так и испускать энергию любыми, в том числе бесконечно малыми, порциями.
Атом элемента, поглотив энергию, через некоторый очень короткий промежуток времени снова самопроизвольно возвращается в первоначальное состояние, излучая поглощенную энергию в количестве одного кванта (h), т.е. энергии, соответствующей определенной частоте или длине волны.
2.2
Квантовая механика – раздел теоретической физики, описывающий квантовые системы и законы их движения.
 Уравнение де-Бройля
Уравнение де-Бройля
Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна. Подобно частице электрон обладает определенной массой и зарядом, в то же время движущийся электрон проявляет волновые свойства (например, характеризуется способностью к дифракции). Длина волны электрона λ и его скорость V связаны соотношением де Бройля:
λ = h / mV,
2.3
Периодическая система - графическое выражение периодического закона.
Атом состоит из атомного ядра и электронной оболочки.
Ядро атома состоит из протонов (p+) и нейтронов (n 0). У большинства атомов водорода ядро состоит из одного протона.
Число протонов N (p+) равно заряду ядра (Z) и порядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов).
N (p +) = Z
Сумма числа нейтронов N (n 0), обозначаемого просто буквой N, и числа протонов Z называется массовым числом и обозначается буквой А.
A = Z + N
Электронная оболочка атома состоит из движущихся вокруг ядра электронов (е -).
Число электронов N (e -) в электронной оболочке нейтрального атома равно числу протонов Z в его ядре.
2.4
Периодический закон Д. И. Менделеева является теоретической основой неорганической химии, изучающей все химические элементы и их соединения, кроме соединений углерода, которыми занимается органическая химия.
Физический смысл порядкового номера – показывает заряд ядра атома и равен количеству протонов в ядре атома и общему числу электронов в атоме.
Современная формулировка периодическогозакона следующая: свойство элементов, а также формы и свойства их соединенийнаходятся в периодической зависимости от з аряда ядра их атомов.
2.5
Порядок заполнения атомных орбиталей можно представить следующей таблицей (читается по строчкам сверху вниз, каждая строчка читается слева направо).
1s
2s
2p 3s
3p 4s
3d 4p 5s
4d 5p 6s
4f 5d 6p 7s
5f 6d 7p 8s
Или
s→2s→2p→3s→3p→4s  3d→4p→5s
3d→4p→5s  4d→5p→6s
4d→5p→6s  5d→4f→5d→6p→7s
5d→4f→5d→6p→7s  6d→5f→6d→7p
6d→5f→6d→7p
2.6
Период – это последовательный горизонтальный ряд элементов с одинаковым значением главного квантового числа.
Группа – это вертикальный ряд элементов с одинаковым количеством валентных электронов.
Элементы одной группы разделяются на две подгруппы: главную и побочную. В главной подгруппе объединяются элементы, у которых валентные электроны располагаются наs- иp- подуровнях внешнего квантового уровня. В побочную подгруппу – элементы, у которых валентные электроны располагаются на внешнемs- и предвнешнемd-подуровнях.
Все элементы разделяются на 4 электронных семейства.
s-Элементы (элементы s-семейства) — это элементы, в атомах которых последним заполняется s-подуровень внешнего электронного слоя.
Первые два элемента каждого периода — это s- элементы. Они составляют главные подгруппы I и IIгрупп.
р-Элементы (элементы р-семейства) — это элементы, в атомах которых, последним заполняется р-подуровень внешнего электронного слоя.
В каждом периоде (кроме первого и седьмого) имеется шесть р-элементов; они находятся в конце периода. р-Элементы составляют главные подгруппы III—VIIIгрупп.
d-Элементы (элементы d-семейства) — это элементы, в атомах которых последним заполняется d-подуровень предвнешнего электронного слоя.
О Побочная подгруппа — это вертикальный ряд d-элементов, которые имеют одинаковое суммарное число электронов на d-подуровне предвнешнего слоя и s-подуровне внешнего слоя. Это число обычно равно номеру группы.
Например:
Побочная подгруппа IV группы 22Ti ls22s2 2p63s23p6 4s23d2
4е
Побочная подгруппа VI группы 24Cr ls22s2 2p63s23p 6 4s13d 5
6е
f-Элементы (элементы f -семейства) — это элементы ватомах которых последним заполняется f -подуровень третьего снаружи электронного слоя.
f -Элементы находятся в VI и VII периодах Каждый из этих периодов содержит 14 f -элементов. f -Элементами являются лантаноиды и актиноиды, которые располагаются в нижней части периодической системы.
Химические элементы, у которых имеется одинаковая конфигурация валентных электронов, называются электронными аналогами.
У полных аналогов совпадают электронные конфигурации двух последних периодов.
Электронные аналоги, являющиеся химическими аналогами, характеризуются одинаковым количеством валентных электронов, которые участвуют в образовании химических связей.
2.7
. Непериодические свойства химических элементов связаны с ядрами атомов - это заряд ядра, число электронов, масса атомов, стабильность или радиоактивность химических элементов. Периодичность электронного строения проявляется в том, что через определенное число элементов в периодической системе повторяются s-элементы,p-элементы, d-элементы с одинаковыми конфигурациями электронных подуровней. Это влечет за собой периодическое изменение химических и физических свойств элементов.
Периодические свойства химических элементов связаны с электронным строением атомов и с характером заполнения электронных слоев. Основные характеристики атомов элементов являются периодическими свойствами - это радиус атома, энергия ионизации, энергия сродства к электрону, относительная электроотрицательность
Периодические свойства элементов:
- Радиус атома и атомный объем.
- Потенциал ионизации.
- Сродство к электрону.
- Электроотрицательность атома.
- Степени окисления.
- Физические свойства соединений (плотность, температуры плавления и кипения).
Характеристики химических элементов закономерно изменяются в группах и периодах.
В периодах (с увеличением порядкового номера)
- увеличивается заряд ядра,
- увеличивается число внешних электронов,
- уменьшается радиус атомов,
- увеличивается прочность связи электронов с ядром (энергия ионизации),
- увеличивается электроотрицательность,
- усиливаются окислительные свойства простых веществ ("неметалличность"),
- ослабевают восстановительные свойства простых веществ ("металличность"),
- ослабевает основный характер гидроксидов и соответствующих оксидов,
- возрастает кислотный характер гидроксидов и соответствующих оксидов.
В группах (с увеличением порядкового номера)
- увеличивается заряд ядра,
- увеличивается радиус атомов (только в А-группах),
- уменьшается прочность связи электронов с ядром (энергия ионизации; только в А-группах),
- уменьшается электроотрицательность (только в А-группах),
- ослабевают окислительные свойства простых веществ ("неметалличность"; только в А-группах),
- усиливаются восстановительные свойства простых веществ ("металличность"; только в А-группах),
- возрастает основный характер гидроксидов и соответствующих оксидов (только в А-группах),
- ослабевает кислотный характер гидроксидов и соответствующих оксидов (только в А-группах),
- снижается устойчивость водородных соединений (повышается их восстановительная активность; только в А-группах).
Очень важной характеристикой элемента с точки зрения строения атома является радиус атома. С ростом положительного заряда ядра радиус у элементов изменяется. В периоде слева направо радиус уменьшается вследствие сжатия электронной оболочки (заряд ядра увеличивается, электроны сильнее притягиваются к ядру). В группах сверху вниз радиус увеличивается вследствие увеличения количества квантовых уровней. Чем больше радиус атома, тем слабее удерживаются валентные электроны, тем легче отдает их атом в химических реакциях. Как отдача электронов, так и принятие электронов характеризуются энергетическим эффектом, который определяется тремя видами энергии:
- энергия ионизации (J) – энергия, которая необходима для отрыва валентных электронов от атома и превращения атома в положительно заряженную частицу – ион. Она измеряется в эВ/атом или кДж/моль.
Энергия ионизации зависит от радиуса атома. С увеличением радиуса энергия ионизации уменьшается в группе сверху вниз, увеличивается в периоде с ростом количества валентных электронов. Энергия ионизации характеризует металлические (восстановительные) свойства, его активность. Чем больше величина энергии ионизации, тем меньше металлические свойства;
- энергия сродства к электрону (Е) – энергия (единицы измерения эВ/атом или кДж/моль), которая выделяется при присоединении валентных электронов к атому, при этом атом превращается в отрицательно заряженную частицу. Эта энергия характеризует неметаллические (окислительные) свойства химических элементов; в группе сверху вниз уменьшается, в периоде увеличивается;
- электроотрицательность – это полусумма энергии ионизации и энергии сродства к электрону: Э.О. = (I+E) / 2. Электроотрицательность – способность атома в молекуле притягивать к себе электроны. За единицу принята элетроотрицательностьлитияLi. В группе электроотрицательностьуменьшаетсяcверху вниз, в периоде увеличивается слева направо. Зная значение энергии для каждого из атомов, мы можем дать окислительно-восстановительную характеристику элемента. (Значения электроотрицательности атомов по Полингу представлены в приложении).
2.8
Вертикальная периодичность заключается в повторяемости свойств простых веществ и соединений в вертикальных столбцах Периодической системы. Это основной вид периодичности, в соответствии с которым все элементы объединены в группы. Элементы одной группы имеет однотипные электронные конфигурации. Химия элементов и их соединений обычно рассматривается на основе этого вида периодичности.
Вертикальная периодичность обнаруживается и в некоторых физических свойствах атомов, например, в энергиях ионизации Ei (кДж/моль):
Горизонтальная периодичность заключается в появлении максимальных и минимальных значений свойств простых веществ и соединений в пределах каждого периода. Она особенно заметна для элементов VIIIБ-группы и лантаноидов (например, лантаноиды с четными порядковыми номерами более распространены, чем с нечетными).
В таких физических свойствах, как энергия ионизации и сродство к электрону, также проявляется горизонтальная периодичность, связанная с периодическим изменением числа электронов на последних энергетических подуровнях.
Диагональная периодичность - повторяемость свойств простых веществ и соединений по диагоналям Периодической системы. Она связана с возрастание неметаллических свойств в периодах слева направо и в группах снизу вверх. Поэтому литий похож на магний, бериллий на алюминий, бор на кремний, углерод на фосфорДиагональную периодичность не следует понимать как абсолютное сходства атомных, молекулярных, термодинамических и других свойств. Та, в своих соединениях атом лития имеет степень окисления (+I), а атом магния - (+II). Однако свойства ионов Li+ и Mg2+ очень близки, проявляясь, в частности, в малой растворимости карбонатов и ортофосфатов.
Вторичная периодичность Многие свойства элементов в группах изменяются не монотонно, а периодически, особенно для элементов IIIA-VIIA-групп. Такое явление носит название вторичной периодичности. Так, германий по своим свойствам больше похож на углерод, чем на кремний. Известно, что силан реагирует с гидроксид-ионами в водном растворе с выделением водорода, а метан и герман не взаимодействуют даже с избытком гидроксид-ионов.
2.9
Энергия связи – энергия, которая выделяется при образовании молекулы из одиночных атомов. Энергия является мерой прочности химической связи. Чем больше энергия связи, тем прочнее связь.
Длина связи – расстояние между центрами ядер атомов в молекуле. Чем меньше длина связи, тем прочнее связь.
Валентные углы – углы между связями, образуемыми одним атомом в молекуле.
2.10
Основные положения метода валентных связей (МВС):
- ковалентная связь образуется за счет перекрывания атомных орбиталей валентных электронов с антипараллельными спинами;
- перекрываются только облака неспаренных валентных электронов;
- в результате взаимодействия электронов в атомах образуется общая электронная пара, возникает единое электронное облако высокой плотности, которое находится между ядрами атомов.
Ковалентная связь - химическая связь, образованная путем обобществления пары электронов двумя атомами.
Различают два механизма образования ковалентных связей: обменный и донорно-акцепторный.
Обменный механизм заключается в том, что каждый из взаимодействующих атомов для образования общих электронных пар предоставляет свои неспаренные электроны.
Донорно-акцепторный механизм заключается в том, что один из атомов – донор- отдает свою пару электна свободную орбиталь другого атома – акцептора. Например: азот – донор, водород – акцептор.
Свойства ковалентной связи:
- насыщаемость характеризует способность атомов элементов образовывать определенное число связей, т.е. показывает состав молекулы. Максимальное число связей определяется количеством неспаренных электронов и наличием свободных орбиталей. Число неспаренных валентных электронов при обменном механизме является мерой валентности (ковалентности) атома.
Например, молекула аммиака состоит из одного атома азота и трех атомов водорода.
14N: 2s22p3

 1H:1s1
1H:1s1
У атома водорода один неспаренный электрон, у атома азота – три неспаренных валентных электрона. Следовательно, один атом азота может образовать три связи с тремя атомами водорода, образуя молекулу NH3;
- направленность: так как при образовании молекулы происходит перекрывание электронных плотностей, то это перекрывание может идти в двух направлениях:
1  ) По линии связи ядер атомов – это σ-связь
) По линии связи ядер атомов – это σ-связь
а  )
)
б)
s-s
p-p
Для s-облаков характерна только σ-связь.
2) Перпендикулярно линии, связывающей центры ядер – π-связь.
 p-p
p-p
Направленность связи показывает пространственную структуру молекул, их геометрическую форму.
- полярность: ковалентная связь считается полярной (КПС), если образована атомами с разной электроотрицательностьюи неполярной (КНПС) – с одинаковой электроотрицательностью (см. приложение).
Кратность ковалентной связи
Для ковалентной связи возможны случаи, когда два атома в молекуле связаны не одной связью, а двумя и более, то есть образуется не одна общая электронная пара, а несколько. Примером могут служить молекулы N2,O2,CH2=CH2(этилен), ацетилена. При образовании кратных связей одна из них будет σ, а другие π. В первую очередь, образуется σ-связь как более прочная.
2.11
Имея два неспаренных электрона, атом бериллия способен к образованию двух связей по обменному механизму.
Образующиеся связи должны быть разными по энергии, так как электроны находятся на разных подуровнях. Однако экспериментально доказано, что обе связи совершенно одинаковы. Следовательно, при образовании химических связей происходит выравнивание атомных орбиталей по энергии и форме. Этот процесс получил название – гибридизация, а «выровненные» орбитали называют гибридными.
Случай гибридизации одной s- и однойp- орбиталиназывается sp-гибридизацией.
Для sp-гибридизации характерна линейная структура молекулы, валентный угол 180°.Такой вид гибридизации наблюдается у элементовIIгруппы.
При гибридизации одной s- и двухp- орбиталей (sp2-гибридизация) образуются три равноценные гибридные орбитали, которые располагаются под углом 1200в одной плоскости. Такая гибридизация характерна для элементовIIIгруппы.
В sp3-гибридизация участвуют однаs- и триp- орбитали, в результате образуются четыре гибридные орбитали. Данный тип гибридизации характерен для элементовIVгруппы.
Таким образом, основные положения теории гибридизации:
- В гибридизации участвуют орбитали разных подуровней одного уровня.
- Число гибридных орбиталей равно числу чистых орбиталей, участвующих в гибридизации.
- Гибридные орбитали более вытянуты в направлении образования химических связей и поэтому обеспечивают лучшее перекрывание электронных облаков.
При образовании связи между двумя атомами с одинаковой электроотрицательностью (см. приложение) общая электронная пара располагается симметрично - неполярная связь.
Например: Cl2, Н2, О2 и т.д.
Если связь неполярная, то и молекула будет неполярной.
Смещение электронного облака называется поляризацией и обуславливает свойство, называемое поляризуемостью.
Полярная ковалентная связь возникает при соединении атомов с различной электроотрицательностью.
Например: молекулу HClобразуют атом хлора с элетроотрицательностью, равной 3, и атом водорода с электроотрицательностью 2,1(см. приложение) – полярная связь. Происходит смещение электронного облака ближе к атому с наибольшей электроотрицательностью и молекула приобретает два полюса. Часть молекулы, куда смещается электронное облако, заряжается отрицательно, а другая положительно. В этом случае образуется диполь. Такая система, имеющая одинаковые по величине, но противоположные по знаку заряды, находящиеся на некотором расстоянии друг от друга, называется диполем. Чем сильнее поляризация, тем длина диполя больше.
Полярность молекулы определяется дипольным моментом, который равен μ = δ•ℓ, где δ - заряд, измеренный в единицах заряда электрона, ℓ – длина диполя. Единицей измерения дипольного момента являются кулон·метр (Кл·м) или Дебай (D).
1D= 4,8·10-18эл. ст. ед.·см. = 0,33 ·10-29Кл·м
По величине дипольного момента можно судить о степени поляризуемости. В настоящий момент для большинства молекул величина дипольного момента известна.
Например: HF→1,22D;HCl→1,07D;HBr→ 0,79D;HI→0,38D.
В многоатомных молекулах дипольный момент μ определяем числом полярных связей и их направленностью. Для этого находим векторную сумму отдельных связей по правилу параллелограмма. Вектором обозначим смещение электронной плотности.
Например: в молекуле H2O
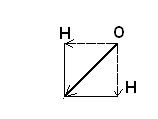
Суммарный вектор не равен 0, значит, молекула H2Oполярна и существует в виде диполя.
В случае sp,sp2,sp3гибридизации образуются чаще всего симметричные неполярные молекулы.
По методу МВС электронная структура молекулы выглядит как набор различных валентных схем (метод локализованных пар). Но исследования показывают что всегда локализованными являются только σ-связи. При наличии π-связей может иметь место делокализация. Нелокализованная химическая связь ― связующая электронная пара одновременно принадлежит более чем двум атомным ядрам.
2.12
Ионная связь – возникает между разноимённо заряженными частицами – ионами в результате действия электростатических сил притяжения.
Так как ион может притягивать к себе ионы противоположного знака в любом направлении, ионная связь в отличие от ковалентной отличается ненаправленностью.
Взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. Поэтому они могут притягивать и другие ионы противоположного знака, то есть ионная связь отличается ненасыщенностью.
Так как электронные плотности атомов и ионов простираются на значительные расстояния от ядер и имеют заметные значения за пределами их эффективных радиусов, то при образовании любой химической связи обязательно имеет место перекрывание облаков, то есть связь не может быть чисто ионной.
Каждый ион можно характеризовать его поляризующим действием, которое зависит от напряженности создаваемого им электрического поля, пропорционального отношению заряда к радиусу (q / r - ионный потенциал), и поляризуемостью, то есть способностью их к деформации _ a (измеряется в единицах объема х10-24 см3). Качественные правила, характеризующие поляризацию ионов, сформулированы К. Фаянсом в 1923 г.
1. Поляризация тем больше, чем меньше размер катиона и больше его заряд, то есть чем больше ионный потенциал ( ).
).
Поляризующая способность сильно растет с зарядом. Поэтому катионы с большим зарядом (B3+, Si 4+, P5+) образуют только ковалентные соединения. Видно, что по ионному потенциалу элементы более близки в диагональном направлении периодической таблицы: Li+ и Mg2+, Be2+ и Al3+ и т.д.
2. Поляризация тем больше, чем больше отрицательный заряд аниона и больше его радиус; многозарядные анионы по этой причине образуют только ковалентные соединения (P3-, As3-).
 3. Поляризация катионов больше, если у них внешние электроны не имеют конфигурации благородного газа (s2р6), а имеют конфигурацию (n - 1)d x ns0 (где х от 1 до 10).
3. Поляризация катионов больше, если у них внешние электроны не имеют конфигурации благородного газа (s2р6), а имеют конфигурацию (n - 1)d x ns0 (где х от 1 до 10).
Формула Льюиса
- Определяем какие атомы образуют связи
- Определяем количество всех валентных электронов
- Помещаем по 2 электрона для каждой связи
- Завершаем «строение» молекулы добавлением электронных пар так, чтобы центральный атом имел октет
2.13
Дисперсионное притяжение возникает в результате мгновенных флуктуаций электронной плотности в молекулах. Электронные облака искажаются, что приводит к появлению в молекуле мгновенного диполя, который способен индуцировать диполь в соседней молекуле.
Если вещество состоит из полярных молекул (вода), то они ориентируются по отношению друг к другу своими разноименно заряженными концами, вследствие чего возникает их взаимное притяжение. Такое взаимодействие называется ориентационным. В случае неполярных молекул (CO2) возникают наведенные (индуцированные) диполи. Их возникновение обусловлено электрическим полем атома, оказывающим поляризующее действие на ближайший атом соседней молекулы. Это индукционное взаимодействие наблюдается и у веществ с полярными молекулами. Но оно слабее ориентационного. Движение электронов и колебание ядер вызывает появление мгновенных диполей. Они возникают в твердых телах и жидкостях согласованно, причем концы соседних молекул оказываются заряженными электричеством противоположного знака, что приводит к взаимному притяжению. Это явление называется дисперсионным взаимодействием. Оно имеет место во всех веществах, находящихся в конденсированном состоянии. Чем слабее связаны с ядром внешние электроны, то есть чем крупнее атомы, тем значительнее дисперсионные силы. В случае HCl на долю дисперсионных сил приходится 81% величины всех сил межмолекулярного взаимодействия, а в случае HJ - 99,5%.
Если одна из двух молекул имеет атом со свободными орбиталями, а другая - атом с парой неподеленных электронов, то между ними происходит донорно-акцепторное взаимодействие, которое приводит к образованию ковалентной связи, например:
NH3 + BF3 = NH3 * BF3
У атома азота в молекуле аммиака имеется неподеленная пара электронов, а у атома бора в молекуле трифторида бора - вакантная орбиталь.
При взаимодействии по донорно-акцепторному механизму атом азота отдает на связь пару электронов, а атом бора - вакантную орбиталь, в результате чего возникает ковалентная связь.
Водородная связь
Водородная связь
Ее образование обусловлено тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S).
Влияние водородной связи
Водородные связи влияют на физические (т.кип. и т.пл., летучесть, вязкость, спектральные характеристики) и химические (кислотно-основные) свойства соединений.
Межмолекулярные водородные связи обусловливают ассоциацию молекул, что приводит к повышению температур кипения и плавления вещества. Например, этиловый спирт C2H5OH, способный к ассоциации, кипит при +78,3°С, а диметиловый эфир СН3ОСН3, не образующий водородных связей, лишь при 24°С (молекулярная формула обоих веществ С2Н6О).
Образование Н-связей с молекулами растворителя способствует улучшению растворимости. Так, метиловый и этиловый спирты (CH3OH, С2Н5ОН), образуя Н-связи с молекулами воды, неограниченно в ней растворяются.
Внутримолекулярная водородная связь образуется при благоприятном пространственном расположении в молекуле соответствующих групп атомов и специфически влияет на свойства. Например, Н-связь внутри молекул салициловой кислоты повышает ее кислотность
Химическая связь, образованная положительно заряженным водородом молекулы (или полярной группы) и электроотрицательным атомом другой или той же молекулы, называется водородной связью.
Если водородная связь образуется между разными молекулами, она называется межмолекулярной, если связь образуется между двумя группами одной и той же молекулы, то она называется внутримолекулярной. Водородная связь между молекулами А–Н и В–R обозначается тремя точками ···.
А–Н + В–R = А–Н ··· В–R
водород в данном случае образует две химические связи, причем они не равноценны.
Образование водородной связи обусловлено тем, что в полярных молекулах А – Н или полярных группах –А – Н поляризованный атом водорода обладает уникальными свойствами: отсутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома.
Атомы могут быть одинаковыми, как при взаимодействии НF
Fδ‾–Нδ+ + Fδ‾–Нδ+ = F–Н···F–Н,
но могут быть и разными, как при взаимодействии воды и фтороводорода

2.15
Конденсированное состояние - понятие, объединяющее твёрдые тела и жидкости в противопоставлении их газу. Атомные частицы (атомы, молекулы, ионы) в конденсированном теле связаны между собой. Ср. энергии теплового движения частиц не хватает на самопроизвольный разрыв связи, поэтому конденсированное тело сохраняет свой объём. Мерой связи атомных частиц служит теплота испарения (в жидкости) и теплота возгонки (в твёрдом теле).
В отличие от газообразного состояния, у вещества в конденсированном состоянии существует упорядоченность в расположении частиц (ионов, атомов, молекул). Кристаллические твёрдые тела обладают высокой степенью упорядоченности - дальним порядком в расположении частиц. Частицы жидкостей и аморфных твёрдых тел располагаются более хаотично, для них характерен ближний порядок. Свойства веществ в конденсированном состоянии определяются их структурой и взаимодействием частиц.
Вещество может находиться в зависимости от температуры и давления в газообразном, жидком, твердом и плазменном состояниях.
В газообразном состоянии вещество существует в виде молекул, находящихся в непрерывном движении, и характеризуется малой величиной межмолекулярного взаимодействия и значительной в



 кг [1] — масса электрона.
кг [1] — масса электрона.  Кл [1] — заряд электрона.
Кл [1] — заряд электрона. Уравнение де-Бройля
Уравнение де-Бройля 3d→4p→5s
3d→4p→5s 



 1H:1s1
1H:1s1 ) По линии связи ядер атомов – это σ-связь
) По линии связи ядер атомов – это σ-связь )
) p-p
p-p
 ).
). 3. Поляризация катионов больше, если у них внешние электроны не имеют конфигурации благородного газа (s2р6), а имеют конфигурацию (n - 1)d x ns0 (где х от 1 до 10).
3. Поляризация катионов больше, если у них внешние электроны не имеют конфигурации благородного газа (s2р6), а имеют конфигурацию (n - 1)d x ns0 (где х от 1 до 10).



