Цель: сформировать знания о строении и свойствах галогенопроизводных углеводородов.
Вопросы для обсуждения:
1.Галогенопроизводные, их классификация и номенклатура.
2. Особенности строения и реакционные центры галогенопроизводных.
3. Реакции нуклеофильного замещения. Механизмы SN1 и SN2.
4. Реакции элиминирования (отщепления) Е1 и Е2. Правило Зайцева.
5. Взаимодействие с металлами (с реактивом Гриньяра, металлическим натрием).
6. Восстановление галогенпроизводных.
7. Реакции электрофильного присоединения непредельных галогенопроизводных.
8. Реакции электрофильного замещения в ароматическом ряду.
Материалы и примеры для самостоятельного изучения
Пример 1. Сравните механизмы реакций SN 1 и SN 2.
Решение. Каждый из этих механизмов в чистом виде встречается очень редко. Реакционная способность в SN2-реакции уменьшается при переходе от СН3-Х к первичным RCH2-X, для вторичных - она гораздо меньше и появляется значительный вклад SN1-реакций. При переходе от вторичных к третичным галогеналканам реакционная способность в SN1-реакции резко возрастает.

Изменяя условия протекания реакций, можно направить процесс преимущественно по тому или иному механизму.
Влияние условий реакции на относительное значение двух механизмов
| Механизм
| Растворитель
| Сила нуклеофила
| Концентрация
нуклеофила
|
| SN1
| Протонный
| Более слабый
| Меньшая
|
| SN2
| Апротонный
| Более сильный
| Бóльшая
|
Пример 2. Сравните реакции нуклеофильного замещения и элиминирования.
Решение. В реакциях замещения донор электронной пары отдает свою пару электронов атому углерода Сa, связанному с галогеном - в этом случае он является нуклеофилом. Тот же донор электронов может отдавать свою электронную пару атому водорода, связанному с Сb - в этом случае он является основанием в реакциях элиминирования.

Реакции элиминирования и нуклеофильного замещения в этом случае являются конкурирующими. При переходе от первичных ко вторичным и далее третичным галогеналканам элиминирование происходит все в большей степени.

Cильные основания в большей степени способствуют элиминированию. Выход продуктов элиминирования увеличивается за счет продуктов замещения также с повышением температуры.
Пример 3. В чем причина низкой реакционной способности галогенаренов
Решение. Галогенарены не реакционноспособны в реакциях нуклеофильного замещения, которые характерны для галогеналканов. Низкая реакционная способность галогенаренов обусловлена двумя факторами: (1) делокализацией электронов вследствие резонанса и (2) более высокой энергией s -связи.
1. Хлорбензол можно представить как гибрид граничных структур I-V, причем в структурах III, IV и V хлор связан с атомом углерода двойной связью.

Вклад структур III, IV и V показывает, что углерод и хлор связаны более, чем одной парой электронов, следовательно, связь углерод - хлор является не простой, а кратной.
2. В галогеналканах углерод, соединенный с галогеном, находится в sp3 -гибридном состоянии. В галогенаренах атом углерода, связанный с галогеном, находится в sp2 -cостоянии, поэтому связь углерод-галоген в галогенаренах короче и прочнее, чем в галогеналканах.
Подобным же образом можно объяснить низкую реакционную способность винилгалогенидов CH2 = CH-X.

Задачи для самостоятельного решения
Номенклатура и строение
Задача 21.1. Напишите структурные формулы следующих соединений:
а) 2-метил-3-хлорбутан;
б) 3-бром-2,4-диметилгексан;
в) 1-бром-4-метил-3-этилгексан;
г) 3-иод-2,5-диметилгексан;
д) 2,6-диметил-3-хлоргептан;
е) изопропилхлорид;
ж) изобутилхлорид;
з) втор-бутилхлорид;
и) трет-бутилхлорид;
к) 1,1,2-трихлорэтан;
л) 1,2,2-трифторпропан;
м) 1,1,1,5-тетрафторпентан;
н) 3-метил-1,2-дихлорпентан.
Задача 21.2. Назовите следующие соединения:

Задача 21.3. Рассмотрите строение молекулы хлорбензола. Опишите взаимное влияние атома хлора и бензольного кольца. Охарактеризуйте связь С—Сl в этом соединении (длина, энергия, полярность). Сравните ее с аналогичными связями в молекулах винилхлорида и этилхлорида. В каком случае разрыв связи С—Сl требует меньшей энергии?
Задача 21.4. Сравните строение молекул n-хлортолуола и хлористого бензила. Охарактеризуйте связи С—Сl. В каком соединении расщепление этой связи с образованием аниона хлора должно происходить легче? Почему?
Химические свойства
Задача 21.5. Напишите уравнения реакции взаимодействия с водным раствором гидроксида натрия а) хлорэтана; б) 2-метил-2-хлорпропана Покажите механизмы этих реакций.
Задача 21.6. Напишите уравнения реакций взаимодействия со спиртовым раствором гидроксида натрияа) хлорэтана; б) 2-метил-2-хлорпропана Рассмотрите механизм реакций Е1 и Е2.
Задача 21.7. Напишите уравнения реакций дегидрогалогенирования со спиртовым раствором щелочи следующих веществ:
а) 2-метил-2-хлорпентан;
б) 2-метил-3-хлорпентан;
в) 3-бром-4-этилгексан;
г) 2-бром-2,3-диметилбутан.
Задача 21.8. Какие металлорганические соединения образуются в качестве промежуточных продуктов в реакциях? а) при взаимодействии иодметана с металлическим натрием (реакция Вюрца); б) при взаимодействии бромбензола с металлическим натрием (реакция Вюрца-Фитгига).
Задача 21.9. Аллилхлорид легко гидролизуется в водном растворе при нагревании. Гидролиз 1-хлоропропана протекает очень медленно и при повышенной температуре. Реакция ускоряется при добавлении в водный раствор 1-хлоропропана щелочи. Винилхлорид в перечисленных условиях не вступает в реакцию гидролиза. Объясните причины различного отношения указанных соединений к гидролизу.
Задача 21.10. Напишите реакции хлорбензола со следующими реагентами: a) H2SO4; б) HNO3 (H2SO4); в) Вг2 (FeBr3); г) СН3СН2Вг (АlВг3); д) СН3СОСl (АlС13). Приведите механизм реакции (в) и охарактеризуйте влияние атома хлора на реакционную способность хлорбензола и направление замещения.
Задача 21.11. Охарактеризуйте влияние электроноакцепторных групп в бензольном кольце на реакционную способность арилгалогенидов в реакциях нуклеофильного замещения. Следующие соединения расположите в порядке возрастания активности атома хлора:
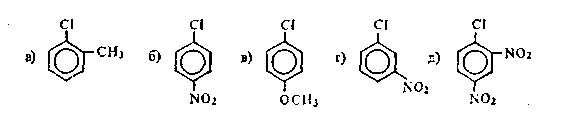
Задача 21.12. На примере реакции бромбензола с азотной кислотой в присутствии серной кислоты объясните, почему галоген в арилгалогенидах оказывает дезактивирующее действие на электрофильное замещение, но является при этом о-, n-ориентантом.
Литература для самостоятельной работы
Органическая химия: Учебник для вузов: В 2 кн./В.Л. Белобородов, С.Э. Зурабян, А.П. Тюкавкина; Под ред. Н.А. Тюкавкиной. - М.: Дрофа, 2002. – Кн. 1: Основной курс. – 620с. (С. 298 – 336)