| Операция
| Уравнения реакций, рисунок
|
| Соберите прибор для получения газа и проверьте его на герметичность. Около 0,2 г испытуемого жидкого или твердого органического вещества смешайте в пробирку с 1-2 г порошка оксида меди (II). Оксид меди (II) необходим для окисления органического вещества. В верхнюю часть пробирки поместите рыхлый комочек ваты с тонким слоем белого порошка, обезвоженного сульфатом меди (II). Пробирку закройте пробкой с газоотводной трубкой, которую опустите в 0,5 мл известковой воды другой пробирки. Пробирку нагрейте над пламенем спиртовки.
При наличии углерода произойдет помутнение известковой воды, а при наличии водорода – посинение безводного сульфата меди (II).
| Уравнения реакций протекающих процессов:
(С.....Н.....) + 3СuO = СО2 + Н2О + 3Сu +........
CuSO4 + 5H2O = CuSO4 × 5H2O
Голубой цвет
СО2 + Са(ОН)2 = СаСО3¯ + Н2О
белый осадок
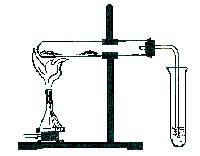 Прибор для открытия углерода и водорода
Прибор для открытия углерода и водорода
|
Проба на присутствие азота (Тяга! Защитные очки!)
| Операция
| Уравнения реакций, рисунок
|
| Для открытия азота 5-10 мг испытуемого вещества поместите в сухую пробирку. Прибавьте к нему небольшой кусочек металлического натрия. Нагрейте осторожно смесь в пламени спиртовки. Проследите, чтобы смесь расплавилась и образовался однородный сплав. Когда пробирка остынет, добавьте в нее 5 капель этилового спирта для устранения остатков металлического натрия, который реагирует со спиртом не так бурно, как с водой. Убедившись, что остаток натрия прореагировал со спиртом (прекращается шипение от выделения пузырьков газа), добавьте в пробирку 5 капель воды и нагрейте ее на пламени спиртовки, чтобы все растворилось. При этом цианистый натрий переходит в раствор, алкоголят же натрия с водой образует едкую щелочь. После этого добавьте в пробирку 1 каплю раствора железного купороса FeSO4, обычно содержащего примесь соли Fe2(SO4)3. В присутствии щелочи немедленно образуется грязно-зеленый осадок гидроксида железа (II) в смеси с желтым осадком гидроксида железа (III). При наличии в растворе избытка цианистого натрия гидроксид железа (II) образует комплекс желтой кровяной соли. Пипеткой нанесите в центр фильтровальной бумаги одну каплю мутной жидкости из пробирки. Как только капля впитается, на ее место нанести одну каплю раствора соляной кислоты. После подкисления осадки гидроксида железа (III) растворяются, и при наличии азота немедленно появляется синее пятно образовавшейся берлинской лазури. При отсутствии азота синего пятна не образуется. В нитросоединениях азот обнаруживается этим путем с трудом
| Уравнения реакций протекающих процессов:
(......CN) + Na = NaCN
2С2Н5ОН + 2Nа =2С2Н5ОNа + Н2
C2H5ONa + H2O = C2H5OH + NaOH
FeSO4 + 2NaOH = Fe(OH)2¯+ Na2SO4
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3¯ + 3Na2SO4
Fe(OH)2 + 2NaCN = Fe(CN)2 + 2NaOH
Fe(CN)2 + 4NaCN = Na4[Fe(CN)6]
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
3Na4[Fe(CN)6] + 4FeCl3 = =Fe4[Fe(CN)6]3 + 12NaCl
 а,б – капли соляной кислоты
а,б – капли соляной кислоты
|
Проба на присутствие серы (Тяга! Защитные очки!)
| Операция
| Уравнения реакций, рисунок
|
| Для открытия серы 5-10 мг испытуемого вещества поместите в сухую пробирку. Добавьте к веществу кусочек металлического натрия. Держа пробирку вертикально, нагрейте смесь докрасна, следя за тем, чтобы натрий плавился не отдельно, а в смеси с веществом, иначе опыт не удастся. Когда пробирка остынет, прибавьте в нее 5 капель этилового спирта для устранения остатка металлического натрия, который со спиртом образует алкоголят натрия. После окончания реакции добавьте для растворения 5 капель воды и прокипятите, чтобы ускорить растворение. При сплавлении органическое вещество, содержащее серу, часто обугливается, поэтому раствор сульфида натрия получается черным от присутствия частичек угля. Для того, чтобы избавиться от них, возьмите кусочек фильтровальной бумаги размером 3´3 см и, наклонив пробирку, смочите темной жидкостью сначала один угол бумажки, а затем другой. Частички угля адсорбируются в центре бумажного сектора, а раствор сульфида калия фильтруется и образует концентрический бесцветный «вытек». Отступая на 3-4 мм от границы «вытека», нанесите маленькую каплю ацетата свинца Pb(СН3СОО)2. В случае наличия серы на границе соприкосновения «вытеков» появляется темно-коричневое окрашивание
| Уравнения реакций протекающих процессов:
(.......S) +2Na = Na2S +........
Pb(СН3СОО)2 + Na2S = PbS¯ + 2CН3СООNa черный
осадок
а и б – капли Рb (СН3СОО)2
|
Проба на присутствие галогенов (Тяга! Защитные очки!)
| Операция
| Уравнения реакций, рисунок
|
| Проба Бейльштейна. Тонкую медную проволоку загибают на конце в петлю диаметром 1-3 мм и прокаливают этот конец в бесцветном пламени горелки до прекращения окрашивания пламени. Дав почерневшей проволочке остыть, набирают петлей каплю или несколько крупинок исследуемого вещества и снова вводят петлю в наиболее горячую часть бесцветного пламени. В присутствии галогенов пламя принимает зеленую окраску. Образовавшаяся соль окрашивает пламя в зеленый цвет
| Уравнения реакций протекающих процессов:
(..C...H...Cl) + O2 = НCl + CO2+ +Н2О
СuO + 2HCl = CuCl2 + H2O

|
| Метод Степанова. В пробирку наливают 2—3 мл этилового спирта и добавляют 1 каплю галогеносодержащего органического вещества (хлороформа, тетрахлорид углерода, йодоформ и др.). В полученную смесь вносят кусочек металлического натрия величиной с небольшую горошину. Начинается энергичная реакция, сопровождающаяся выделением водорода, причем часть водорода в момент выделения участвует в восстановлении хлороформа. Пробирку закрывают пробкой с прямой газоотводной трубкой и поджигают выделяющийся водород. После окончания выделения водорода и полного растворения натрия к реакционной смеси добавляют 2 мл дистиллированной воды. Избыток алкоголята натрия реагирует с водой с образованием гидроксида натрия. В воде также растворяется белый осадок хлорида натрия, плохо растворимый в этиловом спирте. Необходимо отметить, что в присутствии щелочи нельзя обнаружить хлорид-ион реакцией с нитратом серебра, так как при его добавлении будет образовываться бурый осадок гидроксида серебра. Поэтому полученный щелочной раствор подкисляют несколькими каплями концентрированной азотной кислоты (контроль по лакмусовой бумаге) и к кислому раствору добавляют несколько капель 1%-ного раствора нитрата серебра. Наблюдают выпадение белого творожистого осадка хлорида серебра. Цвет осадка зависит от природы галогена: AgCl — белый, AgBr — желтоватый, AgI — желтый.
|
2С2Н5ОН + 2Na = 2C2H5ONa + 2[H]
СНС13 + 6[Н] = 3НС1 + СН4
НС1 + C2H5ONa = NaCl + С2Н5ОН
C2H5ONa + H2O = C2H5OH + NaOH
NaCl + AgNO3 = NaNO3 + AgCl↓
|
Определите, какие из атомов- органогенов (углерод, водород, азот, сера, галогены, присутствуют в выданных Вам органических веществах
Литература для самостоятельной работы
1. Органическая химия: Учебник для вузов: В 2 кн./В.Л. Белобородов, С.Э. Зурабян, А.П. Тюкавкина; Под ред. Н.А. Тюкавкиной. - М.: Дрофа, 2002. – Кн. 1: Основной курс. – 620с. (С. 74-88)
2. Органическая химия (в вопросах и ответах) / Под ред. Б. А. Ивина и Л. Б. Пиотровского. — СПб.: Наука, 2002. — 510 с. (С. 218-253)



 Прибор для открытия углерода и водорода
Прибор для открытия углерода и водорода
 а,б – капли соляной кислоты
а,б – капли соляной кислоты





