УЧЕБНАЯ ПРОГРАММА ДИСЦИПЛИНЫ - SYLLABUS
1.1. Данные о преподавателе:
Фомин Виталий Николаевич – доцент кафедры неорганической и технической химии, кандидат химических наук
Контактная информация: 6 учебный корпус КарГУ, химический факультет, кафедра неорганической и технической химии, лаборатория 303.
1.2. Данные о дисциплине:
Неорганическая химия
Количество кредитов: 3
Место проведения: 6 учебный корпус КарГУ, аудитория 306, лаборатории 303-304, 27, 30-31.
Выписка из учебного плана
| Форма обучения
| Срок обучения
| курс
| Семестр
| кредиты
| лекции
| Лаб.работы
| СРСП
| СРС
| всего
| Форма контроля
|
| Очн.
|
|
|
|
|
|
|
|
|
| Тест
|
1.3. Пререквизиты:
Изучение дисциплины Неорганическая химия базируется на знании школьных программ по химии, математике, физике и биологии. Для более полного и глубокого освоения данного курса необходимы навыки решения простейших химических задач, навыки работы с компьютером, с учебной и справочной литературой.
1.4. Постреквизиты:
Знания, полученные при изучении данной дисциплины, необходимы при изучении курсов Аналитической химии, Физической химии, Коллоидной химии, Кристаллохимии, а также для большого числа других, более узких, разделов современной химии.
Краткое описание
Цель курса: Дать студентам знание свойств химических элементов и их соединений, основанное на периодическом законе Д.И.Менделеева и современных сведениях о строении веществ и других понятиях теоретической неорганической химии. В результате изучения курса студенты должны иметь представление о месте неорганической химии в системе других химических наук, об основных категориях химии, о закономерностях, управляющих химическими превращениями.
По завершении изучения дисциплины Неорганическая химия, студенты должны усвоить основные химические законы, понятия и теории, современную номенклатуру неорганических соединений, общую характеристику химических элементов, их соединений и их свойства. Они должны уметь пользоваться периодической системой Д.И.Менделеева, для определения на основании положения элемента в таблице, его свойств, знать химизм основных химических производственных процессов, применять теоретический материал на практике при выполнении лабораторных работ и при решении задач. Студенты должны приобрести практические навыки обращения с химическим оборудованием и проведения химического эксперимента.
Результаты обучения
В результате изучения курса «Неорганическая химия» у студентов должны сформироваться устойчивые представления об основных количественных законах химии, природе вещества и химической связи, а также сформироваться навыки выполнения пробирочных опытов и экспериментов с использованием стеклянных приборов.
1.7. График выполнения и сдачи заданий по дисциплине Теоретические основы неорганической химии
| № темы
| Виды работ
| Цель и содержание задания
| Рекомендуемая литература
| продолжительность выполнения
| Баллы (согласно рейтинг-шкале)
| Форма контроля
| форма отчетности
| Сроки сдачи (№ недели)
|
|
|
|
|
|
|
|
|
|
|
|
| Письменная работа
| Научиться решать задачи
| 9, 21-25
|
|
| К/р*
|
| В теч. сессии
|
| Отчет по лабор. работе
| Анализ результатов, полученных эксперим. путем
| 8, 28-30
|
|
| Проверка отчета
|
| В теч. сессии
|
| реферат
| Работа с научной литературой
| 1-30
|
|
|
|
| В теч. сессии
|
|
| Письменная работа
| Научиться писать электронные формулы элементов
| 1-5
|
|
| Т/к**
|
| В теч. сессии
|
|
| реферат
| Работа с научной литературой
| 1-30
|
|
|
|
| В теч. сессии
|
|
| Письменная работа
| Освоить МВС и ММО
| 1-30
|
|
| ДКР***
|
| В теч. сессии
|
| 1-3
| Индивид. собесед.
| Контроль знаний по изученным темам (1-3)
| 1-30
|
|
| коллоквиум
|
| В теч. сессии
|
|
| Отчет по лабор. работе
| Анализ результатов, полученных эксперим. путем
| 8, 28-30
|
|
| Проверка отчета
|
| В теч. сессии
|
| реферат
| Работа с научной литературой
| 1-30
|
|
|
|
| В теч. сессии
|
| Письменная работа
| Освоить номенклатуру КС, методы ВС, МО и ТКП в применении к КС
| 1-30
|
|
| ДКР
|
| В теч. сессии
|
|
| Отчет по лабор. работе
| Анализ результатов, полученных эксперим. путем
| 8, 28-30
|
|
| Проверка отчета
|
| В теч. сессии
|
| реферат
| Работа с научной литературой
| 1-30
|
|
|
|
| В теч. сессии
|
|
| Отчет по лабор. работе
| Анализ результатов, полученных эксперим. путем
| 8, 28-30
|
|
| Проверка отчета
|
| В теч. сессии
|
|
| Письменная работа
| Научиться решать задачи по химической кинетике
| 1-30
|
|
| Т/к
|
| В теч. сессии
|
| 4-6
| Индивидуальное собеседование
| Контроль знаний по изученным темам (4-6)
| 1-30
|
|
| коллоквиум
|
| В теч. сессии
|
|
| Отчет по лабор. работе
| Анализ результатов, полученных эксперим. путем
| 8, 28-30
|
|
| Проверка отчета
|
| В теч. сессии
|
| реферат
| Работа с научной литературой
| 1-30
|
|
|
|
| В теч. сессии
|
| Письменная работа
| Научиться решать задачи на свойства растворов
| 1-30
|
|
| К/р
|
| В теч. сессии
|
|
| Отчет по лабор. работе
| Анализ результатов, полученных эксперим. путем
| 8, 28-30
|
|
| Проверка отчета
|
| В теч. сессии
|
| Письменная работа
| Научиться писать гидролиз солей
| 1-30
|
|
| К/р
|
| В теч. сессии
|
|
| Отчет по лабор. работе
| Анализ результатов, полученных эксперим. путем
| 8, 28-30
|
|
| Проверка отчета
|
| В теч. сессии
|
| Письменная работа
| Освоить метод ионных уравнений, научиться решать задачи на законы Фарадея
| 1-30
|
|
| ДКР
|
| В теч. сессии
|
| 7-9
| Индивидуальное собеседование
| Контроль знаний по изученным темам (7-9)
| 1-30
|
|
| коллоквиум
|
| В теч. сессии
|
*- контрольная работа;
** - тестовый контроль;
*** - домашняя контрольная работа
Список литературы
Основная:
- Неорганическая химия. В трех томах Под ред.академика Ю.Д.Третьякова. Том 1.Физико-химические основы неорганической химии. Москва: Академия, 2004. 234с.
- Общая и неорганическая химия.Том 1. Теоретические основы химии. Под ред.А.Ф.Воробьева. Москва: ИКЦ «Академкнига», 2004.371с.
- Суворов А.В., Никольский А.Б. Общая химия. Санкт-Петербург: ХИМИЗДАТ., 2000. 620с.
- Шрайвер Д., Эткинс П. Неорганическая химия. В двух томах. Москва: «Мир». 2004.678с.
- Угай Я.А. Общая химия.М.:ВШ.1984.440с.
- Угай Я.А. Неорганическая химия.М.:ВШ.1989.463с.
- Угай Я.А. Общая и неорганическая химия. М.:ВШ.1997.527с
- Ахметов Н.С. Общая и неорганическая химия. М.:ВШ.1988.640с.
- Некрасов Б.В. Основы общей химии. В 2-х томах.М.:Химия.1972-1973.Т.1-2.
- Коттон Ф., Уилкинсон Дж. Основы неорганической химии. М.:Мир, 1979.678с.
- Реми Г. Курс неорганической химии. В 2-х томах.М.:Мир.1972-1974.т.1-2.
- Практикум по неорганической химии. Под ред.Спицына В.И. М.:ВШ.1984.224с
- Гольбрайх З.Е. Сб.задач и упражнений по общей химии.М.:ВШ.1984.224с
- Глинка Н.Л. Задачи и упражнения по обшей химии.Л.:Химия.1989.272с.
15. http://www.twirpx.com/files/chidnustry/chemistry/nonorganic/ (доступная для бесплатного ознакомления литература по неорганической химии).
Дополнительная:
16. Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. М.:Мир.1969.
17. Дей К., Селбин Д. Теоретическая неорганическая химия.М.:Химия.1976.566с.
18. Мартыненко Л.И., Спицын В.И. Избранные главы неорганической химии. М.МГУ.1986
19. Щукарев С.А. Неорганическая химия. В 2-х томах.М.:ВШ.1970-1974.т.1-2.
20. Воробьева О.И. и др. Методические разработки по неорганической химии для студентов 1 курса. М.:МГУ.1985.
21. Букетов Е.А. Современные формы выражения таблицы элементов Д.И.Менделеева. Караганда.:КарГУ.1982.113с.
22. Полинг Л. Общая химия. М.Мир.1974
23. Зайцев О.С. Общая химия (Направление и скорость химических процессов, строение вещества).М.:ВШ.1983
24. Зайцев О.С. Общая химия (Состояние веществ и химические реакции).М.:Химия.1990
25. Воробьева О.И. и др. Вопросы, упражнения и задачи по неорганической химии. М.МГУ.1985.180с.
26. Свиридов В.В. и др. Задачи, вопросы и упражнения по общей химии. М.:БГУ.1978.352с.
27. Любимова М.Б. Вопросы и задачи по общей и неорганической химии. М.:ВШ.1990.351с.
28. Лидин Р.А. и др. Задачи по неорганической химии. М.:ВШ.1990.319с.
29. Лидин Р.А. и др. Неорганическая химия в вопросах.М.:Химия.1991.288с.
30. Романцев Л.М. и др. Сб.задач и упражнений по общей химии. М.:ВШ.1991.288с.
31. Краткая химическая энциклопедия. М.: СЭ.1960-1966.т.1-2.
32. Популярная библиотека химических элементов. Л.Химия.1975.т.1-2.
33. Зайцев О.С. Исследовательский практикум по общей химии. Изд-во Московского университета.1994. 480с.
34. Хомченко Г.П. Практикум по общей и неорганической химииМ.:ВШ.1980. 332с.
35. Ахметов Н.С.,Азизова М.К., Бадыгина Л.И. Лабораторные и семинарские занятия по неорганической химии. М.:ВШ.1988. 303с.
Информация по оценке знаний
рейтинг-шкала:
| Форма контроля
| Баллы
|
| | Очное отд
| Заочное отд
|
| Текущий
|
|
|
| Рубежный
|
|
|
| Домашний
|
|
|
| Итоговый
|
|
|
| Всего:
|
|
|
Формы оценки знаний
| Оценка по буквенной системе
| баллы
| %-ное содержание
| Оценка в традиционной системе
|
| А
| 4,0
|
| отлично
|
| А-
| 3,67
| 90-94
|
| В+
| 3,33
| 85-89
| хорошо
|
| В
| 3,0
| 80-84
|
| В-
| 2,67
| 75-79
|
| С+
| 2,33
| 70-74
| удовлетворительно
|
| С
| 2,0
| 65-69
|
| С-
| 1,67
| 60-64
|
| D+
| 1,33
| 55-59
|
| D
| 1,0
| 50-54
|
| D-
| 0,67
|
| неудовлетворительно
|
| F
|
| 0-49
|
Политика и процедура курса
Изучение дисциплины «Теоретические основы неорганической химии» по кредитной технологии, осуществляется с применением таких форм аудиторных занятий, как лекции, лабораторно-практические занятия, самостоятельная работа студентов с преподавателем (СРСП). Все занятия, пропущенные по уважительной причине, отрабатываются в свободное время с разрешения преподавателя и инженера учебной лаборатории. Пропуски занятий без уважительной причины приравниваются к оценке «неудовлетворительно».
На лекциях преподаватель осуществляет разбор теоретического материала, акцентируя внимание на особо сложных разделах. При этом, студенты обязаны изучить все разделы дисциплины, предусмотренные программой, независимо от того, рассматривались ли они на лекциях или нет. То есть, определенная часть работы по изучению дисциплины, выполняется студентами самостоятельно. В случае возникновения вопросов по изучаемым разделам, студенты разбирают материал совместно с преподавателем на СРСП.
Лабораторно-практические занятия по неорганической химии проводятся в учебных лабораториях в присутствии преподавателя и инженера кафедры. Во время выполнения лабораторно-практических заданий студенты обязаны соблюдать все правила техники безопасности.
УЧЕБНО-МЕТОДИЧЕСКИЕ МАТЕРИАЛЫ ПО ДИСЦИПЛИНЕ
2.1. Тематический план курса
Всего (кредитов) 3
| Наименование темы
| лекции
| лабораторные
| СРСП
| СРС
|
| 1.Атомно-молекулярное учение. Развитие материалистического представления в химии. Стехиометрические законы химии, границы их применимости. Основные типы структур неорганических соединений. Вещества с молекулярной и немолекулярной структурой. Нестехиометрические соединения.
|
|
| 4,5
|
|
| 2.Строение атома. Модели Томсона, Резерфорда, Бора, Зоммерфельда. Современное представление о строении атома. Корпускулярно-волновой дуализм. Уравнение Луи де Бройля, принцип неопределенности Гейзенберга, уравнение Шредингера. Квантовые числа. Принцип Паули, правила Гунда и Клечковского. Строение атома и периодический закон.
|
| -
| 4,5
|
|
| 3.Химическая связь. Свойства взаимодействующих атомов: эффективный радиус, сродство к электрону, энергия ионизации, электроотрицательность. Типы химической связи: ковалентная, ионная, металлическая, водородная, ван-дер-ваальсова. Метод валентных связей, метод ЛКАО-МО. Гибридизация. Количественные характеристики химической связи. Многоцентровые связи.
|
| -
| 4,5
|
|
| 4.Комплексные соединения. Номенклатура. Изомерия. Теория химической связи в координационных соединениях: электростатическая теория, теория валентных связей, теория кристаллического поля, теория поля лигандов.
|
|
|
|
|
| 5.Термохимия и термодинамика. Тепловые эффекты химических реакций. Термохимические уравнения. Закон Гесса и следствия из него. Энтальпия, энтропия, энергия Гиббса, теплоемкость. Направление химического процесса.
|
|
| 4,5
|
|
| 6.Кинетика химических процессов. Химическое равновесие. Молекулярное столкновение. Скорость реакции, константа скорости, закон действующих масс. Молекулярность и порядок реакции. Энергия активации. Теория активных столкновений и переходного состояния. Зависимость скорости реакции от температуры. Свойство равновесного состояния. Принцип Ле-Шателье.
|
|
| 4,5
|
|
| 7.Жидкое состояние. Жидкие растворы. Структура растворов. Классификация растворов. Концентрации растворов и способы их выражения. Энергетика растворения. Свойства растворов неэлектролитов. Законы Рауля и Генри.
|
|
|
|
|
| 8.Электролитическая диссоциация. Сильные и слабые электролиты. Активная концентрация ионов сильных электролитов. Теории кислот и оснований. Реакции ионного обмена. Ионное произведение воды. Водородный показатель. Растворимость. Произведение растворимости Гидролиз солей
|
|
| 4,5
|
|
| 9.Окислительно восстановительные реакции (ОВР). Классификация ОВР. Методы подбора коэффициентов окислительно восстановительных реакций. Окислительно восстановительные потенциалы. Направление окислительно восстановительных реакций. Уравнение Нернста. Электрохимия.
|
|
|
|
|
| Всего (часов)
|
|
|
|
|
Тезисы лекционных занятий
Тема лекции:
Химическая связь
Тезисы лекции:
Атомы в определенном качественном и количественном отношении объединяются в молекулы благодаря возникновению между ними химических связей. Химические связи между атомами различных элементов отличаются по своей природе: способу образования, энергии, длине и т.д. Исторически связи делятся на следующие типы: ковалентные, ионные и металлические.
Ковалентная связь может быть образована как обменным механизмом, т.е. за счет перекрывания электронных облаков двух связывающихся атомов, так и донорно-акцепторным механизмом, когда ковалентную связь образуют атом-донор, представляющий пару электронов и атом-акцептор, обладающий вакантной орбиталью.
Самым главным при образовании ковалентной связи по любому механизму является возникновение общей пары электронов для двух рассматриваемых атомов. Различают полярную и неполярную ковалентную связь. Неполярной ковалентная связь получается в том случае, когда связывающиеся между собой атомы имеют одну и ту же электроотрицательность (Н2, О2 и т.д.)
При образовании полярной ковалентной связи, в результате смещения общей пары электронов к более электроотрицательному, на одном из атомов сосредоточивается избыточный положительный, на другом – избыточный отрицательный заряды. Так возникает диполь. Мерой полярности молекулы –диполя является дипольный момент. Зная дипольный момент молекулы, можно судить о ее геометрической структуре.
Чем больше смещение связывающей электронной пары к одному из атомов, тем ближе связь к ионной. Чисто ионной связи не бывает, поскольку это пример научной абстракции, поэтому об этом виде связи можно говорить как о предельном случае полярной ковалентной связи. В отличие от ковалентной связи ионная связь является ненаправленной и ненасыщаемой.
Кроме перечисленных типов связи существует еще водородная связь. Атом водорода в соединениях с сильно электроотрицательными элементами приобретает значительный –избыточный положительный заряд и становится способным образовывать дополнительную связь с другими атомами электроотрицательных элементов. Наличие водородной связи приводит к образованию полимеров-ассоциатов типа (Н2О)n, (НF)n и повышению температуры плавления и кипения веществ.
Исходя из современных корпускулярно-волновых представлений о природе электрона, квантово-механическое описание ковалентной связи предусматривает использование методов валентных связей (МВС) и молекулярных орбиталей (ММО).
Метод валентных связей основывается на положениях: ковалентная связь образуется двумя неспаренными электронами с противоположными спинами по обменному или донорно-акцепторному механизму; прочность и направление ковалентной связи определяется областью перекрывания обобществленных электронов.
К характерным особенностям ковалентной связи относятся насыщаемость, направленность и поляризуемость. Определенная последовательность связей атомов в молекулах и их направленность в пространстве определяют геометрию молекулы. В свою очередь направленность связей в пространстве может быть объяснена понятием о гибридизации АО центрального атома. Гибридизация - выравнивание АО по форме и по энергии – осуществляется в соответствии с правилами:1) гибридизации подвергаются АО, близкие по энергии; 2) в гибридизации может принимать участие АО, несущая валентную электронную пару (например 2s2-орбиталь кислорода в молекуле воды); 3) склонность к гибридизации в рядах сходных по свойствам элементов падает с увеличением радиусов атомов.
По ММО при образовании молекул из атомов, исходные атомные орбитали преобразуются в молекулярные орбитали (МО). В результате молекулу можно рассматривать как многоцентровой атом, в котором каждый электрон движется по МО в поле остальных электронов и всех ядер. Каждой молекулярной орбитали соответствует определенный набор молекулярных квантовых чисел. Последовательное заполнение молекулярных орбиталей электронам подчиняется принципу наименьшей энергии, принципу Паули и правилу Хунда.
Из исходных n АО всегда образуется n МО. При сложении (перекрывании) АО согласно ЛКАО образуются связывающие МО со сравнительно низким значением энергии, при вычитании (отталкивании) АО – разрыхляющие МО с более высоким уровнем энергии, чем у исходных АО. Образование МО из АО изображают в виде энергетической диаграммы, где по вертикали откладывают значения энергии Е орбиталей:
В атомах элементов от лития до азота имеет место энергетическая близость 2s- и 2p-орбиталей, поэтому электроны на МО  и
и 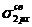 взаимно отталкиваются. В результате МО
взаимно отталкиваются. В результате МО 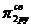 и
и 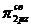 становятся энергетически более выгодными, чем
становятся энергетически более выгодными, чем 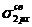 -орбиталь.
-орбиталь.
В ММО кратность связи или порядок связи определяется как полуразность между числом связывающих и разрыхляющих электронов на МО. Чем выше значение ПС, тем больше прочность связи, тем меньше длина связи. При ПС, равном нулю, молекула становится неустойчивой и ее существование невозможно.
В случае применения ММО к рассмотрению многоатомных молекул, на энергетических диаграммах помимо образования МО из АО необходимо показать предварительную гибридизацию исходных АО центрального атома.
Основная литература: 1-6,9,10
Дополнительная литература: 11-19
Тема лекции:
Комплексные соединения
Тезисы лекции:
К концу 19в. накоплен большой материал по особой группе соединений, состав которых не находил объяснений с позиций классической теории валентности. В 1893г. Альфред Вернер предлагает координационную теорию, объясняющую устройство таких соединений, которые он называет комплексными.
Комплексные соединения – наиболее устойчивые соединения высшего порядка, которые в водном растворе либо вообще не распадаются на свои составные части, либо распадаются в самой незначительной степени.
В соответствии с теорией Вернера в каждом комплексном соединении различают внутреннюю и внешнюю сферу. В химических реакциях, в процессах растворения, в структуре кристалла, внутренняя сфера или собственно комплекс, выступает как самостоятельная единица. Центральный элемент внутренней сферы комплекса, вокруг которого группируются ионы или молекулы, называют комплексообразователем или центральным атомом (ц.а.). В качестве таковых чаще всего выступают атомы переходных металлов. Ионы или молекулы, координирующиеся возле ц.а. во внутренней сфере называются лигандами.
Число мест во внутренней сфере комплекса, которое может быть занято лигандами, называют координационным числом или координационной валентностью.Координационное число (к.ч.) зависит от центрального атома: чем больше радиус комплексообразователя, тем выше к.ч., чем больше степень окисления ц.а., тем выше к.ч.
Классифицировать комплексные соединения можно по разным признакам. Так, по количеству мест, занимаемых лигандом, различают монодентатные и бидентатные комплексы. По принадлежности к определенному классу соединений выделяют комплексные кислоты, комплексные основания и комплексные соли. По характеру заряда внутренней сферы комплексные соединения подразделяют на катионные, анионные и нейтральные. По характеру лигандов выделяют аквакомплексы, аммиакаты, ацидокомплексы, гидроксокомплексы, аминаты и т.д. Кроме того, существуют бикомплексы (соли с комплексными катионом и анионом), сверхкомплексы (в которых количество лигандов больше, чем координационная валентность). По количеству комплексообразователей различают моноядерные и полиядерные соединения. Наличие циклов во внутренней сфере позволяет выделять циклические комплексы, которые обычно называют хелатами.
Для комплексных соединений характерны различные виды изомерии. Ионизационной метамерией называют существование веществ с одинаковым составом, в водном растворе, диссоциирующих на различные ионы. Солевые изомеры содержат в качестве лигандов неорганические изомеры. Различное распределение лигандов в бикомплексах приводит к координационной изомерии. Характер пространственного расположения лигандов относительно центрального атома обусловливает геометрическую цис-, транс- и оптическую изомерию.
Природу химической связи в комплексных соединениях пытались объяснить многие ученые. Так, Коссель и Магнус в электростатической теории предполагали наличие ионной связи между центральным атомом и лигандами. Но эта теория не объясняет существования комплексов с неполярными лигандами и центральным атомом в нулевой степени окисления (например, карбонилы). К недостаткам этой теории можно отнести и отсутствие объяснений магнитных и оптических свойств комплексных соединений.
Метод валентных связей развивает идеи о парноэлектронной связи в координационных соединениях. С точки зрения МВС связь между ц.а. и лигандом – донорно-акцепторная. Лиганд является донором электронной пары, а комплексообразователь предоставляет свободную орбиталь. Чем больше перекрывание между ц.а. и лигандом, тем прочнее связь. Орбитали центрального атома подвергаются гибридизации, причем тип гибридизации определяется числом, природой и электронной структурой лиганда. Гибридизация определяет пространственную структуру комплекса. Дополнительное упрочение комплекса, в соответствии с МВС, обусловлено тем, что наряду с 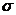 -связью может возникать дополнительное
-связью может возникать дополнительное  -связывание. Магнитные свойства теория МВС объясняет исходя из заселенности орбиталей. Но, как и предыдущая теория, МВС не объясняет оптических свойств комплексных соединений, так как не учитывает возбужденного состояния, кроме того, не дает оценку энергий для различных структур комплексов.
-связывание. Магнитные свойства теория МВС объясняет исходя из заселенности орбиталей. Но, как и предыдущая теория, МВС не объясняет оптических свойств комплексных соединений, так как не учитывает возбужденного состояния, кроме того, не дает оценку энергий для различных структур комплексов.
Теория кристаллического поля (ТКП) основана на электростатической модели. Связь между ц.а. и лигандом – ионная, причем ц.а. рассматривается детально, а лиганд – как бесструктурная заряженная точка, создающая электростатическое поле. Основное внимание ТКП уделяет тем изменениям, которые происходят в центральном атоме под действием лигандов. В поле лигандов снимается вырождение d-орбитали центрального атома (чаще всего переходного металла), так как различны формы этих орбиталей и их расположение в пространстве. В октаэдрическом поле лигандов пятикратно вырожденная d-орбиталь расщепляется и, энергетически наиболее выгодными, становятся d 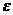 орбитали, а d
орбитали, а d  орбитали – менее выгодными. Энергия расщепления зависит от силы лиганда. В тетраэдрическом или квадратном поле лигандов, картина расщепления совсем другая.. Заполнение электронами по-разному расщепленных орбиталей приводит к существованию высокоспиновых и низкоспиновых комплексных соединений. К недостаткам этой теории относят то, что она не учитывает определенной доли ковалентности в связи между ц.а. и лигандом, кроме того, она не объясняет существования комплексов, в которых лигандами выступают нейтральные молекулы. Последний недостаток разрешается в теории поля лигандов.
орбитали – менее выгодными. Энергия расщепления зависит от силы лиганда. В тетраэдрическом или квадратном поле лигандов, картина расщепления совсем другая.. Заполнение электронами по-разному расщепленных орбиталей приводит к существованию высокоспиновых и низкоспиновых комплексных соединений. К недостаткам этой теории относят то, что она не учитывает определенной доли ковалентности в связи между ц.а. и лигандом, кроме того, она не объясняет существования комплексов, в которых лигандами выступают нейтральные молекулы. Последний недостаток разрешается в теории поля лигандов.
ММО в применении к комплексным соединениям детально учитывает электронную структуру не только комплексообразователя, но и лигандов. Валентные электронные системы располагаются на многоцентровых МО, охватывающих ядра ц.а. и всех лигандов, входящих в состав комплекса. Для построения МО используются АО комплексообразователя и лиганда, удовлетворяющие ряду требований. Образование связывающих молекулярных орбиталей (СМО) происходит в результате максимального перекрывания электронных облаков, дающего выигрыш в энергии. Разрыхляющая МО образуется в результате отрицательного перекрывания. Если АО центрального атома не перекрывается или почти не перекрывается с АО лиганда, энергия их не меняется и АО превращается в МО с той же энергией и получается несвязывающая молекулярная орбиталь (НМО).
Основная литература: 1-7, 9-10
Дополнительная литература: 12,13, 19-24.
Тема лекции:
Планы практических занятий
Практические занятия как отдельная форма проведения занятий не предусмотрены.
Планы лабораторных заданий
Вопросник
1. Правила работы в лаборатории и организация рабочего места.
2. Химическая посуда и особенности работы с ней.
3. Техника выполнения отдельных операций: взятие вещества для проведения опыта; взвешивание; нагревание; растворение твердых веществ; осаждение; отделение осадка от раствора; промывание осадка; выпаривание растворов и высушивание осадков; прокаливание; сплавление; определение плотности жидкости; определение вида осадка и формы кристаллов.
4. Современные методы очистки веществ. Очистка веществ в различных агрегатных состояниях. Особенности очистки твердых веществ. Перекристаллизация, возгонка, перегонка и др.
5. Как в лабораторных условиях можно определить молярную массу эквивалента вещества?
6. Как практически определяются атомные и молекулярные массы веществ?
7. Как характеризовать состав комплексных соединений?
8. Соединения с комплексным анионом
9. Соединения с комплексным катионом
10. Как получать соединения, содержащие в молекуле комплексный катион и анион?
11. Комплексные соединения в реакциях обмена
12. Исследование прочности комплексных ионов. Разрушение комплексов.
13. Комплексные соединения в окислительно-восстановительных процессах
14. Каково влияние концентрации реагирующих веществ на скорость химической реакции в гомогенной системе?
15. Влияние температуры на скорость химической реакции в гомогенной системе
16. Влияние катализатора на скорость химической реакции
17. Влияние величины поверхности реагирующих веществ на скорость химической реакции в гетерогенной системе
18. Влияние изменения концентрации реагирующих веществ на равновесие химической реакции
19. Как отличать характер изменения энтальпии системы при экзо- и эндотермическом процессе?
20. Определение теплоты нейтрализации сильного основания сильной кислотой
21. Определение теплоты нейтрализации слабого основания слабой кислотой
22. Определение теплоты гидратации
23. Что такое калориметр, как он устроен?
24. Приготовление растворов различной концентрации
25. Определение растворимости различных солей
26. Приготовление пересыщенных растворов
27. Электропроводность растворов электролитов
28. Ионные процессы (реакции обмена)
29. Определение концентрации кислоты при помощи реакции нейтрализации
30. Сравнение химической активности кислот
31. Смещение равновесия диссоциации слабого электролита
32. Условия выпадения осадка
33. Дробное осаждение
34. Условие растворения осадков в результате химического взаимодействия
35. Влияние величины произведения растворимости электролита на его способность к химическому взаимодействию
36. Получение одних малорастворимых соединений из других
37. Индикаторы. Окраска индикаторов в кислой и щелочной среде.
38. Определение рН раствора при помощи индикаторов.
39. Инструментальное определение рН раствора.
40. Гидролиз солей.
41. Реакция среды в растворах различных солей
42. Образование основных и кислых солей при гидролизе
43. Совместный гидролиз двух солей
44. Атомы, молекулы простых веществ и элементарные ионы в качестве окислителей и восстановителей
45. Сложные ионы в окислительно-восстановительных процессах
46. Значение среды в окислительно-восстановительных процессах
47. Реакции, в которых окислитель или восстановитель расходуются также на связывание получающихся продуктов
48. Окислительно-восстановительная двойственность
49. Внутримолекулярные окислительно-восстановительные процессы.
50. Реакции диспропорционирования
51. Органические вещества в качестве восстановителей
52. Исследование активности металлов
53. Изготовление гальванического элемента
54. Электролиз водных растворов
Основная литература: 8
Дополнительная литература: 28-30
Методические рекомендации:
При выполнении лабораторных работ рекомендуется оформлять лабораторный журнал, в котором необходимо отразить последовательность выполнения того или иного опыта, зарисовать необходимую установку, при необходимости изложить предполагаемый результат эксперимента, произвести все предварительные расчеты и подробно изложить все наблюдения по проводимой работе. После выполнения всех опытов, относящихся к одной теме, полученные результаты рекомендуется оформить в виде научной статьи.
При подготовке к выполнению экспериментальных работ можно пользоваться как источниками, предложенными в списке основной и дополнительной литературы, так и любыми другими специальными практикумами и руководствами по экспериментальной неорганической химии.
2.5.Планы занятий в рамках самостоятельной работы студентов под руководством преподавателя.
Тема: Строение атома.
Задания: Использовать представление о квантовании энергии для объяснения происхождения линейчатых спектров. Вычислять энергию перехода электрона в атоме. Характеризовать энергетическое состояние электрона в атоме набором квантовых чисел и записывать его формулой, используя буквенное обозначение орбитального квантового числа. Объяснить физический смысл волновой функции электрона, понятий «орбиталь», «электронная плотность», «плотность вероятности». Изображать графически радиальное распределение электронной плотности и форму орбиталей.
Задачи: 293-303(9), 58-108(22),
форма проведения СРСП
Аудиторное обсуждение темы, работа с литературой, групповое выполнение задания
Тема: Химическая связь.
Задания: Научиться объяснять природу химической связи и выделение энергии при образовании молекул из атомов. Осуществлять графически линейную комбинацию атомных орбиталей и описывать образование из атомных связывающих, разрыхляющих и несвязывающих 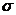 - и
- и  - молекулярных орбиталей. Строить энергетические диаграммы молекулярных орбиталей для двухатомных молекул и молекулярных ионов, образованных элементами малых периодов периодической системы. Определять порядок связи в молекуле; устанавливать зависимость между порядком связи и энергией связи, ее длиной; различать пара- и диамагнитные молекулы. По типу перекрывания атомных орбиталей различать
- молекулярных орбиталей. Строить энергетические диаграммы молекулярных орбиталей для двухатомных молекул и молекулярных ионов, образованных элементами малых периодов периодической системы. Определять порядок связи в молекуле; устанавливать зависимость между порядком связи и энергией связи, ее длиной; различать пара- и диамагнитные молекулы. По типу перекрывания атомных орбиталей различать 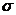 -,
-,  - и -связи. Определять пространственную структуру молекул
- и -связи. Определять пространственную структуру молекул
Задачи: 311-329(9),289-307 (25)
форма проведения СРСП
Дискуссия по теме, выполнение письменного задания, работа с учебной литературой, работа в парах.
Тема: Свойства растворов.
Задания: Уметь различать способы выражения концентрации растворов. Переходить от одного способа выражения концентрации к другому. Решать задачи на коллигативные свойства растворов неэлектролитов. Применять законы Рауля и Генри.
Задачи: 223-271(9), 487-502(9)
форма проведения СРСП
Аудиторная. Просмотр учебного фильма. Работа с учебной литературой. Выполнение группового задания.
Тема: Строение атома.
Задания: Подготовить рефераты. Составить план-конспект по теме «Строение ядра атома. Ядерные процессы». Подготовиться к тестовому контролю.
Тема: Химическая связь.
Задания: Подготовить рефераты



 и
и 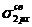 взаимно отталкиваются. В результате МО
взаимно отталкиваются. В результате МО 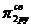 и
и 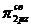 становятся энергетически более выгодными, чем
становятся энергетически более выгодными, чем 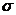 -связью может возникать дополнительное
-связью может возникать дополнительное  -связывание. Магнитные свойства теория МВС объясняет исходя из заселенности орбиталей. Но, как и предыдущая теория, МВС не объясняет оптических свойств комплексных соединений, так как не учитывает возбужденного состояния, кроме того, не дает оценку энергий для различных структур комплексов.
-связывание. Магнитные свойства теория МВС объясняет исходя из заселенности орбиталей. Но, как и предыдущая теория, МВС не объясняет оптических свойств комплексных соединений, так как не учитывает возбужденного состояния, кроме того, не дает оценку энергий для различных структур комплексов.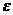 орбитали, а d
орбитали, а d  орбитали – менее выгодными. Энергия расщепления зависит от силы лиганда. В тетраэдрическом или квадратном поле лигандов, картина расщепления совсем другая.. Заполнение электронами по-разному расщепленных орбиталей приводит к существованию высокоспиновых и низкоспиновых комплексных соединений. К недостаткам этой теории относят то, что она не учитывает определенной доли ковалентности в связи между ц.а. и лигандом, кроме того, она не объясняет существования комплексов, в которых лигандами выступают нейтральные молекулы. Последний недостаток разрешается в теории поля лигандов.
орбитали – менее выгодными. Энергия расщепления зависит от силы лиганда. В тетраэдрическом или квадратном поле лигандов, картина расщепления совсем другая.. Заполнение электронами по-разному расщепленных орбиталей приводит к существованию высокоспиновых и низкоспиновых комплексных соединений. К недостаткам этой теории относят то, что она не учитывает определенной доли ковалентности в связи между ц.а. и лигандом, кроме того, она не объясняет существования комплексов, в которых лигандами выступают нейтральные молекулы. Последний недостаток разрешается в теории поля лигандов.


