Точка эквивалентности в методах ацидометрии и алкалиметрии определяется по изменению кислотности среды (рН растворов).
Для экспериментального установления точки эквивалентности пользуются индикаторами – веществами, которые изменяют окраску в зависимости от рН раствора.
Момент титрования, когда индикатор изменяет окраску, называется точкой конца титрования. Очевидно, что необходимо выбирать индикатор и условия титрования так, чтобы точка конца титрования совпадала с точкой эквивалентности или была возможно ближе к последней.
Индикаторы — довольно сложные органические вещества, являющиеся слабыми кислотами или основаниями. Окраска молекулярной и ионизированной форм этих веществ различна.
Различают одноцветные, у которых одна из форм бесцветна, и двуцветные индикаторы. Например, фенолфталеин – одноцветный индикатор, он бесцветен в кислой и нейтральной средах и малиновый – в щелочной. Метиленовый оранжевый – двуцветный, он принимает розовую окраску в кислой среде и желтую – в нейтральной и щелочной средах.
Допустим, что индикатор является слабой кислотой, тогда равновесие его ионизации можно записать уравнением:
HInd ↔ Ind¯ + H+,
где Ind¯ – сложный органический анион.
По закону действующих масс константа равновесия:
Ка 
Обычно индикатор добавляется к раствору кислоты или основания, находящихся в значительном избытке по сравнению с концентрацией индикатора, поэтому равновесная концентрация ионов водорода определяется концентрацией сильного электролита:
Ka × [HInd]
[H+] = ——————
[Ind–]
После логарифмирования уравнение примет вид:
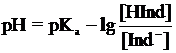
Если равновесные концентрации недиссоциированной и диссоциированной форм равны,то
рН = рКа
Это значение рН называется точкой перехода индикатора.
Однако при изменении рН раствора переход окраски происходит в некотором интервале значений рН. Практически установлено, что окраску одной формы индикатора можно различить на фоне другой, если ее концентрация составляет не менее 1/10 от концентрации другой формы.
Область значений рН, в которой наблюдается видимое для глаза изменение окраски индикатора, называется интервалом перемены окраски индикатора. Ее границы обычно ∆рН = рКа ± 1.
Для каждого индикатора можно определить значение рН, называемое показателем титрования (рТ), при котором происходит наиболее отчетливое изменение окраски.
Например, интервал перемены окраски метиленового оранжевого находится в пределах рН от 3.1 до 4.4. Внутри этого интервала окраска постепенно изменяется от розовой к желтой. Показатель титрования этого индикатора равен 4.0. Это значение находится внутри интервала перехода окраски данного индикатора, но не совпадает с рКа = 3.34.
Свойства некоторых индикаторов
| Индикатор
| Интервал изменения
окраски
| рКа
инд.
| Окраска индикатора
|
| кислотная
форма
| основная
форма
|
| тимоловый синий
| 1,2-2,8
| 1,7
| красная
| желтая
|
| метиловый оранж.
| 3,1-4,4
| 4,0
| красная
| желтая
|
| метиловый красн.
| 4,2-6,2
| 5,5
| красная
| желтая
|
| лакмус
| 5,0-8,0
| 7,0
| красная
| синяя
|
| п-нитрофенол
| 5,6-7,4
| 6,5
| бесцветная
| желтая
|
| бромтимоловый
| 6,0-7,6
| 7,0
| желтая
| синяя
|
| нейтральный красн.
| 6,8-8, 0
| 7,5
| красная
| желтая
|
| фенолфталеин
| 8,2-9,8
| 9,0
| бесцветная
| малиновая
|
| тимолфталеин
| 9,3-10,5
| 9,9
| бесцветная
| синяя
|
Кривые титрования
В процессе кислотно-основного титрования происходит изменение концентрации ионов водорода и соответственно рН раствора.
Графическое изображение зависимости рН от объёма добавляемого рабочего раствора (или от степени нейтрализации анализируемого раствора) называется кривой титрования.
1. Нейтрализация сильной кислоты сильным основанием

HCl + NaOH = NaCl + H2O
В начале титрования добавление небольшого количества щелочи не оказывает влияние на рН раствора. По мере приближения к точке эквивалентности увеличение рН идет более быстро. Добавление последней капли рабочего раствора приводит к резкому изменению рН титруемого раствора и изменению цвета индикатора.
Резкое изменение рН раствора вблизи точки эквивалентности называется скачком титрования. Середина скачка титрования соответствует точке эквивалентности.
В данном случае рН в точке эквивалентности будет нейтральной, т.к. образующаяся в результате реакции нейтрализации соль не подвергается гидролизу.
Следовательно, при титровании сильных кислот сильными основаниями (и наоборот) можно применять индикаторы, интервал перемены окраски которых от 4 до 10 (метиловый красный, метиловый оранжевый, фенолфталеин и др.). Наиболее подходящим будет тот, у которого рТ=7.
Однако необходимо учесть, что присутствие растворимого оксида углерода (IV) в растворе смещает рН точки эквивалентности в кислую среду, поэтому обычно применяют метиловый оранжевый (рТ=4). Довольно значительное отклонение рТ данного индикатора от рН в точке эквивалентности в данном случае не имеет значения, т.к. для изменения окраски индикатора необходимо прилить к раствору очень малый (менее 1 капли) избыток рабочего раствора.
2. Нейтрализация слабой кислоты сильным основанием (и наоборот)

СН3СООН + NaOH = CH3COONa + Н2O
В точке эквивалентности реакция среды будет щелочной вследствие гидролиза образующейся соли:
СН3СООˉ + Н2O = СН3СООН + ОНˉ
Скачок титрования находится в пределах рН от 7.8 до 10, а точка эквивалентности примерно при рН = 8.9, поэтому следует применять индикаторы, изменяющие окраску при рН > 7, например, фенолфталеин, у которого рТ = 9.
3. Нейтрализация слабого основания сильной кислотой (и наоборот)

NH4OH + HCl = NH4Cl + Н2O
В точке эквивалентности реакция среды будет кислой, вследствие гидролиза образующейся соли:
NH4+ + Н2O = NH4OH + H+
Скачок титрования находится в пределах рН от 4.0 до 6.2, а точка эквивалентности при рН = 5.1. Поэтому следует применять индикаторы, изменяющие окраску при рН < 7, например, метиловые оранжевый или красный. Таким образом, при выборе индикатора в методе нейтрализации необходимо учитывать следующее:
· индикатор должен изменять свой цвет при значениях рН близких к точке эквивалентности;
· переход цвета индикатора должен быть удобен для зрительного восприятия (порядок титрования). Например, фенолфталеин удобно использовать при титровании кислоты щелочью, т.к. при этом бесцветная окраска индикатора сменяется на малиновую.
Лабораторная работа №1. Приготовление раствора H2SO4 с С(½H2SO4) = 0.1 моль/л
Исходный раствор H2SO4 имеет:
ρ (плотность) = _____г/мл (найдена с помощью ареометра);
ω(массовая доля) = _____% (см. приложение 1);
а) расчет массы навески безводной H2SO4, необходимой для приготовления раствора с С(½H2SО4) = 0,1моль/л объемом 0,2 л; M(H2S04)= 98 г/моль;
m(H2SО4) = С(½H2SО4) × V(H2SО4) × М(½H2SО4) = …(г),
где М(½H2SО4) = ½ × М(H2SО4).
б) расчет массы навески раствора H2SO4 c ω(%) = …
m(H2SО4) × 100
m´(р-раH2SО4) = ——————— = …_(г).
ω
в) расчет объема раствора H2SO4 с ρ = … г/мл.
m´(р-раH2SО4)
V(р-ра H2SО4) = ——————— =_… (мл).
ρ (р-раH2SО4)
Примечание: m и m' рассчитывают с точностью до сотых долей единицы; V(H2SO4) – c точностью до сотых долей, затем округляют до десятых.
Приготовление раствора. Рассчитанный объем раствора H2SO4 отмеряют при помощи мерного цилиндра (или бюретки), осторожно вливают в мерную колбу, затем доливают до метки дистиллированной водой и тщательно перемешивают.
Окончание работы. Раствор из колбы переливают в бутылочку, на этикетке пишут факультет, номер группы, фамилию. Бутылочку с раствором ставят в лабораторный стол, на котором указан номер группы и факультет.
Приложение №1. Плотность и концентрация раствора серной кислоты.
| ρ, г/см
| 1,013
| 1,027
| 1,040
| 1,055
| 1,069
| 1,083
| 1,098
| 1,112
|
| ω, %
|
|
|
|
|
|
|
|
|
Лабораторная работа 2. Установление концентрации рабочего раствора серной кислоты по стандартному раствору тетрабората натрия Nа2В4О7.
Концентрация рабочего раствора С(1/2 Na2B4O7) =
0.l моль/л. Индикатор-метиловый оранжевый (интервал перемены окраски 3.1–4.4).
Уравнение реакции:
Na2B4О7 + 7Н2О = 2NaOH + 4Н3ВО3
Методика титрования.
Стандартный раствор буры объемом 10 мл, отмеренный пипеткой Мора, титруют раствором серной кислоты в присутствии 1 капли индикатора до появления оранжево-розовой окраски.
Для повышения точности титрования можно использовать "свидетель", который готовят, отмерив в колбу 10 мл воды, 1 каплю кислоты и1 каплю индикатора. Пробу титруют до появления такой же окраски как в колбе-свидетеле. Розовая окраска в конце титрования означает, что в колбе избыток кислоты около 1 капли.
Обработка результатов эксперимента.
Титрование проводят с точностью до сотых долей миллилитра. Из совокупности отдельных результатов отбросьте промахи (сходимость результатов 0,1 мл) и найдите среднее значение из трёх сходящихся результатов.
Расчет молярной концентрации эквивалента серной кислоты по закону эквивалентов:
C(1/2H2SO4) = 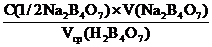 , моль/л
, моль/л
Концентрацию рассчитывают с точностью до трёх значащих цифр. Оформляют работу и сдают преподавателю.
Лабораторная работа 3. Определение концентрации и массы КОН или NaOH в растворе.
Концентрация рабочего раствора серной кислоты устанавливается в предыдущем опыте. Индикатор-метиловый оранжевый.
Уравнение реакции:
H2SO4 + 2NaOH = 2H2O + Na2SO4
Методика титрования.
Полученный в мерной колбе исследуемый раствор (задача) доводят дистиллированной водой до метки и тщательно перемешивают. Объём раствора, равный 10 мл, отмеренный пипеткой Мора, титруют раствором серной кислоты в присутствии 1 капли индикатора до появления оранжево-розового окрашивания. Возможно использование колбы–"свидетеля", приготовленного в предыдущей лабораторной работе.
Обработка результатов эксперимента.
Титрование проводят с точностью до сотых долей миллилитра. Из совокупности результатов выбирают три сходимых результата и рассчитывают средний объём щелочи, пошедший на титрование стандартного раствора.
Расчет концентрации и массы щелочи в исследуемом растворе:
а) по закону эквивалентов:
С (NaOH) =  , моль/л
, моль/л
б) m(NaOH) = C(NaOH) × м(NaOH) × V¢(NaOH) × 1000, мг,
где M(NaOH) — молярная масса эквивалента NaOH
V¢ (NaOH) = 0.1 л — объем задачи.
Результаты сдаются преподавателю. Расчеты проводят с точностью до трёхзначащих цифр.
Контрольные вопросы и задачи
1. Расчитайте молярную концентрацию раствора хлорида железа (III) с массовой долей FeCl3 10% и плотностью
1.092 г/мл.
2. Рассчитайте массовую долю азотной кислоты в растворе с молярной концентрацией 0.1783 моль/л и плотностью
1.01 г/мл.
3. В биохимическом анализе применяют хлорцинковую смесь, которую готовят растворением 50 г ZnSO4×7H2O и 250 г NaCl в 1 л дистиллированной воды (ρ(Н2O) = 1 г/мл). Рассчитайте массовую и молярную долю веществ в этой смеси.
4. Определите фактор эквивалентности и рассчитайте молярную массу эквивалента вещества, указанного в схемах реакции первым:
а) NaH2PO4 + NaOH → Na2HPO4 + H2O
б) H2SO4 + NaOH → NaHSO4 + Н2O
в) H2SO4 + NaOH → Na2SO4 + H2O
г) Cr2(SO4)3 + H2O + KOH → K2CrО4 + K2SO4 + H2O
д) NaBrO3 + KI + H2SO4 → NaBr + I2 + K2SO4 + H2O
ж) H2S + Br2 → S + HBr
5. Рассчитайте молярную массу эквивалента:
а) фосфорной кислоты в реакции полного обмена протонов;
б) сульфата железа (III) в реакции полного обмена ионов железа.
Рассчитайте молярную концентрацию эквивалента фосфорной кислоты (в реакции а), если 10 г кислоты содержится в объеме раствора 1,5л.
6. На нейтрализацию 10 мл раствора гидроксида натрия потребовалось 10.8 мл раствора щавелевой кислоты с
С(½ Н2С2О4) = 0.112 моль/л. Определите концентрацию раствора гидроксида натрия. Рассчитайте массу гидроксида натрия, необходимую для приготовления 200 мл такого раствора.
7. Для проведения химической реакции требуется сульфат магния массой 18 г. Какой объем раствора с С(½ MgSO4) = 0.02 моль/л содержит эту массу вещества?
8. Для определения содержания хлоридов в сыворотке крови используется 0.1 М водный раствор AgNO3. Рассчитайте массу нитрата серебра, необходимую для приготовления такого раствора объемом 100 мл.
9. На титрование раствора NaOH объемом 15 мл, в присутствии индикатора метилового оранжевого, израсходовано 13.53 мл рабочего раствора HCl с молярной концентрацией эквивалента 0.115 моль/л. Определите молярную концентрацию эквивалента раствора гидроксида натрия.
10. Какова молярная концентрация эквивалента Na2СО3, если в объёме 200 мл содержится 1.06 г карбоната натрия?
11. Какова масса буры Na2В4О7, необходимой для приготовления раствора объемом 0.25 л с молярной концентрацией эквивалента 0.1 моль/л?
12. Для дезинфекции ран в медицине применяется йодная настойка, представляющая собой раствор йода в спирте с массовой долей йода 5%. Вычислите: а) массу йода, содержащегося в йодной настойке массой 15 г; б) объём спирта и массу йода, необходимых для приготовления йодной настойки массой 500 г (плотность спирта 0.8 г/мл).
13. Для определения рекальцификации кровяной плазмы применяют раствор хлорида кальция с молярной концентрацией 0.025 моль/л (р=1г/см3), который готовят из сухого прокаленного вещества. Какова масса СаСl2, необходимого для приготовления требуемого раствора объемом 250 мл.




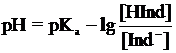



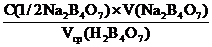 , моль/л
, моль/л , моль/л
, моль/л


