Лабораторная работа по теме: «АМИНОКИСЛОТЫ И БЕЛКИ»
Анализ аминокислотного состава белков при помощи цветных реакций.
В лабораторной практике для идентификации, полу количественного определения белков и отдельных аминокислот очень часто используются цветные реакции. В цветных реакциях происходит взаимодействие специфических реактивов с функциональными группами радикалов аминокислот, входящих в состав белков, или с пептидными группировками. Цветные реакции на белки проводят параллельно с растворами двух белков яичного белка (1) и желатина (2). Результаты оформляют в виде таблицы.
| № п/п
| Реакция
| Определяемая аминокис лота
| Применяемые реактивы
| Результаты
реакции: наличие(+) или отсутствие (-)
| Вывод. Сравнение аминокислота ого состава белков
|
|
|
|
|
| I
| II
|
|
|
| Биуретовая
|
|
|
|
|
|
|
| Ксанто протеиновая (нитрования)
|
|
|
|
|
|
| 3 3
| Миллона
|
|
|
|
|
|
|
| Фоля
|
|
|
|
|
|
Работа №1. Биуретовая реакция на белки
В щелочной среде раствор белка при добавлении разбавленного раствора сульфата меди окрашивается в сине-фиолетовый цвет. Окраска обусловлена образованием комплексов ионов меди с пептидными группами белка. Биуретовую реакцию дают все белки, а также олигопептиды, содержащие не менее двух пептидных связей.
Ход работы:
В одну пробирку наливают 5 капель раствора яичного бежа, в другую-5 капель раствора желатина. В каждую пробирку добавляют по 5 капель 10% раствора NaOH и по 1 капле 1 % раствора CuS04. В обеих пробирках наблюдают устойчивое сине-фиолетовое окрашивание. Оформление работы. Результаты опыта вносят в таблицу.
Рабата №2. Реакция на ароматические аминокислоты (реакция нитрования).
При нагревании с крепкой азотной кислотой растворы белка окрашиваются в желтый цвет Реакция обусловлена наличием в белках циклических аминокислот: фенил аланина, тирозина, триптофана - и основана на образовании нитропроизводных этих аминокислот:
После подщелачивания раствором NH4OH желтое окрашивание переходит в оранжевое (образуются аммонийные соли хиноидной структуры). Реакцию с азотной кислотой дают почти все белки, за исключением тех, в которых отсутствуют перечисленные аминокислоты.
Ход работы: В одну пробирку наливают 5 капель раствора яичного белка, во вторую – 5 капель раствора желатина. В обе пробирки добавляют по 3-5 капель концентрированный азотной кислоты и нагревают. В первый пробирке образуется белый осадок, который при нагревании окрашивается в желтый цвет и постепенно растворяется (происходит гидролиз белка), при этом раствор приобретает желтую окраску. Пробирки охлаждают, к охлажденному раствору добавляют (осторожно!) по 10 капель концентрированного раствора аммиака или 30% раствора гидроксида натрия и наблюдают изменение окраски растворов вследствие образования аммонийной соли динитротирозина. Результаты опыта вносят в таблицу.
Образование желтых пятен на коже при попадании азотной кислоты обусловлено этой реакцией.
Работа №3. Реакция на тирозин (реакция Миллона)
Реакция обусловлена наличием в белках аминокислоты тирозина. При нагревании или продолжительном стоянии раствора белка с реактивом Миллона (раствор нитратов ртути (1) и (2) в HNO3 с примесью HNO2) образуется осадок, окрашенный сначала в розовый, а затем в кроваво-красный цвет. Реактив Миллона дает окрашивание почти со всеми фенолами.
Ход работы:
В 3 пробирки наливают по 5капель: в 1-ю - раствора яичного белка, во 2-ю -раствора желатина, в 3-ю - раствора тирозина. Во все пробирки добавляют пo 2-3 капли реактива Миллона и осторожно нагревают. Наблюдают изменение окраски растворов и записывают в таблицу.
Практическая часть
Лабораторная работа по теме «БЕЛКИ»
Опыт№1: «ДИАЛИЗ БЕЛКОВ»
Диализ демонстрирует макромолекулярную природу белка. Как и все высокомолекулярные соединения, белок не проникает через искусственные (например, целлонам, пергамент и др.) и биологические мембраны, что позволяет использовать диализ как метод очистки белка от низкомолекулярных органических и неорганических примесей.
Метод основан на способности мембран задерживать макромолекулы белка и пропускать неорганические ионы.
Для приготовления раствора одну из смесей растворяют в 10 мг 50%-ного раствора муравьиной кислоты или в 10 мг дистиллированной волы, к которой добавляют несколько капель бутилового спирта.
Чтобы приготовить растворитель берут 4 части бутилового спирта, одну* часть ледяной уксусной кислоты и 5 частей дистиллированной волы жидкости наливают в делительную воронку, встряхивают в течение нескольких минут и оставляет для разделения слоев. Нижний олой сливают и используют для насыщения его парами камеры, в которой производится хроматография. Верхний насыщенный. водой бутилово-уксусньш слой, используют для хроматографии.
На дно хроматографической камеры наливают небольшое количество растворителя, который при испарении насыщает камеру парами, что предотвращает высыхание фильтровальной бумаги. В верхней части камера укрепляют ванночку, представляющей собой стеклянную трубку соответствующую длине камеры, запаянную с концов, имеющую продольный разрез шириной 2-3 мм, и наливают в нее растворитель.
Берут полоску хрономатографической бумаги шириной 5 см и, отступая от ее края на 8-10 см, при помощи микропипетки наносят 0,005-0,01 мл приготовленной смеси аминокислот. Образовавшееся пятно быстро просушивают над электроплиткой. Коней бумаги, ближе к которому нанесена капля смеси, опускают в ванночку с растворителем, а второй конец должен свободно свисать через отверстие в ванночке в камеру. Необходимо следить, чтобы полоска бумаги свисала строго вертикально и не прикасалась свободной концом ни к стенкам, ни ко дну камеры, ни к растворителю на дне камеры. В ванночке полоса бумаги фиксируется предметным стеклом или стеклянной палочкой.
В процессе хроматографии растворитель должен пройти вдоль всей полосы бумаги, увлекая за собой аминокислоты. Когда растворитель пройдет до конца полосы, ее извлекают из камеры и высушивают на воздухе в вытяжном шкафу. Для лучшего разделения смеси пропускание растворителя можно повторить. Высушенную полосу опрыскивают раствором 0,5%-ного нингидрина на ацетоне с добавлением уксусной кислоты и воды (95:1:4) и помещают в сушильный шкаф при температуре 60 °С на 10-15 чин. На высушенной полосе появляются отдельные лиловые пятна, соответствующие адсорбированныз аминокислот из взятой смеси.
Л абораторная работа по теме «БЕЛКИ»
Опыт №1:«ДИАЛИЗ БЕЛКОВ»
Диализ демонстрирует макромолекулярную природу белка. Как и все высокомолекулярные соединения, белок не проникает через искусственные (например, целлонам, пергамент и др.) и биологические мембраны, что позволяет использовать диализ как метод очистки белка от низкомолекулярных органических и неорганических примесей.
Метод основан на способности мембран задерживать макромолекулы белка и пропускать неорганические ионы.
Ход определения:
В две пробирки наливают по 1 -2 мл раствора яичного белка с хлоридом натрия. В первую пробирку добавляют 1-2 капли раствора азотнокислого серебра AgN03, во вторую - 2 мл NaOH и 1 -2 капли CuS04 (т.е. проделывают биуретовую реакцию качественную реакцию на пептидную связь в молекулах белка).
Целлофану, предварительно замоченному в дистиллированной воде, придают форму мешочка, который примерно на 1/3 заполняют исследуемым раствором белка. Края мешочка зажимают "между двумя стеклянными палочками, которые прижимают друг к другу с помощью надетых с двух концов резиновых палочек
Мешочек погружают в стакан с дистиллированной водой, положив зажимающие его стеклянные палочки на края стакана.
Через 45 мин. после начала диализа берут две пробы наружное жидкости. С одной из них проводят биуретовую реакцию на белок, с другой - реакцию на ион хлора, добавляя 2-3 капли AgNOa.
Проделывают пробы на белок и ион хлора с жидкостью внутри мешочка.
| Определяемые компоненты
| До диализа
| После диализа
|
|
| внешняя жидкость
| внутренняя жидкость
| Внешняя жидкость
| внутренняя жидкость
|
| Белок
|
|
|
|
|
| Ион СГ
|
|
|
| ■1
|
В выводах отметить, какое свойство белка демонстрирует метод диализа.
А -АМИЛАЗЫ СЛЮНЫ
Под влиянием фермента амилазы слюны крахмал гидролизустся сначала до декстринов, затем до дисахарида — мальтозы и под действием фермента мальтозы — до глюкозы.
Крахмал образует — с иодом синее окрашивание, декстрины — разную окраску в зависимости от их сложности; амилодекстрины - фиолетовую, эритродекстрины - краснобурую, ахродекстрины - желто-бурую. Отсутствие окраски указывает на образование мальтозы или глюкозы.
ХОД РАБОТЫ, В три пробирки наливают по 5 мл 1 % раствора крахмала
В пробирку № 1 добавляет 2-3 мл предварительно прокипяченной слюны
В пробирку № 2 и №3добавляют 2-3 мл разбавленной, но непрокипяченной слюны. Перемешивают содержимое пробирок и ставят пробирки № I и № 2 в водяную баню при температуре 38-40 °С Пробирку №3 ставят в сосуд со льдом. Через 15 минут во все пробирки добавляют по 2-3 капли раствора йода в йодистом калии
Наблюдают изменение окраски и делают вывод
А-АМИЛАЗЫ СЛЮНЫ
Изменение пространственного расположения активных участков молекулы фермента пол влиянием рН приводит к изменению активного центра фермента и изменению скорости ферментативной реакции
ХОД РАБОТЫ', В три пробирки наливают 0,2 М раствор двузамещенного фосфорнокислого натрия и 0,1 М раствор лимонной кислоты в соотношениях, указанных а таблице. Получают буферные растворы со значением рН - 4,0, 6,8, 10,0. В каждую пробирку добавляют по 5 ил 1% раствора крахмала и по I мл разбавленного раствора слюны в 5 раз Содержимое перемешивают и ставят в баню на 15 минут. Затем во все пробирки добавляют 1-2 капли йода в йодистом калии.
АМИЛАЗЫ
| №
пробы
| р
1Нр
| Соль
Na2HPO<0.2 М
| Лимонная
кислота
С 6 Н8 О7,
0,1 М
| Субстрат
крахмала 1%
| Фермент
амилаза
слюны 1-3
| Цвет 1 иодной
пробы
|
-
| 44,0
| 0,38
| 0,62
| 5мл
| 1мл
|
|
-
| 66,8
| 0,77
| 0,23
| 5мл
| 1мл
|
|
-
|
| 1мл + 1капля NaOH 0,1н
| -
| 5мл
| 1мл
|
|
ФОСФОЛИПИДЫ»
Куриного яйца
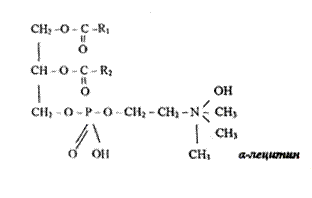
Понятие о лецитинах. Лецитины относятся к фосфоглицеридам (фосфатидилхолинам). При гидролизе лецитинов освобождается молекула глицерина, две молекулы жирных кислот (из которых одна является непредельной), молекулы фосфорной кислоты и азотистого основания холина.
Фосфорная кислота в молекуле лецитина соединена сложноэфирной связью со спиртовой группой холина

холин
В зависимости от того, к какому углеродному атому глицерина присоединен остаток холинфосфорной кислоты, выделяют а и р-лецитины. Лецитины различаются также по жирным кислотам, входящим в их состав.
Реактивы: 1) желток куриного яйца, б) этиловый спирт, в) ацетон, г) хлористый кадмий, насыщенный спиртовой раствор.
Ход работы:
В небольшой стаканчик вносят желток куриного яйца и, помешивая стеклянной палочкой, добавляют 10 мл горячего спирта. После остывания содержимое фильтруют в сухую пробирку. Фильтрат должен быть прозрачным.
Осаждение ацетоном.
В сухую пробирку наливают 2-3 мл ацетона и по каплям прибавляют спиртовой раствор лецитинов. Выпадает осадок. Так как лецитины в ацетоне не растворяются.
Осаждение хлористым кадмием
В сухой пробирке к 1 мл спиртового каплям насыщенный раствор хлористого кадмия. Выпадает белый осадок соединения лецитинов с хлористым кадмием.
Обнаружение холина.
После осаждения ацетоном осадок лецитинов нагревают с несколькими мл 10%-ного раствора едкого кали или едкого нарта. Лецитины гидролизуются на свои компоненты. При гидролизе происходит частичный распад холина с отщеплением триметиламина, обладающего селедочным
запахом.
Приборы: Штатив с пробирками, спиртовка, воронки, фильтры.
Реактивы. Раствор желтка (161), едкий натр 10%-ный раствор, лакмусовая бумажка, соляная кислота 10%-ный раствор, сернокислая медь 5%-ный раствор, молибденовый реактив.
Ход работы: В пробирку поместить 2 мл раствора желтка добавить 2 мл едкого натрия и прокипятить. Идет гидролитический распад лецитина Наряду с гидролизом лецитина распадается холин с образованием триметиламина, который можно обнаружить по посинению влажной лакмусовой бумажки, поднесенной к пробирке.
Обнаружение жирных кислот.
К гидролизату добавить 10%-иый раствор соляной кислоты (до кислой реакции среды по лакмусовой бумажке). В кислой среде жирные кислоты — в виде хлопьев (в щелочной они находятся в виде растворимых натриевых солей). Жирные кислоты отфильтровать, а фильтрат* использовать для следующих двух опытов.
Обнаружение глицерина.
К одной части фильтрата добавить 10%-ный раствор едкого натрия (до щелочной реакции среды) и 5%-ный раствор сернокислой меди. Образуется ярко-синий осадок глицерата меди.
Лабораторная работа по теме: «АМИНОКИСЛОТЫ И БЕЛКИ»
Анализ аминокислотного состава белков при помощи цветных реакций.
В лабораторной практике для идентификации, полу количественного определения белков и отдельных аминокислот очень часто используются цветные реакции. В цветных реакциях происходит взаимодействие специфических реактивов с функциональными группами радикалов аминокислот, входящих в состав белков, или с пептидными группировками. Цветные реакции на белки проводят параллельно с растворами двух белков яичного белка (1) и желатина (2). Результаты оформляют в виде таблицы.
| № п/п
| Реакция
| Определяемая аминокис лота
| Применяемые реактивы
| Результаты
реакции: наличие(+) или отсутствие (-)
| Вывод. Сравнение аминокислота ого состава белков
|
|
|
|
|
| I
| II
|
|
|
| Биуретовая
|
|
|
|
|
|
|
| Ксанто протеиновая (нитрования)
|
|
|
|
|
|
| 3 3
| Миллона
|
|
|
|
|
|
|
| Фоля
|
|
|
|
|
|








