Это совокупность методов качесвтенного и количественного анализа, основанных на электрохимических ялениях, происходящих в исследуемой среде лии на границе раздела фаз и связанных с изменением структуры х, химического состава или концентрации анализируемого вещества.
Делят на 5 основных групп:
· Потенциометрия – метод основан на измерении ЭДС обратимых электрохимических цепей
· Вольтамперометрия основана на исследовании зависимости тока поляризации от напряжения, прикладываемого к электрохимической ячейке
· Кулонометрия объединяет методы анализа, основанные на измерении количества вещества, выделяющегося на электроде в процессе электрохимической реакции в соответствии с законами Фарадея
· Кондуктометрия изменряет электропроводность растворов
· Диэлектрометрия основана на измерении диэлетрической проницаемости вещества
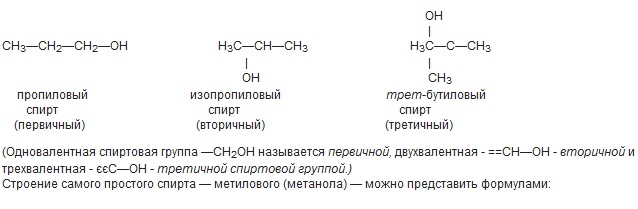
Предельные спирты.
имеющих общую формулу CnH2n+1OH, или в общем виде R—OH. В зависимости от характера углеродного атома (первичный, вторичный или третичный), с которым связана гидроксильная группа, различают спирты первичные, вторичные и третичные
Предельные одноатомные спирты от C1 до C12 — жидкости. Высшие спирты — мазеобразные вещества, от C21 и выше — твердые вещества.
Все спирты легче воды (плотность ниже единицы). Температура кипения спиртов нормального строения повышается с увеличением молекулярной массы. Спирты нормального строения кипят при более высокой температуре, чем спирты с изостроением. В воде хорошо растворяются метиловый, этиловый и пропиловый спирты. С увеличением молекулярной массы растворимость спиртов снижается. Низшие спирты легче воспламеняются и горят бесцветным пламенем. Спирты с большой молекулярной массой коптят при горении.
Химические свойства. Основные химические свойства спиртов определяются реакционноспособной гидроксильной группой. Химические реакции могут идти или только по водороду гидроксильной группы, или протекать с участием всей группы.
Реакции гидроксильного водорода.
1. Взаимодействие спиртов со щелочными металлами (образование алкоголятов). Спирты, как известно, обладают чрезвычайно слабыми кислотными. Однако атом водорода гидроксильной группы, обладая некоторой подвижностью, способен обмениваться в реакциях замещения на активные металлы:
2C2H6OH + 2Na ® 2C2H6ONa + H2
этилат
натрия
2. Образование простых эфиров.
Взаимодействием алкоголятов с галогеналкилами можно получить простые эфиры:
C2H6—ONa + I—C2H6 ® C2H6—O—C2H6 + NaI
диэтиловый
эфир
3. Образование сложных эфиров (реакция этерификации).
При реакции спиртов с кислотами (органическими или неорганическими) получаются соединения, которые называют сложными эфирами. Такая реакция получила название реакции этерификации (от лат. aether — эфир).
Если во взаимодействие со спиртом вводят органические (карбоновые) кислоты, то в качестве катализатора используют сильные минеральные кислоты:
O O
// H+ //
H3C—С—OH + HO—C2H5 «H3C—C—O—C2H5 + H2O
уксусная этиловый эфир
кислота уксусной кислоты
(этилацетат)
Замещение гидроксильной группы на галоген (образование галогенопроизводного):
C2H6OH + HCl «C2H6Cl + H2O
Такая реакция обратима, но можно равновесие сдвинуть вправо, если ее проводить в присутствии водоотнимающих средств (например, H2SO4(конц.), ZnCl2 и др.).
Замещение гидроксильной группы на галоген происходит также при взаимодействии спирта с PCl5.
Дегидратация спиртов (отщепление воды).
Реакция дегидратации может быть внутримолекулярной и межмолекулярной.
При внутримолекулярной дегидратации образуются алкеновые углеводороды. Легче дегидратируются третичные, затем вторичные и, наконец, первичные спирты.
Окисление спиртов.
Предельные спирты, в отличие от алканов, легко окисляются. Главный "виновник" этого — гидроксильная группа. При окислении первичных спиртов образуются альдегиды, а при окислении вторичных — кетоны. В качестве окислителей используют К2Сr2О7 + H2SO4 или KMnO4 + H2SO4. Третичные спирты более устойчивы к действию окислителей. Реакции окисления спиртов являются обратными реакциями восстановления альдегидов и кетонов.







