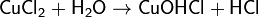Классическая теорияэлектролитическойдиссоциации быласоздана С. Аррениусом и В. Оствальдом в 1887 году. Аррениуспридерживалсяфизическойтеориирастворов, неучитывалвзаимодействиеэлектролитасводойисчитал, чтоврастворахнаходятсясвободныеионы. Русскиехимики И. А. Каблуков и В. А. Кистяковскийприменилидляобъясненияэлектролитическойдиссоциациихимическуютеориюрастворов Д. И. Менделеева идоказали, чтоприрастворенииэлектролитапроисходитегохимическоевзаимодействиесводой, врезультатекоторогоэлектролитдиссоциируетнаионы.
Классическаятеорияэлектролитическойдиссоциацииосновананапредположениионеполнойдиссоциациирастворённоговещества, характеризуемой степеньюдиссоциации α, т. е. долейраспавшихсямолекул электролита. Динамическоеравновесиемеждунедиссоциированными молекулами иионамиописывается закономдействующихмасс. Например, электролитическаядиссоциациябинарногоэлектролита KA выражаетсяуравнениемтипа:

Константадиссоциации  определяется активностями катионов
определяется активностями катионов  , анионов
, анионов  инедиссоциированныхмолекул
инедиссоциированныхмолекул  следующимобразом:
следующимобразом:

Значение  зависитотприродырастворённоговеществаирастворителя, атакжеоттемпературыиможетбытьопределенонесколькимиэкспериментальнымиметодами. Степеньдиссоциации (α) можетбытьрассчитанаприлюбойконцентрацииэлектролитаспомощьюсоотношения:
зависитотприродырастворённоговеществаирастворителя, атакжеоттемпературыиможетбытьопределенонесколькимиэкспериментальнымиметодами. Степеньдиссоциации (α) можетбытьрассчитанаприлюбойконцентрацииэлектролитаспомощьюсоотношения:
 ,
,
где  — среднийкоэффициентактивностиэлектролита.
— среднийкоэффициентактивностиэлектролита.
17. Особенностидиссоциациикислот, солей, оснований
Вещества, способныедиссоциироватьвводныхрастворахилирасплавах, называютэлектролитами. Книмотносятсякислоты, щелочи, соли. Рассмотримособенностиихдиссоциации.
Запишемуравнениеэлектролитическойдиссоциациикислот:
HCl? H + + Cl-
HNO3? H + + NO3-
H2SO4? 2H + + SO42-.
Кислотныеостаткивразличныхкислотразные, нообщимпризнакомвсехкислотявляетсяналичиевихрастворахгидратированныхкатионовводородаН3О + (вуравненияхдляупрощенияпишемН +).
Кислотаминазываютэлектролиты, придиссоциациикоторыхвводныхрастворахвкачествекатионовобразуютсятолькогидратированныеионыводорода.
Наличиекатионовводородаврастворахкислотприводитихобщиесвойства: кислыйвкус, общиехимическиесвойства, действиенаиндикаторы. Именноблагодаряэтомувсекислотыодинаковоизменяютокраскуиндикатороввсвоихрастворах.
Поколичествукатионовводорода, образующихсяврезультатедиссоциацииодноймолекулыкислоты, определяютосновностькислоты. Соляная HCl инитратная HNO3 кислотыявляетсяодноосновных. Сернаякислота H2SO4 - двухосновная, аортофосфатнакислота H3PO4 - трехосновных:
H3PO4? 3H + + PO43-.
Многоосновныекислотыдиссоциируютступенчато, постепенноотщепляяпоодномукатионуводорода. Диссоциацияпопервойступеньюобычнопроисходитвбольшейстепени, чемзавторымилитретьим.
Запишемуравнениеэлектролитическойдиссоциациищелочей:
NaOH? Na + + OH-
Ba (OH) 2? Ba2 + + 2OH-
Общимпризнакомвсехлуговявляетсяналичиевихрастворахгидроксид-анионов.
Лугаминазываютэлектролиты, придиссоциациикоторыхвводныхрастворахвкачествеанионовобразуютсятолькогидроксид-анионы.
Гидроксид-анионыврастворахщелочейпредопределяютихобщиесвойства: милкистьнаощупь, разрушительноевоздействиенакожу, бумагу, волосыит.д., воздействиенаиндикаторы.
Луга - ионныевещества, поэтомуихдиссоциацияявляетсяполной.
Рассмотримпримерыдиссоциациисолей:
NaNO3? Na + + NO3-
K2SO4? 2К + + SO42-
BaCl2? Ba2 + + 2Cl-.
Соляминазываютэлектролиты, придиссоциациикоторыхвводныхрастворахобразуютсягидратированныекатионыметаллическихэлементовианионыкислотныхостатков.
Cоли - ионныевещества, поэтомуихдиссоциацияявляетсяполной.
Слабыеэлектролиты
Слабыеэлектролиты — химическиесоединения, молекулы которыхдажевсильно разбавленныхрастворах незначительно диссоциированны на ионы, которыенаходятсявдинамическомравновесииснедиссоциированнымимолекулами. Кслабымэлектролитамотноситсябольшинствоорганическихкислотимногиеорганическиеоснованиявводныхиневодныхрастворах.
Слабымиэлектролитамиявляются:
· почтивсеорганическиекислотыивода;
· некоторыенеорганическиекислоты: HF, HClO, HClO2, HNO2, HCN, H2S, HBrO, H3PO4,H2CO3, H2SiO3, H2SO3 идр.;
· некоторыемалорастворимыегидроксидыметаллов: Fe(OH)3, Zn(OH)2 идр.
[править]Сильныеэлектролиты
Сильныеэлектролиты — химическиесоединения, молекулы которыхвразбавленныхрастворахпрактическиполностью диссоциированы на ионы. Степеньдиссоциации такихэлектролитовблизкак 1. Ксильнымэлектролитамотносятсямногиенеорганические соли, некоторыенеорганические кислоты и основания вводныхрастворах, атакжеврастворителях, обладающихвысокойдиссоциирующейспособностью (спирты, амиды идр.).
Классическаятеорияэлектролитическойдиссоциацииприменималишькразбавленнымрастворам слабыхэлектролитов. Сильныеэлектролиты в разбавленныхрастворахдиссоциированыпрактическиполностью, поэтомупредставленияоравновесиимеждуионамиинедиссоциированнымимолекуламилишеносмысла. Согласнопредставлениям, выдвинутымв 20—30-хгг. 20 в. В. К. Семенченко (СССР), Н. Бьеррумом (Дания), Р. М. Фуоссом (США) идр., врастворахсильныхэлектролитовприсреднихивысокихконцентрацияхобразуютсяионныепарыиболеесложныеагрегаты. Современные спектроскопические данныепоказывают, что ионнаяпара состоитиздвухионовпротивоположногознака, находящихсявконтакте («контактнаяионнаяпара») илиразделённыходнойилинесколькимимолекуламирастворителя («разделённаяионнаяпара»). Ионныепарыэлектрическинейтральныинепринимаютучастиявпереносеэлектричества. Всравнительноразбавленныхрастворахсильныхэлектролитовравновесиемеждуотдельнымисольватированнымиионамииионнымипарамиможетбытьприближённоохарактеризовано, аналогичноклассическойтеорииэлектролитическойдиссоциации, константойдиссоциации (илиобратнойвеличиной —константойассоциации). Этопозволяетиспользоватьвышеприведённоеуравнениедлярасчётасоответствующейстепенидиссоциации, исходяизэкспериментальныхданных.
Впростейшихслучаях (большиеодноатомныеоднозарядныеионы) приближённыезначенияконстантыдиссоциациивразбавленныхрастворахсильныхэлектролитовможновычислитьтеоретически, исходяизпредставленийочистоэлектростатическомвзаимодействиимеждуионамивнепрерывнойсреде —растворителе.
Примерысильныхэлектролитов: некоторые кислоты (HClO4, HMnO4, H2SO4, HCl, HBr; HI), гидроксиды щелочных и щёлочноземельных металлов (NaOH, KOH, Ba(OH)2); большинство солей.
Степеньдиссоциации — величина, характеризующаясостояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
"Степеньдиссоциацииэтоестьотношениячислапродиссоциируемыхмолекулкобщемучислумолекулиумноженномуна 100%":

числараспавшихсяна ионы молекул кобщемучислурастворенныхмолекул.
Степеньдиссоциации  равнаотношениючисладиссоциированныхмолекул
равнаотношениючисладиссоциированныхмолекул  ксумме
ксумме  , где
, где  — числонедиссоциированныхмолекул. Часто
— числонедиссоциированныхмолекул. Часто  выражаютвпроцентах. Степеньдиссоциациизависиткакотприродырастворённогоэлектролита, такиотконцентрациираствора.
выражаютвпроцентах. Степеньдиссоциациизависиткакотприродырастворённогоэлектролита, такиотконцентрациираствора.
19. Особенностиреакцийврастворахэлектролитов
Врастворахэлектролитовприсутствуютионы, подвижностькоторых, какправило, выше, чемнедиссоциированныхмолекул. Крометого, большинствоионовобладаютвысокойреакционнойспособностью. Поэтомухимическиереакцииврастворахэлектролитовпротекают, какправило, свысокимискоростями, ихимическоеравновесиебольшинствапроцессовустанавливаетсябыстро.
Химическиесвойствараствораэлектролитаскладываютсяизсвойствобразующихегоионов. Группаэлектролитов, содержащаяодинитотжевидионов, обладаетсходнымихимическимисвойствами. Так, всерастворы, содержащиехлорид-ионы  , придобавлениикнимрастворанитратасеребра
, придобавлениикнимрастворанитратасеребра  даютбелыйосадокхлоридасеребраAgCl. Подобныекачественныереакциинаданныйвидионовширокоиспользуютсяваналитическойхимииприопределениисоставарастворов.
даютбелыйосадокхлоридасеребраAgCl. Подобныекачественныереакциинаданныйвидионовширокоиспользуютсяваналитическойхимииприопределениисоставарастворов.
Основнымфактором, влияющимнасмещениеравновесияврастворахэлектролитов, являетсяизменениеконцентрацииионов. Поэтомуобменныереакцииврастворахидутвсторонумалорастворимыхвеществилислабыхэлектролитов. Этоправилолегкообъяснимо, таккакврезультатепротеканиятакихпроцессоводинилинескольковидовионоввыводятсяизсферывзаимодействия, чтовсоответствииспринципомЛеШательедолжнопривестикболееполномупротеканиюреакции. Малорастворимыевеществамогутвыводитсяизраствораиливвидеосадка, иливвидегаза. Слабымиэлектролитамимогутбытькислотыиоснования, водаикомплексы.
20. Ио́нноепроизведе́ниеводы́ — произведение концентраций ионов водорода Н+ иионов гидроксила OH− в воде иливводных растворах, константаавтопротолиза воды.
Водоро́дныйпоказа́тель, pH (произносится«пэаш», английскоепроизношение англ. pH — piː'eɪtʃ «Пиэйч») —мера активности (воченьразбавленныхрастворахонаэквивалентна концентрации) ионов водорода в растворе, иколичественновыражающаяегокислотность, вычисляетсякакотрицательный (взятыйсобратнымзнаком) десятичный логарифм активности водородныхионов, выраженнойв молях налитр:

Гидролизсолей
Гидролизсолей — разновидностьреакцийгидролиза, обусловленногопротеканиемреакцийионногообменаврастворах (преимущественно, водных) растворимыхсолей-электролитов. Движущейсилойпроцессаявляетсявзаимодействие ионов сводой, приводящеекобразованиюслабого электролита вионномили (реже) молекулярномвиде («связываниеионов»).
Различаютобратимыйинеобратимыйгидролизсолей[1]:
· 1. Гидролизсолислабойкислотыисильногооснования (гидролизпоаниону):


(растворимеетслабощелочнуюсреду, реакцияпротекает обратимо, гидролизповторойступенипротекаетвничтожнойстепени)
· 2. Гидролизсолисильнойкислотыислабогооснования (гидролизпокатиону):

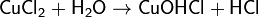
(растворимеетслабокислуюсреду, реакцияпротекает обратимо, гидролизповторойступенипротекаетвничтожнойстепени)
· 3. Гидролизсолислабойкислотыислабогооснования:


(равновесиесмещеновсторонупродуктов, гидролизпротекает практическиполностью, таккакобапродуктареакцииуходятиззоныреакцииввидеосадкаилигаза).
Сольсильнойкислотыисильногооснованиянеподвергаетсягидролизу, ирастворнейтрален. См. также Электролитическаядиссоциация.
21.Окисли́тельно-восстанови́тельныереа́кции, ОВР, редокс (от англ. redox ← reduction-oxidation — окисление-восстановление) —этовстречно-параллельныехимическиереакции, протекающиесизменением степенейокисления атомов, входящихвсоставреагирующихвеществ, реализующихсяпутёмперераспределенияэлектроновмеждуатомом-окислителемиатомом-восстановителем.




 определяется активностями катионов
определяется активностями катионов  , анионов
, анионов  инедиссоциированныхмолекул
инедиссоциированныхмолекул  следующимобразом:
следующимобразом:
 ,
, — среднийкоэффициентактивностиэлектролита.
— среднийкоэффициентактивностиэлектролита.
 равнаотношениючисладиссоциированныхмолекул
равнаотношениючисладиссоциированныхмолекул  ксумме
ксумме  , где
, где  — числонедиссоциированныхмолекул. Часто
— числонедиссоциированныхмолекул. Часто  , придобавлениикнимрастворанитратасеребра
, придобавлениикнимрастворанитратасеребра  даютбелыйосадокхлоридасеребраAgCl. Подобныекачественныереакциинаданныйвидионовширокоиспользуютсяваналитическойхимииприопределениисоставарастворов.
даютбелыйосадокхлоридасеребраAgCl. Подобныекачественныереакциинаданныйвидионовширокоиспользуютсяваналитическойхимииприопределениисоставарастворов.