Химические свойства алкинов объясняет наличие тройной связи в молекуле алкина. Типичная реакция для алкинов – реакция присоединения, которая протекает в 2 стадии. На первой происходит присоединение и образование двойной связи, а на второй – присоединение к двойной связи. Реакция у алкинов протекает медленнее, чем и алкенов, т.к. электронная плотность тройной связи «размазана» более компактно, чем у алкенов, и поэтому менее доступна для реагентов.
1. Галогенирование. Галогены присоединяются к алкинам в 2 стадии. Например,
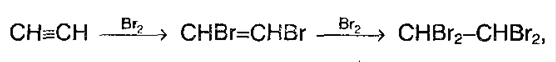
А суммарно: 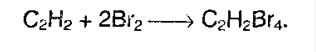
Алкины также как алкены обесцвечивают бромную воду, поэтому эта реакция является качественной и для алкинов. 2.Гидрогалогенирование. Галогенводороды присоединяются к тройной связи труднее, чем к двойной. Для ускорения (активации) процесса используют сильную кислоту Льюиса – AlCl3. Из ацетилена при таких условиях модно получить винилхлорид, который идет на производства полимера – поливинилхлорида: 
Если же галогенводород в избытке, то реакция идет по правилу Марковникова: 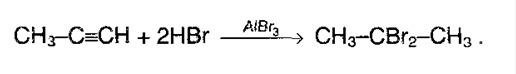
3. Гидратация (присоединение воды). Реакция протекает только в присутствии солей ртути (II) в качестве катализатора: 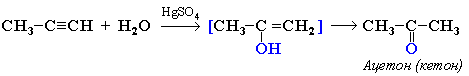
На 1ой стадии образуется непредельный спирт. Такие спирты называются виниловыми или фенолами. Отличительная черта таких спиртов – неустойчивость. Они изомеризуются в более стабильные соединения (альдегиды и кетоны) вследствие переноса протона от ОН -группы к углероду при двойной связи. Те алкины, которые имеют концевую тройную связь, могут отщеплять протон под действием сильных кислотных реагентов. Такой процесс обусловлен сильной поляризацией связи. Причиной поляризации служит сильная электроотрицательность атома углерода в sp -гибридизации, поэтому алкины могут образовывать соли – ацетилениды:
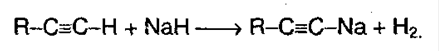
Ацетилениды меди и серебра легко образуются и выпадают в осадок (при пропускании ацетилена через аммиачный раствор оксидасеребра или хлорида меди). Эти реакции являются качественными на концевую тройную связь:

Полученные соли легко разлагаются под действием HCl, в результате выделяется исходный алкин: 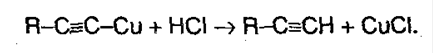
Поэтому алкины легко выделить из смеси других углеводородоров. 5. Полимеризация. При участии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий, могут образовываться различные продукты. Например, под воздействием хлорида меди (I) и хлорида аммония: 
Винилацетилен (полученное соединение) присоединяет хлороводород, образуя хлорпрен, который служит сырьем для получения синтетического каучука:

Реакция окисления и восстановления. Алкины легко окисляются перманганатом калия. Раствор обесцвечивается, т.к. в исходном соединении есть тройная связь. При окислении происходит расщепление тройной связи с образованием карбоновой кислоты: 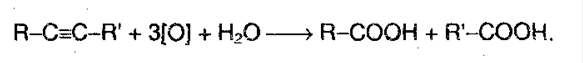 В присутствие металлических катализаторов происходит восстановление водородом:
В присутствие металлических катализаторов происходит восстановление водородом:

30. Ацетилен – это один из наиболее значимых углеводородов с тройной связью. Он является первым представителем ряда ацетилена, а также бесцветным газом, который практически не растворим в воде. Молекула ацетилена имеет на два атома водорода меньше, чем в молекуле этилена, и при этом характерно образование третьей связи между атомами углерода.
Применение ацетилена:
1) может применяться в качестве горючего при газовой сварке и резке металлов;
2) используется также для синтеза различных органических соединений;
3) в результате присоединения хлора к ацетилену получают растворитель – 1,1,2,2-тетрахлорэтан. Путем дальнейшей переработки тетрахлорэтана получаются другие хлорпроизводные;
4) при отщеплении хлороводорода от 1,1,2,2-тетрахлорэтана образуется трихлорэтен – растворитель высокого качества, который широко применяется при чистке одежды: СНСI = ССI2;
5) в больших количествах ацетилен идет на производство хлорэтена, или винилхлорида, с помощью полимеризации которого получается поливинилхлорид (используется для изоляции проводов, изготовления плащей, искусственной кожи, труб и других продуктов);
6) из ацетилена получаются и другие полимеры, которые необходимы в производстве пластмасс, каучуков и синтетических волокон.
31. Ароматические углеводороды (арены) -углеводороды, в молекулах которых есть одно или несколько бензольных колец. Состав аренов с одним бензольным кольцом отвечает общей формуле C n H 2n-6. В молекуле простейшего арена - бензола (C6H6) -  -связи образуют единую делокализованную сопряженную (ароматическую) систему
-связи образуют единую делокализованную сопряженную (ароматическую) систему  -связей.
-связей.
Строение молекулы простейшего арена - бензола - может быть передано структурными формулами различных типов:
 (Строение-Кекуле-1825 г. Три 2-ые связи)
(Строение-Кекуле-1825 г. Три 2-ые связи)
31. Изомерия и номенклатура углеводородов Для гомологов бензола характерна изомерия положения нескольких заместителей. Простейший гомолог бензола — толуол (метил-бензол) не имеет таких изомеров, следующий гомолог представлен в виде четырех изомеров:

Основой названия ароматического углеводорода с небольшими заместителями является слово бензол. Атомы в ароматическом кольце нумеруют, начиная от старшего заместителя к младшему:
 По номенклатуре положения 2 и 6 называют орто-положениями, 4 — пара-, а 3 и 5 — жета-положениями.
По номенклатуре положения 2 и 6 называют орто-положениями, 4 — пара-, а 3 и 5 — жета-положениями.
32. Физические свойства углеводородов Бензол и его простейшие гомологи в обычных условиях весьма токсичные жидкости с характерным неприятным запахом. Они плохо растворяются в воде, но хорошо — в органических растворителях.
33.Способы получения Основным источником промышленного получения бензола и его гомологов является нефть и каменноугольная смола — один из продуктов сухой перегонки (коксования) каменного угля. Среди синтетических способов получения аренов можно выделить две группы: получение собственно ароматического кольца и введение в кольцо углеводородного заместителя. Для получения бензола и его гомологов можно использовать следующие реакции:
1. Дегидрирование циклогексана
 2. Ароматизация (дегидроциклизация) алканов. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных.
2. Ароматизация (дегидроциклизация) алканов. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных.
3. Синтез Вюрца:
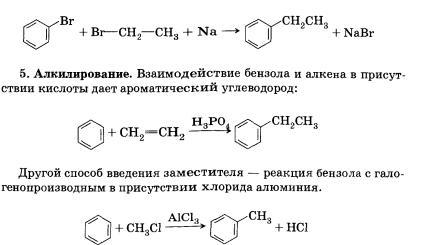
34.Химические свойства углеводородов
Реакции замещения
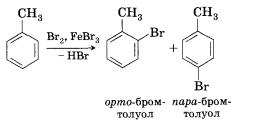
1. Бромирование. При реакции с бромом в присутствии катализатора, бромида железа(ІІІ), один из атомов водорода в бензольном кольце может замещаться на атом брома:
2. Нитрирование.При взаимодействии ароматического углеводорода с азотной кислотой в присутствии серной (смесь серной и азотной кислот называют нитрующей смесью) происходит замещение атома водорода на нитрогруппу —NO2.
Реакции присоединения 1. Гидрирование. Каталитическое гидрирование бензола протекает при более высокой температуре, чем гидрирование алкенов. 2. Хлорирование. Реакция идет при освещении ультрафиолетовым светом и является свободнорадикальной.
Механизмы реакций бромирования этена и бензола:

Катализатором описанной выше реакции является бромид железа(III), который, присоединяясь к молекуле брома, способствует образованию частицы Вг+ — активного электрофила. По электрофильному механизму идут многие реакции, в которых принимает участие бензол и другие ароматические соединения.
Нитрование




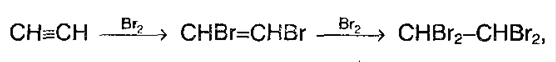
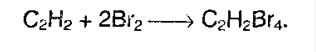


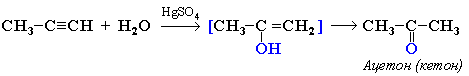
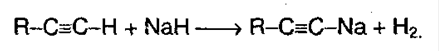

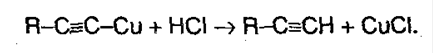


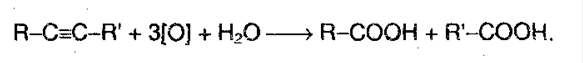 В присутствие металлических катализаторов происходит восстановление водородом:
В присутствие металлических катализаторов происходит восстановление водородом:
 -связи образуют единую делокализованную сопряженную (ароматическую) систему
-связи образуют единую делокализованную сопряженную (ароматическую) систему  (Строение-Кекуле-1825 г. Три 2-ые связи)
(Строение-Кекуле-1825 г. Три 2-ые связи)
 По номенклатуре положения 2 и 6 называют орто-положениями, 4 — пара-, а 3 и 5 — жета-положениями.
По номенклатуре положения 2 и 6 называют орто-положениями, 4 — пара-, а 3 и 5 — жета-положениями. 2. Ароматизация (дегидроциклизация) алканов. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных.
2. Ароматизация (дегидроциклизация) алканов. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных.






