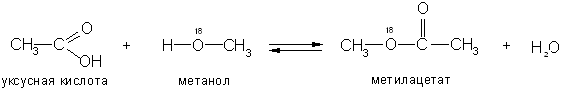К двухосновным предельным кислотам относятся:
Эти кислоты получают теми же методами, что и одноосновные: окислением гликолей, омылением динитрилов и т.д.
Двухосновные кислоты – бесцветные кристаллические вещества, растворимые в воде.
Для многоосновных кислот характерны все реакции протекающие с одноосновными кислотами, причем возможно взаимодействие как по одной функциональной группе, так и по всем имеющимся группам. Например, двухосновные кислоты содержат две карбоксильные группы, поэтому они дают два ряда производных; средние и кислые соли, полные и неполные сложные эфиры.
Вместе с тем наличие двух карбоксилов в одной молекуле обусловливает некоторые особенности в химических свойствах двухосновных кислот.
1. В зависимости от взаимного расположения карбоксильных групп в углеродной цепи. Они по разному ведут себя при нагревании.
а) Щавелевая и малоновая кислоты и одно- и двухзамещенные гомологи последней при нагревании декарбоксилируются:
б) янтарная и глутаровая кислоты и их гомологи при нагревании образуют циклические ангидриды
в) полный амид янтарной кислоты и ее гомологов при нагревании образуют имид:
г) при пиролизе кальциевых или бариевых солей адипиновой, пимелиновой, пробковой кислот образуются циклические кетоны с отщеплением СО2:
2. В малоновой кислоте две карбоксильные группы, связанные с метиленовой группой, обуславливают на последней значительный недостаток электронной плотности, что приводит к повышению реакционной способности атомов водорода в этой группе. С участием этих атомов малоновая кислота вступает в различные реакции замещения.
В эфирах малоновой кислоты они легко замещаются атомами щелочных металлов:
Натриймалоновый эфир весьма устойчив и способен реагировать с различными галогенсодержащими соединениями. Это его свойство используется для синтеза различных карбоновых кислот
Билет №11. Ароматические карбоновые кислоты: определение, классификация,физ. и хим. свойства.
Органические карбоновые кислоты характеризуются наличием карбоксильной групп ─СООН. По числу этих групп различают одно–, двух– и вообще многоосновные кислоты. Органические кислоты могут быть алифатическими (предельными и непредельными), алициклическими, ароматическими.
Номенклатура и изомерия
Изомерия карбоновых кислот определяется строением радикала, связанного с карбоксильной группой.
По номенклатуре ИЮПАК кислоты называют по соответствующим углеводородам с добавлением окончания –овая и слова кислота, причем нумерация цепи начинается с углерода карбоксильной группы. Однако, в большинстве случаев, используют тривиальные названия.
Иногда при составлении рациональных названий кислот с разветвленной цепью атомов углерода их рассматривают как производные уксусной кислоты, в молекуле которой атомы водорода метильной группы замещены радикалами, например:
Способы получения
1. Окисление органических соединений (углеводородов, спиртов, альдегидов, кетонов):
2. Гидролиз нитрилов
3. Действие двуокиси углерода на металлорганические соединения:

4. Оксосинтез. Взаимодействие олефинов с оксидом углерода (II) и водяным паром в присутствии катализаторов (тетракарбонил никеля, фосфорной кислоты и др.) при температуре 300–4000С и давлении 2–5∙107 Па дает смесь кислот нормального и изостроения:
5. Гидролиз тригалогенопроизводных, содержащих галоген у одного углеродного атома:
6. Ароматические кислоты могут быть получены окислением гомологов бензола:
7. Кроме того, ароматические карбоновые кислоты могут быть получены:
а) сплавлением ароматических сульфатов с формиатами и цианидами
б) реакцией ароматических соединений с галогенопроизводными угольной кислоты:
Физические свойства
В зависимости от строения карбоновые кислоты являются жидкостями или твердыми телами. Уменьшение длины углеродного скелета или появление дополнительной карбоксильной группы увеличивают растворимость кислоты в воде. На физические свойства кислот оказывают влияние ассоциация молекул вследствие образования водородных связей. Кислоты образуют более прочные водородные связи, чем спирты, так как связи О─Н в них в большей степени поляризованы. В твердом, жидком и даже в некоторой степени в парообразном состоянии карбоновые кислоты существуют в виде димеров:
Ароматические кислоты кипят при несколько более высоких и плавятся при значительно более высоких температурах, чем кислоты жирного ряда с тем же числом углеродных атомов. В водных растворах ароматические монокарбоновые кислоты обнаруживают большую степень диссоциации, чем кислоты жирного ряда: константа диссоциации бензойной кислоты 6,6∙10-5, уксусной кислоты 1,75∙10–5.
Химические свойства
Кислотный характер карбоновых кислот ярко выражен. Это объясняется взаимным влиянием атомов в карбоксильной группе: в ней электронная плотность смещена в сторону наиболее электроноакцепторного атома кислорода
Это ослабляет связь между кислородом и водородом и облегчает отделение иона водорода, т.е. диссоциацию кислоты.
Появление пониженной электронной плотности (δ+) на центральном углеродном атоме карбоксила приводит также к стягиванию σ–электронов соседней углерод-углеродной связи к карбоксильной группе и появлению пониженной электронной плотности (δ+) на α–углеродном атоме кислоты.
Сдвиг электронной плотности в молекуле недиссоциированной карбоновой кислоты понижает электронную плотность на гидроксильном атоме кислорода и повышает ее на карбонильном. Этот сдвиг еще больше увеличивается у аниона кислоты.
Результатом сдвига является полное выравнивание зарядов в анионе, названное мезомерией карбоксиланиона. Выравнивание электронной плотности приводит к выигрышу в энергии и для многих реакций является движущей силой, называемой энергией резонанса.
Наличие электрофильных заместителей в радикале, особенно в α–положении, кратных связей, или появление второй карбоксильной группы приводит к возрастанию кислого характера.
1. Карбоновые кислоты способны образовывать соли с металлами, их оксидами, гидроксидами, аммиаком:
2. Характерной реакцией карбоновых кислот является их способность образовывать со спиртами в присутствии минеральных кислот сложные эфиры – реакция этерификации:
Роль катализатора в реакции этерификации играют ионы водорода. Механизм реакции этерификации описывается следующим образом:
а) кислород карбонильной группы кислоты, захватывая протон, образует карбкатион I:
Карбкатион I присоединяет молекулу спирта за счет неподеленных электронных пар атома кислорода с образованием промежуточного тетраэдрического комплекса II, который способен обратимо распадаться с отщеплением воды и образованием нового карбокатиона сложного эфира III. При диссоциации последнего образуется сложный эфир, причем освобождается катализатор протон.
Большой интерес представляет вопрос кислота или спирт отщепляют гидроксил в реакциях этерификации.
С помощью «меченых атомов» (тяжелого изотопа кислорода 18О) было показано, что вода при этерификации образуется за счет водорода спирта и гидроксила кислоты:
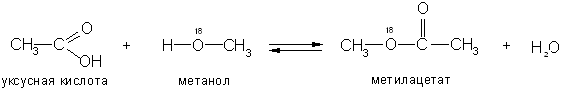
Сложные эфиры получают также взаимодействием галогенацилов со спиртами и алкоголятами и нагреванием солей карбоновых кислот с галогеналкилами и действием спиртов на ангидриды кислот
Сложные эфиры низших кислот и спиртов – жидкости с приятным запахом, в некоторых случаях напоминающих запах плодов. Например: изоамилацетат – грушевая эссенция.
Для сложных эфиров характерны реакции гидролиза и переэтерификации:
3. При действии галогенидов фосфора и серы на карбоновые кислоты образуются галогенангидриды кислот. При этом, как и в случае спиртов, гидроксил замещается галогеном:
Галогенангидриды кислот можно называть по кислоте и галогену, например бромангидрид масляной кислоты. Но чаще их называют по кислотному радикалу - ацилу. Перед названием ацила указывают галоген:
Низшие галогенангидриды – жидкости с весьма резким запахом, раздражающим слизистые оболочки.
При взаимодействии галагенангидридов с соединениями, содержащими атом металла или активный атом водорода, происходит замена его кислотным остатком – ацилом. Подобные реакции называются ацилированием и позволяют получить все производные кислот: ангидриды, кислоты, сложные эфиры, амиды, пероксиды и т.д.
Все эти реакции являются реакциями нуклеофильного замещения и идут в большинстве случаев по тетраэдрическому механизму.
4. При дегидратации кислот или при взаимодействии солей кислот с их галогенангидридами образуются ангидриды кислот:
Ангидриды низших кислот – легкоподвижные жидкости с острым запахом; в воде плохо растворимы или вовсе не растворимы. Кипят при более высокой температуре, чем соответствующие кислоты.
Ангидриды кислот обладают большой химической активностью и являются, как и галогенангидриды, хорошими ацилирующими агентами:
Большое значение имеет реакция получения фторангидрида.
5. При пропускании паров кислот вместе с аммиаком над дегидратирующими катализаторами получаются амиды кислот:
Амиды кислот получают также действием NH3 на галогенангидриды или ангидриды кислот или из аммонийных солей кислот:
Амиды кислот – кристаллические вещества (кроме жидкого амида муравьиной кислоты – формамида).
Амиды, за счет сопряжения свободной электронной пары азота с карбонильным кислородом, почти лишены основных свойств
Наиболее важным для амидов являются реакции:
а) гидролиза в кислой или щелочной среде
б) дегидратации в присутствии пентаоксида фосфора
О нитрилах кислот подробнее смотрите в главе «Азотсодержащие соединения».
6. Галогензамещенные кислоты могут быть получены при действии молекулярного хлора или брома на карбоновые кислоты. Наиболее легко α-галогензамещенные производные кислот образуются из ангидридов и галогенангидридов: