

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Интересное:
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Галогенопроизводными называются органические соединения, образующиеся при замене атомов водорода в углеводородах на атомы галогенов.
В зависимости от числа атомов водорода, замещенных галогеном, различают моно-, ди-, три- и поли - галогенопроизводные.
СН3Cl, CH2Cl2, CHCl3 CCl4
хлористый метил хлористый метилен хлороформ четыреххлористый углерод
В зависимости от характера органического радикала, связанного с галогеном, различают насыщенные, ненасыщенные, алифатические, алициклические, ароматические галогенопроизводные:

Названия простейших моногалогенопроизводных производят от названий соответствующих одновалентных радикалов прибавлением слова хлористый, бромистый, фтористый, йодистый.
Изомерия моногалогенопроизводных обусловлена строением углеродного скелета и положением атома галогена. В полигалогенопроизводных появляется еще одна причина: взаимное расположение галогенов в молекуле.
Галогенопроизводное считается первичным, если галоген связан с первичным атомом углерода, вторичным – если связан со вторичным, третичным - если с третичным.
Галогенопроизводные, у которых все имеющиеся в молекуле атомы водорода замещены на галоген, называется – пергалогенпроизводными:
CF3-CF3, CF2=CF2
перфторэтан перфторэтилен
По номенклатуре ИЮПАК галоген в названии указывается как заместитель с обозначением его положения в цепи цифрой (см. главу 1).

Способы получения
1. Замещение атомов водорода в углеводородах на галоген
а) галогенирование предельных углеводородов протекает по радикальному механизму при облучении:

Замещение может идти и дальше.
Фтористые алкилы получают обычно действием фтористого серебра на йодистые алкилы:
|
|

или действием на алканы CoF3 – последний при 200 оС медленно выделяет F2:
2CoF3  → 2CoF2 + F2
→ 2CoF2 + F2
CH3-CН3 + 12CоF3 → CF3-CF3 + 6HF + 12 CоF2
б) бензол и его гомологи галогенируются легче, чем алканы. Причем на холоде и в присутствии катализатора (хлоридов тяжелых металлов) галоген замещает атомы водорода в бензольном ядре, а при нагревании или на свету в отсутствии катализатора замещаются атомы водорода в боковой цепи:

в). При высоких температурах (400 – 600 оС) удается заместить атомы водорода в алкенах, не нарушая кратной связи:

2. Присоединение галогенов или галогеноводородов к ненасыщенным углеводородам:

3. Получение галогенопроизводных из спиртов. Чаще всего на спирты действуют галогенидами фосфора, серы, а также галогеноводородными кислотами в присутствии водоотнимающих средств:

4. Общий метод синтеза дигалогенопроизводных – это действие пентахлорида или пентабромида фосфора на альдегиды и кетоны:

При этом получаются соединения с двумя атомами галогена при одном атоме углерода.
5. Хлороформ, бромоформ, йодоформ можно получить действием соответствующего галогена в щелочном растворе на ацетальдегид

Физические свойства
Низшие алкилгалогениды – газообразные вещества, средние – жидкости, высшие – твердые тела. Физические свойства галогенопроизводных зависят от строения радикала, вида и количества атомов галогена в молекуле. С увеличением длины углеродной цепочки и с переходом от фтора к йоду температура кипения и плотность моногалогенопроизводных возрастает. Дигалогенопроизводные – тяжелые масла или твердые вещества. Все галогенопроизводные практически нерастворимы в воде, хорошо растворимы в органических растворителях, большинство имеют специфический, часто резкий запах, раздражающий слизистую оболочку, некоторые обладают анестезирующим действием (СН2Сl2, СНСl3), токсичны, являются антисептиками (СНJ3).
|
|
Химические свойства
Большинство галогенопроизводных углеводородов - весьма реакционноспособные соединения, широко применяемые в разнообразных синтезах. Это определяется тем, что атом любого галогена обладает большим сродством к электрону, чем атом углерода. σ-Связь C─Halg в галогеналкилах сильно поляризована, что приводит к возникновению пониженной электронной плотности на атоме углерода и повышенной на атоме галогена. Для органических молекул характерна так называемая поляризуемость, т.е. cпособность увеличивать полярность связи при подходе атакующего реагента. Поляризуемость связи тем больше, чем более объемиста и подвижна электронная оболочка атомов, образующих связь. Так, если полярность связей C-F, C-Cl, C-Br и C-J довольно близка, то поляризуемость связи C-J значительно больше, чем связи C-F. В точном соответствии с поляризуемостью во всех реакциях нуклеофильного замещения иодпроизводные максимально активны, а фторопроизводные практически не реакционноспособны.
На реакционную способность галогена оказывает большое влияние, и строение органического радикала. При нахождении галогена у углерода с кратной связью свободная электронная пара атома галогена сопряжена с π-электронами двойной связи:

Это проявляется в заметном укорачивании связи C–Cl от 0,176 до 0,169 нм вследствие дополнительного взаимодействия и в очень сильном уменьшении реакционной способности. Атомы галогена при двойной связи практически не реакционноспособны. Напротив, у атома галогена в аллильном положении реакционная способность резко увеличивается. Это объясняется тем, что способность таких соединений к диссоциации заметно повышена

Образующийся аллильный карбкатион стабилизируется вследствие смещения π-электронной плотности на положительно заряженный атом углерода. Поэтому образование такого карбкатиона энергетически значительно более выгодно, чем алкилкатиона. Все реакции замещения аллильного галогена идут по механизму SN1 и их скорость на несколько порядков выше, чем для алкилгалогенидов. По той же причине, что и в хлористом виниле, атом галогена в бензольном ядре мало реакционноспособен, однако бензильный атом галогена, как и в бромистом аллиле, очень легко вступает в реакции нуклеофильного замещения.
|
|
Реакция гидролиза
При действии свежеприготовленной гидроокиси серебра или воды в присутствии щелочей галогеналкилы дают спирты

Для первичных и вторичных алкилгалогенидов механизм этих реакций SN2

Отрицательно заряженная гидроксильная группа атакует положительно заряженный атом углерода со стороны, противоположной отрицательно заряженному атому брома. При наличии достаточной энергии гидроксил приближается настолько, что между ним и атомом углерода начинает образовываться связь, а связь между атомами углерода и брома начинает разрываться. В этом переходном состоянии атом углерода и все три атома водорода находятся в одной плоскости (молекула «уплощена»). Затем анион брома выталкивается и образуется молекула метилового спирта. Такой процесс называется реакцией нуклеофильного замещения второго порядка (SN2): нуклеофильного потому, что атакующая частица заряжена отрицательно; второго порядка - потому что скорость реакции зависит от концентрации как бромистого метила, так и гидроксила.
У третичных алкилгалогенидов подход отрицательно заряженной частицы затруднен имеющимися объемными заместителями, и процесс идет по другому механизму:
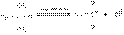
Хотя и в очень малой степени, но все же происходит процесс диссоциации третичного бромистого бутила. Образующийся третичный бутилкатион мгновенно реагирует с находящимися в растворе нуклеофильными частицами:

В этом случае скорость реакции зависит только от процесса диссоциации и, следовательно, от концентрации в реакционной смеси третичного бромистого бутила и реакция в целом называется реакцией нуклеофильного замещения первого порядка SN1.
Реакции замещения
К реакциям замещения, протекающим по нуклеофильному механизму, относятся реакции замещения галогена на CN-группу, аминогруппу, нитрогруппу, водород и т. д.


Реакция β-элиминирования (отщепления).
При действии на алкилгалогениды спиртовыми растворами щелочей образуются алкены
Получение магнийорганических соединений.
|
|
|

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!