Основные газовые законы. Определение молекулярных масс газообразных веществ.
К основному газовому закону относится уравнение состояния газа (уравнение Менделеева-Клапейрона): 
Газ, который подчиняется этому закону, называется идеальным.
Закон Авогадро.
В равных объемах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул.
В одном моле содержится  При нормальных условиях моль газа занимает 22,4 л.
При нормальных условиях моль газа занимает 22,4 л.
Универсальный газовый закон.

При изобарном процессе 

При изохорном процессе 

При изотермическом процессе 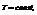
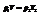
Единица молекулярной массы - 1/12 часть массы молекулы углерода, условно принятой равной 12.
Масса газообразных веществ определяется по закону Авогадро и уравнению Менделеева-Клапейрона.
Основные стехиометрические законы.
1. Закон постоянства состава: в-во имеет постоянный состав независимо от способа его получения.
Пример. 2H2+O2=2H2O и 4NH3+3O2=6H2O+2N.
2. Закон эквивалентов: в-ва вступают в химическое взаимодействие и замещают друг друга в соединениях в весовых количествах ропорциональным химическим эквивалентам этих веществ.
Химический эквивалент - такое весовое кол-во в-ва, которое реагирует с 1.008 весовых частей H2 или 8 в.ч. О2.
3. Закон простых кратных отношений: если два элемента образуют несколько соединений, то на одно и тоже весовое кол-во одного элемента приходится такие весовые кол-ва другого элемента, которые относятся между собой, как простые целые числа.
Пример. H20/H2O2, CO/CO2, N2O/NO/N2O3/NO2/N2O4/N2O5.
4. Закон сохранения массы и энергии: в изолированной системе сумма масс и энергий постоянна.
5. Закон Авогадро: в равных объемах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул.
В одном моле содержится 
Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
Эквивалент – реальная или условная частица вещества, которая может замещать, присоединять или быть каким-либо другим способом эквивалентна одному иону водорода в ионнообменных реакциях или одному электрону в ОВР.
Пример. 
Эквивалентная масса элемента - это масса 1 эквивалента элемента.
Эквивалентная масса вещества - это масса 1 эквивалента вещества.
Другими словами, эквивалентная масса кислоты равна ее молярной массе, деленной на основность кислоты.
Пример. 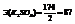
Закон химических эквивалентов. Моль эквивалентов одного вещества реагирует с одним молем эквивалентов другого вещества.
Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону,
Образование химической связи. Энергия связи и длина связи.
При взаимодействии атомов между ними может возникнуть химическая связь, приводящая к образованию молекулы/иона/кристалла. Чем прочнее связь, тем больше требуется затратить энергии на ее разрыв.
При возникновении связи энергия выделяется, следовательно уменьшается потенциальная энергия системы электронов и ядер.
Молекулы типа AA, BB, АВ.
Характерен для водорода, галогенов и соединений «галоген+водород». Молекулы имеют линейчатую структуру. Химическая связь действует по кратчайшему расстоянию (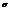 - сигма-связь).
- сигма-связь).
2. Молекулы типа 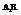
Характерен для соединений, образованных элементами главной подгруппы 6-ой группы: Н2О, Н2S.
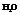 - валентный угол
- валентный угол 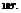
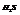 - валентный угол
- валентный угол 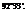
3. Молекулы типа 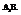
Характерен для соединений, образованных элементами главной подгруппы 5-й группы (N, P, As, Sb, Bi).
Молекула аммиака (NH3) имеет форму пирамиду с треугольным основании.
4. Молекулы типа 
Главная подгруппа 4-й группы (Si,C,Ge,Sn, Pb)
Молекула метана имеет форму тетраэдра (по вершинам – атомы водорода, атом углерода – в центре).
5. Молекулы типа 
Главная подгруппа 3-ей группы (B,Al,Ga,In,Tl).
Молекула 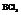 имеет вид равностороннего треугольника.
имеет вид равностороннего треугольника.
6. Молекулы типа 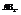
Характерен для некоторых соединений, образованными элементами главной подгруппы 2 группы.
ВеCl2 (линейная структура, угол – 180).
Если в молекуле имеется кратная связь между атомами (двойная или тройная), то только одна связь является прочной - пи-связь. Остальные – сигма-связи.
Пример. Рассмотрим молекулу этилена (С2Н4).
Имеет место неполная гибридизация 

Между атомами углерода одна из связей «пи». Все остальне – «сигма».
Ионная связь.
В случае возникновения ионной связи между атомами или группами атомов преобладает электростатическое взаимодействие. Она возникает между атомами элементов, значительно отличающихся по величине электроотрицательности.
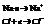
Элементы, входящие в состав ионного соединения, всегда существуют в виде ионов, а не нейтральных атомов. Также нужно отметить, что полного разделения зарядов нет и имеет место частичная ковалентность.
Валентность в ионных соединениях определяется по числу зарядов слагающих их ионов.
Ионы проводят электр. ток в растворах и расплавах и являются проводниками второго рода.
Теплоемкость.
Истинная т-ь – отношение бесконечно малого количества теплоты к тому изменению температуры, которое этим количеством вызывается: 
Для любого вещества справедливо: 

(теплоемкость при постоянном объеме/давлении).
Средняя т-ть – теплоемкость для интервала температур.
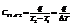
Первый закон.
Теплота, подведенная к системе, расходуется на приращение внутренней энергии системы и на работу системы над окружающей средой.

Второй закон.
Несколько формулировок, выберем эту: в изолированных системах самопроивзольно идут процессы, которые сопровождаются возрастанием энтропии: 
Энтропия – термодинамическая функция, характеризующая меру неупорядоченности состояния системы. Она используется для суждения о направлении самопроизвольно протекающих процессах.
Обобщенный закон.
Для каждой изолированной термодинамической системы существует состояние термодинамического равновесия, которого она при фиксированных внешних условиях с течением времени самопроизвольно достигает.
Энергия Гельмгольца.
Максимальная работа, которую может совершить система при рановесном проведении процесса, равна изменению энергии Гельмгольца реакции 

Энергия Гельмгольца равна 
 называют связанной энергией.
называют связанной энергией.
Она характеризует предел самопроизвольного течения реакции, которое возможно при 
Энергия Гиббса.
Энтальпийный и энтропийный факторы, характеризующие процессы, объединены функцией - энергия Гиббса.
 Поскольку энергию Гиббса можно превратить в работу, то ее называют свободной энергией.
Поскольку энергию Гиббса можно превратить в работу, то ее называют свободной энергией. 
Химическая реакция возможна, если энергия Гиббса уменьшается (<0).
Энергия Гиббса образования вещества – изменение энергии Гиббса системы при образовании 1 моль вещества В из простых веществ, устойчивых при 298 К.
Принцип Ле-Шателье.
При неизменных условиях химическое равновесие в системе может сохраняться сколь угодно долго. В случае же изменения условий (концентрация, температура, давление) одна из противоположно направленных реакций может ускориться, чем другая. После этого равновесие сместится, и установится новое состояние равновесия.
Принцип Ле-Шателье: если на систему, находящуюся в истинном химическом равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении той реакции, протекание которой ослабляет эффект произведенного воздействия.
Влияние температуры.
Повышение температуры смещает равновесие в сторону процесса, идущего с поглощением тепла.

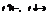
Влияние концентрации.
При увеличении концентрации исходных веществ равновесие смещается в сторону реакции, потребляющей эти вещества (вправо).

Влияние давления.
Увеличение давления смещает равновесие в сторону меньшего числа молей, т.е. в сторону падения давления.
Примечание. На реакцию, идущую без изменения числа молей, давление не влияет.


Закон действующих масс.
Справедлив для гомогенных реакций.
Формулировка: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Константа скорости обозначается как 
Пример. 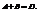
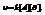
в квадратных скобках концентрации веществ.



«к» не зависит от концентрации в каждый момент времени.
Закон распределения.
Если при постоянной температуре некоторое вещество распределяется между двумя соприкасающимися фазами, то отношение концентрации этого вещества в соприкасающихся фазах есть величина постоянная – коэффициент растворения L.
Величина L не зависит от количества вводимого третьего вещества, а определяется природой фаз 1,2 и природой третьего вещества.
 Можно сказать, что закон Генри – частный случай закона распределения.
Можно сказать, что закон Генри – частный случай закона распределения.
Закон распределения применяется в технике (экстракция стали из шлака), при глубокой очистке полупроводниковых материалов (метод плавки по закону распределения).
Первый закон диффузии.
Масса веществ  переносимого путем диффузии в направлении х через перпендикулярную этому направлению площадку, пропорциональна коэффициенту диффузии D, площади S, времени
переносимого путем диффузии в направлении х через перпендикулярную этому направлению площадку, пропорциональна коэффициенту диффузии D, площади S, времени  и градиенту концентрации
и градиенту концентрации 

Скорость диффузии 

Знак «-» указывает, что процесс диффузии направлен в сторону понижения концентрации.
 Е – энергия активации.
Е – энергия активации.
Второй закон диффузии выражает зависимость изменения концентрации в объеме одной из соприкасающихся фаз от времени: 
___________________________________________
Стационарная диффузия.
При СД концентрация меняется только с расстоянием (х), от времени – нет. 
=> 
 а – градиент концентрации.
а – градиент концентрации.
Эффективный путь диффузии.
при




 толщина диффузионного слоя.
толщина диффузионного слоя.
Законы Рауля.
Особенность растворов: давление пара растворителя над раствором ниже, чем над чистым растворителем.
Первый закон.
Давление пара растворителя над раствором пропорционально мольной доле растворителя в растворе.
Или
Относительно понижение давление пара растворителя над раствором равно мольной доли растворенного вещества.
Введем обозначения:
 давление пара растворителя над чистым растворителем;
давление пара растворителя над чистым растворителем;
 давление пара растворителя над раствором;
давление пара растворителя над раствором;
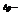 абсолютное понижение давления;
абсолютное понижение давления;
 относительное понижение давления.
относительное понижение давления.
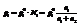

Если система полностью подчиняется закону, на графике наблюдаются прямолинейные зависимости. Однако в реальных системах наблюдаются отклонения.
Примечание автора. Обязательна графическая иллюстрация.

Температура замерзания раствора ниже температуры замерзания чистого растворителя, а температура кипения – выше.
Второй закон.
Повышение температуры кипения раствора и понижение температуры его замерзания пропорциональны моляльной концентрации раствора.

 К – константа, характеризующая растворитель.
К – константа, характеризующая растворитель.
 не зависит от природы вещества, а определяется природой растворителя и моляльностью, т.е. числом растворенных молекул в определенном количестве растворителя.
не зависит от природы вещества, а определяется природой растворителя и моляльностью, т.е. числом растворенных молекул в определенном количестве растворителя.
С помощью законов Рауля можно определять неизвестные молекулярные массы растворенных веществ.
Закон разведения Оствальда.
С разбавлением раствора степень диссоциации его увеличивается.
Выражает зависимость между 

Также можно установить связь и между 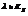

Сильные электролиты: почти все соли, большинство кислот и гидроксиды металлов.
Электролиты средней силы: 
Слабые электролиты: почти все органические кислоты, вода.
Пример.

______________________________________

Влияние температуры.
Согласно уравнению Гиббса-Гельмгольца, работа реакции. При наличии исходных термохимических данных можно рассчитать ЭДС. 2)Зависимость от температуры: 
Сделаем подстановки: 



Qp – теплота реакции, которая выделяется или поглощается при ее необратимом проведении. Если реакция протекает обратимо, то часть энергии реакции превращается в работу А, а часть q остается в виде теплоты в элементе, q характеризует связанную энергию.
Определив градиент ЭДС, можно вычислить изменение энтропии для реакции.
Если q<0,  т.е. ЭДС уменьшается с ростом температуры.
т.е. ЭДС уменьшается с ростом температуры.
Если q>0,  т.е. ЭДС растет с ростом температуры.
т.е. ЭДС растет с ростом температуры.
Для гальванических элементов q подбирают малом, чтобы 
Влияние концентрации.
Пусть реакция 
Изотерма реакции: 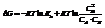
Преобразуем и получим: 
Обозначим первое слагаемое за 
Это стандартная ЭДС, она отвечает случаю равенства единице концентраций всех участвующих веществ, т.е. стандартному изменению свободной энергии реакции 
Электроды 1-го рода.
Металлы, погруженные в растворы своих солей.
солей: 
Электроды 2-го рода.
Металл погружен в насыщенный раствор своей малорастворимой соли, к которой добавлена другая соль с тем же анионом,но хорошо растворимая.
Пример. 
Процессы на электроде: 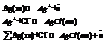
Концентрационная цепь.
Примечание автора. Обязательна графическая иллюстрация.

В сосуд помещены 2 одинаковых электрода и залиты раствором, содержащим ионы металла.
При замыкании цепи получают развитие процессы, приводящие к выравниванию концентрации всех растворов.
ЭДС элемента: 
Альмагамные цепи.
Альмагама – сплав металла со ртутью, остающийся жидким при комнатной температуре.
Примечание автора. Обязательна графическая иллюстрация.

В сосуд залиты альмагамы с различной концентрацией металла и электролит, содержащий ионы металла.
При работе элемента: окисление в первом отделе, восстновление – во втором.
Электрокоррозия.
Идет процесс электролиза под действием тока от внешнего источника.
Рассмотрим пример.

Коррозия стального трубопровода в почве под действием электрических токов. Возникают 2 участка: 1. где рельс (источник тока) играет роль катода (-), а участок провода под ним – роль анода (+).
2. справа от стыка. рельс – анод, провод – катод.
Слева от стыка разрушается трубопровод, справа – рельс.
Разрушение происходит локально – на ограниченном участке.
Кристаллические структуры.
Наименьшая структурная единица – элементарная ячейка. В зависимости от решеток и углов между характеристическими осями различают 7 основных видов (кубическая, ромбоэдрическая и пр.).
Тип кристаллической системы определяется природой и размерами частиц, видом химических связей между ними, температурой и другими факторами.
Многие соединения могут существовать в двух и более кристаллических структурах. Это явление – полиморфизм.
Все кристаллы можно разделить по видам химической связи. Стоит отметить, что существуют кристаллы со смешанными связями.
Молекулярная связь.
В узлах кристаллических решеток находятся молекулы, между которыми дейтсвуют вандерваальсовы силы, имеющие невысокую энергию.
Для кристаллов с молекулярными связями характерны низкие температуры плавления и высокая сжимаемость.
Ковалентная связь.
В узлах кристаллов располагаются атомы, образующие прочные ковалентные связи.
Это обуславливает высокую энергию решетки.
Кристаллы с ковалентной связью - диэлектрики или полупроводники. Типичными примеры: алмаз и кремний.
Ионная связь.
Структурные единицы – положительно и отрицательно заряженные ионы, между которыми происходит электростатическое взаимодействие, характеризуемое высокой энергией.
Кристаллы с ионной связью при низких температурах являются диэлектриками. При температурах близких к температуре плавления они становятся проводниками электричества.
Металлическая связь.
Специфические свойства металлов (высокая проводимость, теплопроводность, ковкость, пластичность, металлический блеск) можно объяснить особым типом связи – металлическая.
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно движутся валентные электроны, отщепившиеся от атомов при образовании ионов. Эти электроны удерживают вместе положительные ионы, в противном случае решётка распалась бы под действием сил отталкивания между ионами.
Смешанная связь.
Тот или иной вид связи встречается редко, обычно – наложение двух или более связей.

Принцип непрерывности.
При непрерывном изменении температуры, давления, концентрации свойства отдельных фаз системы меняются также непрерывно. Свойства системы в целом изменяются непрерывно лишь до тех пор, пока не изменится число или характер ее фаз. При появлении новых или исчезновении имеющихся фаз свойства системы в целом меняются скачком.
Принцип соответствия.
Каждой совокупности фаз, находящихся в равновесии в данной системе, отвечает на диаграмме определенный геометрический образ.В двухкомпонентной системе одной фазе на диаграмме соответствует участок плоскости, кристаллизации твердой фазы- кривая начала кристаллизации, равновесию между тремя фазами - точка пересечения кривых, и т.д.
59. Эвтектическая диаграмма плавкости (без образования твердых растворов).
Диаграмма состояния системы - диаграмма, указывающая, в каких фазовых состояниях находится система в зависимости от условий: температура, давление и состав.
Диаграммы плавкости – частный вид диаграмм состояния.
Для систем, дающих диаграмму плавкости такого типа, характерна полная взаимная растворимость компонентов в жидком состоянии и нерастворимость – в твердом.
Пример. Системы Pb-Ag, Cd-Bi, Tl-Au, KCl-LiCl и т.д.
Чтобы построить диаграмму плавкости системы А-В, необходимо приготовить несколько сплавов – от 100% А, через каждые  - до 100%В.
- до 100%В.
Далее снимаются кривые охлаждения и характерные точки переносятся на диаграмму плавкости бинарной системы А-В. Температуры плавления чистых компонентов -tА и tВ.
Примечание автора. Обязательна графическая иллюстрация. 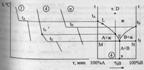
Температура начала первичной кристаллизации сплава 4 – t4, окончание – tE. Подобным же образом переносят характерные точки для всех сплавов и соединяют их на диаграмме плавными линиями, получая в итоге диаграмму плавкости системы A-B.
Ломанная линия tАЕtВ - “линия ликвидуса ”, выше нее возможно существование лишь жидкой фазы.
Линия MEN – “линия солидуса ”, ниже нее – лишь твердая фаза.
Между солидусом и ликвидусом область сосуществования двух фаз – твердой и жидкой.
Примечание автора. Обязательна графическая иллюстрация.
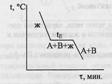
Точка Е – точка эвтектики, сплав эвтектического состава кристаллизуется подобно чистому компоненту, давая кривую охлаждения с площадкой: для сплавов, имеющих состав 100%А до т. х (состава эвтектики) – так называемых доэвтектических – под микроскопом после затвердевания наблюдаются сравнительно крупные кристаллы компонента А, выпадающие первоначально, и смесь мелких кристалликов А и В, выпадающая при достижении жидкой фазы эвтектического состава – в конце кристаллизации.
В сплавах после точки х - заэвтектического состава – наблюдаются крупные кристаллы В и эвтектическая смесь кристалликов А и В. Правило фаз в данном случае записывается как С=К-Ф+1, посколько при снятии диаграмм плавкости P=const. Число степеней свободы: в точке D – C=2-1+1=2, в точке L – C=2-2+1=1, в точке Е – С=2-3+1=0.
Механизм адсорбции.
Адсорбция связана с особым энергетическим состоянием частиц на поверхности адсорбента в отличие от энергетического состояния частиц, находящихся в объеме.
Молекулы жидкости верхнего (первого) слоя обладают избытком энергии по сравнению с молекулами нижнего (второго) слоя.
Силы, действующие на первый слой, стремятся втянуть молекулы внутрь слоя и сократить величину поверхности раздела.
Нескомпенсированность сил у молекул верхнего слоя выражается как некий избыток энергии поверхностного слоя.
Поверхностное натяжение – избыток свободной энергии в поверхностном слое, отнесенный к  поверхности поглощающего тела.
поверхности поглощающего тела. 
Поверхностное натяжение представляет собой максимальную полезную работу, затрачиваемую на образование единицы поверхностим  т.е. фактически удельный потенциал поверхности.
т.е. фактически удельный потенциал поверхности.
За счет этой избыточной энергии и происходит притяжение поверхностью молекул газов и растворенных веществ.
Принцип Гиббса-Кюри.
Та форма кристалла, которая отвечает наименьшему значению поверхностной энергии всех граней обладает наибольшей устойчивостью. 
Дальтониды и бертоллиды.
Диаграмма состояния системы - диаграмма, указывающая, в каких фазовых состояниях находится система в зависимости от условий: температура, давление и состав.
Диаграммы плавкости – частный вид диаграмм состояния.
Дальтонид – устойчивое соединение, дающее эвтектики с компонентами А и В, отвечающее постоянному составу.

На рисунке гомогенности фазы простираются в обе стороны от вертикали  Соединение
Соединение  - соединение, на котором основана фаза.
- соединение, на котором основана фаза.
Если состав соединения, на котором основывается фаза переменного состава, лежит в пределах ее гомогенности, то фаза – дальтонидная фаза переменного состава. Если лежит вне пределов области гомогенности фазы – бертоллидная фаза переменного состава.
Возможен и такой случай, когда для фазы невозможно установить состав соединения.
Термин «бертоллид» был введен Курнаковым. Бертоллидные фазы образуются совсем немногими элементами.

Основные газовые законы. Определение молекулярных масс газообразных веществ.
К основному газовому закону относится уравнение состояния газа (уравнение Менделеева-Клапейрона): 
Газ, который подчиняется этому закону, называется идеальным.
Закон Авогадро.
В равных объемах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул.
В одном моле содержится  При нормальных условиях моль газа занимает 22,4 л.
При нормальных условиях моль газа занимает 22,4 л.




 При нормальных условиях моль газа занимает 22,4 л.
При нормальных условиях моль газа занимает 22,4 л.





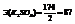
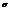 - сигма-связь).
- сигма-связь).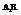
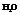 - валентный угол
- валентный угол 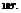
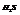 - валентный угол
- валентный угол 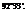
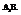


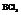 имеет вид равностороннего треугольника.
имеет вид равностороннего треугольника.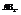
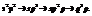

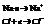



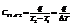




 называют связанной энергией.
называют связанной энергией.
 Поскольку энергию Гиббса можно превратить в работу, то ее называют свободной энергией.
Поскольку энергию Гиббса можно превратить в работу, то ее называют свободной энергией. 

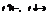



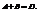
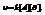



 Можно сказать, что закон Генри – частный случай закона распределения.
Можно сказать, что закон Генри – частный случай закона распределения. переносимого путем диффузии в направлении х через перпендикулярную этому направлению площадку, пропорциональна коэффициенту диффузии D, площади S, времени
переносимого путем диффузии в направлении х через перпендикулярную этому направлению площадку, пропорциональна коэффициенту диффузии D, площади S, времени  и градиенту концентрации
и градиенту концентрации 



 Е – энергия активации.
Е – энергия активации.


 а – градиент концентрации.
а – градиент концентрации.



 толщина диффузионного слоя.
толщина диффузионного слоя. давление пара растворителя над чистым растворителем;
давление пара растворителя над чистым растворителем; давление пара растворителя над раствором;
давление пара растворителя над раствором;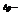 абсолютное понижение давления;
абсолютное понижение давления; относительное понижение давления.
относительное понижение давления.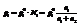



 К – константа, характеризующая растворитель.
К – константа, характеризующая растворитель. не зависит от природы вещества, а определяется природой растворителя и моляльностью, т.е. числом растворенных молекул в определенном количестве растворителя.
не зависит от природы вещества, а определяется природой растворителя и моляльностью, т.е. числом растворенных молекул в определенном количестве растворителя.

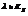









 т.е. ЭДС уменьшается с ростом температуры.
т.е. ЭДС уменьшается с ростом температуры. т.е. ЭДС растет с ростом температуры.
т.е. ЭДС растет с ростом температуры.

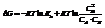





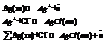





 - до 100%В.
- до 100%В.

 поверхности поглощающего тела.
поверхности поглощающего тела. 


 Соединение
Соединение 


