Спирты (алкоголи) — это производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп — ОН у насыщенных атомов углерода.
Общая формула спиртов: R(OH)m, m>1, где R — УВ радикал; m — число функциональных гидроксильных групп—ОН, которое определяет атомность спирта.
Классификация спиртов по строению УВ радикала:
1. Предельные
2. Ароматические
3. Непредельные: алкенолы и алкинолы.
Классификация спиртов по атомности:
1. Одноатомные
2. Многоатомные: двуатомные (этиленгликоль) и трехатомные (Глицерин)
Изомерия и номенклатура
Первые два члена гомологического ряда — СН3ОН и С2Н5ОН — не имеют изомеров, относящихся к классу спиртов. Для остальных алканолов возможны 2 типа изомерии (в пределах своего класса):
1. изомерия цепи (углеродного скелета);
2. изомерия положения функциональной группы
Спирты изомерны другому классу соединений — простым эфирам (R-O-R').
Электронное строение

Атомы углерода в алканолах находятся в состоянии sp3-гибридизации. Молекулы алканолов представляют собой диполи. Они содержат полярные связи С—Н, С—О, О—Н. Дипольные моменты связей С →О и О ← Н направлены в сторону атома кислорода, поэтому атом «О» имеет частичный отрицательный заряд δ-, а атомы «С» и «Н» — частичные положительные заряды δ+. Полярность связи О—Н больше полярности связи С—О вследствие большей разности электроотрицательностей кислорода и водорода. Однако полярность и этой связи недостаточна для диссоциации ее с образованием ионов Н+. Поэтому спирты являются неэлектролитами.
Физические свойства
Полярность связи О—Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов.
Температуры кипения спиртов больше температуры кипения соответствующих алканов с тем же числом атомов углерода. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей.
• Водородная связь — это особый вид связи, которая осуществляется при участии атома водорода гидроксильной или аминогруппы одной молекулы и атомами с большой электроотрицательностью (О, N, F, C1) другой молекулы. Чем большим положительным зарядом обладает атом водорода и чем больше способность другого атома отдавать свои неподеленные электронные пары, тем легче образуется водородная связь (ВС) и тем она прочнее.
Прочность ВС значительно меньше прочности ковалентной связи (КС): энергия (Е) образования ВС обычно не превышает 5—7 ккал/моль, средняя Е образования КС колеблется в пределах 80—110 ккал/моль.
Гомологическом ряду спиртов нет газообразных веществ.
Все алканолы легче воды, бесцветны, жидкие имеют резкий запах, твердые запаха не имеют. Метанол, этанол и пропанол неограниченно растворяются в воде, с увеличением числа углеродных атомов растворимость алканолов в воде уменьшается, высшие спирты не растворяются в воде.
Химические свойства
Химические свойства алканолов определяются особенностями их электронного строения: наличием в их молекулах полярных связей О—Н, С—О, С—Н. Для алканолов характерны реакции, которые идут с расщеплением этих связей: реакции замещения, отщепления, окисления.
I. Реакции замещения
1. Замещение атома водорода гидроксильной группы вследствие разрыва связи О—Н.
а) Взаимодействие с активными металлами с образованием алкоголятов (алканолятов) металлов: 2С2Н5ОН + 2Na → 2C2H5ONa + Н2О
Эти реакции протекают только в безводной среде; в присутствии воды алкоголяты полностью гидролизуются: C2H5ONa + Н2О → С2Н5ОН + NaOH
б) Взаимодействие с органическими и неорганическими кислотами с образованием сложных эфиров (реакции этерификации): C2H5OH + HO-O-C-CH3 → CH3O-O-C2H5 + H2O
Замещение гидроксильной группы вследствие разрыва связи С—О.
а) Взаимодействие с галогеноводородами с образованием галогеналканов: С2Н5ОН + НВг → C2H5Br + H2O
б) Взаимодействие с аммиаком с образованием аминов. Реакции идут при пропускании смеси паров спирта с аммиаком при 300°С над оксидом алюминия: С2Н5ОН + HNH2 → C2H5-NH2 + Н2О;
II. Реакции отщепления
1. Дегидратация, т. е. отщепление воды
Дегидратация спиртов может быть двух типов: межмолекулярная и внутримолекулярная.
а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R—О—R'. Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов:
С2Н5ОН+НОС2Н5 → H2SO4 (конц.), 140°С → С2Н5-О-С2Н5+Н2О
б) Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта: CH3-CH2OH → H2SO4 (конц.), 170° → H2C=CH2 + H2O
2. Дегидрирование (разрыв связей О—Н и С—Н) а) При дегидрировании первичных спиртов образуются альдегиды: CH3-CH2OH →Cu, t→  + H2
+ H2
б) При дегидрировании вторичных спиртов образуются кетоны
 →Cu, t→
→Cu, t→ 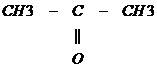 + H2
+ H2
в) Третичные спирты не дегидрируются.
III. Реакции окисления
1. Горение (полное окисление)
Спирты горят на воздухе с выделением большого количества тепла (на этом основано использование спиртовок):
С2Н5ОН + ЗО2 → 2СО2 + ЗН2О; Н = -1374 кДж
2. Неполное окисление под действием окислителей: кислорода воздуха в присутствии катализаторов (например, Си), перманганата калия, дихромата калия и др.
Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования:
2C2H5OH + O2 → Cu, t → 2  + 2H2O
+ 2H2O
Таким образом, реакции дегидрирования спиртов по своей химической сущности являются реакциями окисления.
Способы получения алканолов
1. Гидратация алкенов, т. е. присоединение воды к алкенам H2C=CH2 + H2O →H3PO4, 3000C→ CH3-CH2OH
При гидратации гомологов этилена в соответствии с правилом Марковникова образуются вторичные или третичные спирты: CH3-CH=CH2 + H2O → H2SO4, t → CH3-CHOH-CH3
2. Гидролиз галогеналканов
При действии водного раствора NaOH атом галогена в галогеналкане замещается группой —ОН:
C2H5Cl + NaOH → t → C2H5OH + NaCl
3. Гидрирование альдегидов и кетонов. В присутствии катализаторов (Ni, Pt, Pd, Co) альдегиды восстанавливаются до первичных спиртов, а кетоны — до вторичных спиртов.
4. Специфические способы получения метанола и этанола
СО + 2Н2 → Р t, кат → СН3ОН
Этанол образуется при брожении (ферментации) углеводов — глюкозы или крахмала:
С6Н12О6 → Ферменты → 2С2Н5ОН + 2СО2
МНОГОАТОМНЫЕ СПИРТЫ
Свойства многоатомных спиртов рассмотрим на примере простейшего трехатомного спирта — глицерина, или про-пантриола-1,2,3.
Химические свойства
I. Замещение атомов водорода гидроксильных групп
1. Как и одноатомные спирты, многоатомные спирты взаимодействуют со щелочными металлами; при этом могут образовываться моно-, ди- и тризамещенные продукты:
Физические свойства
Глицерин — вязкая, бесцветная, сладковатая на вкус нетоксичная жидкость с /°кип = 290°С. Смешивается с водой во всех отношениях.
Химические свойства
I. Замещение атомов водорода гидроксильных групп
1. Как и одноатомные спирты, многоатомные спирты взаимодействуют со щелочными металлами; при этом могут образовываться моно-, ди- и тризамещенные продукты:
CH2OH-CH2OH-CH2OH + Na ® CH2OH-CH2OH-CH2ONa + H2 и т.д.
2. Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов (например, с гидроксидом меди (II) Си(ОН)2). Продуктами этих реакций являются внутрикомплексные («хелатные») соединения, в молекулах которых атом тяжелого металла образует как обычные ковалентные связи Me—О за счет замещения атомов водорода ОН-групп, так и донорно-акцепторные связи Me ← О за счет неподеленных электронных пар атомов кислорода других ОН-групп:
CH2OH-CH2OH-CH2OH + Cu(OH)2 + CH2OH-CH2OH-CH2OH → CH2OH-CH2OH-CH2O-Cu- OCH2-CH2OH-CH2OH + 2H2O
Нерастворимый в воде Си(ОН)2 голубого цвета растворяется в глицерине с образованием ярко-синего раствора глицерата меди (II). Эта реакция является качественной реакцией на все многоатомные спирты.
3. Многоатомные спирты, как и одноатомные, взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров:
CH2OH-CH2OH-CH2OH + 3 CH3-COOH →
CH2OCOCH3-CH2OCOCH3-CH2OCOCH3 триацетат глицерина
CH2OH-CH2OH-CH2OH + 3 HNO3 → H2SO4 конц →
CH2ONO2-CH2ONO2-CH2ONO2 тринитрат глицерина
Сложные эфиры глицерина и высших карбоновых кислот представляют собой жиры (см. тему «Сложные эфиры. Жиры»).
Тринитроглицерин — взрывчатое вещество и одновременно лекарственный препарат: 1%-й спиртовой раствор нитроглицерина применяется в медицине в качестве средства, расширяющего сосуды сердца.




 + H2
+ H2  →Cu, t→
→Cu, t→ 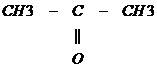 + H2
+ H2


