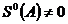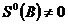Химическая стехиометрия. Эквивалент вещества. Эквивалентная масса и эквивалентный объем. Закон эквивалентов.
Стехиометрия — термин, введенный Рихтером (1793) для обозначения учения о весовых и объемных, отношениях, в которых разнородные вещества соединяются химически. Первое основание этому учению положил немецкий химик Венцель. Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях.
Эквивалентная масса элемента - это масса 1 эквивалента элемента; эквивалентом элемента называют такое его количество, которое реагирует с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. При образовании соединений элементы взаимодействуют друг с другом в количествах, пропорциональных их эквивалентным массам или величинам, кратным этим массам. Для численного выражения эквивалентных масс необходим эталон; в качестве такого эталона приняты атомная масса водорода или ее эквивалент, например атомная масса хлора (Cl-), 1/2 атомной массы кислорода (O2-) или 1/3 атомной массы алюминия (Al3+). Таким образом, эквивалентная масса элемента равна его атомной массе, деленной на его валентность или степень окисления.
Эквивалентный объем - это объем, который занимает при данных условиях 1 эквивалент рассматриваемого вещества. При нормальных условиях эквивалентный объем водорода равен 11,2 л/моль.
Закон эквивалентов формулируется так: эквивалентные количества всех веществ, участвующих в реакции, одинаковы. Для необратимой химической реакции
nАА + nВВ+ …= nСС + nDD + …
в соответствии с законом эквивалентов всегда будет справедливо равенство:
пeqA = пeqB = …=пeqC = пeqD = …
т.е. эквивалентные количества вступивших в реакцию реагентов и образовавшихся продуктов одинаковы.
2. Расчет эквивалентов и эквивалентных масс различных классов неорганических соединений. Закон эквивалентов формулируется так: эквивалентные количества всех веществ, участвующих в реакции, одинаковы. Для необратимой химической реакции
nАА + nВВ+ …= nСС + nDD + …
в соответствии с законом эквивалентов всегда будет справедливо равенство:
пeqA = пeqB = …=пeqC = пeqD = …
т.е. эквивалентные количества вступивших в реакцию реагентов и образовавшихся продуктов одинаковы. Поэтому если эквивалентное количество одного из веществ (реагента или продукта) известно по условию задачи, то определены и эквивалентные количества всех остальных веществ, участвующих в данной реакции, а необходимость их расчета отпадает. В этом состоит преимущество проведения стехиометрических расчетов по закону эквивалентов.
Определять эквивалент вещества, в общем-то, нужно для КОНКРЕТНОЙ реакции.
Например, эквивалент одного и того же основания Э(ОН)n может быть и 1/n, и 1, и 1/n-m...
Существуют формулы для расчёта эквивалентных масс представителей различных классов веществ (это для кислотно-основных и ионообменных реакций)
Но ведь, если в кислоте замещаются не все атомы водорода, т.е. образуются кислые соли, то тогда её эквивалент будет равен делению молярной массы ТОЛЬКО на то количество атомов водорода, которые заместились на металл... Также и с основаниями в реакциях образования основных солей. Поэтому и отмечено: что всё нужно считать для конкретной реакции.
А в окислительно-восстановительных - это обязательно нужно знать во что в результате реакции превращается окислитель или восстановитель и сколько при этом затрачивается электронов на восстановление или окисление соответственно. Эквивалент тогда будет равен 1/число электронов.
Ну а фактор эквивалентности - это всего лишь число, на которое нужно умножить молярную массу вещества для получения его эквивалентной массы.
Наберите в любом поисковике "Расчёт эквивалентных масс" или "Эквивалент вещества", или любую иную вариацию. Очень много статей будет на эту тему.
Энергии Гиббса
В открытых системах изменение внутренней энергии происходит не только в результате получения или отдачи теплоты и совершения работы, но и за счёт изменения масс, входящих в систему компонентов. Все свойства открытых систем и ΔG будут зависеть от количества каждого компонента:
где – химический потенциал, энергия Гиббса отнесённая к 1-му молю вещества, – изменённое количество вещества системы
Если в системе – компонентов, то:
– самопроизвольное протекание процессов в открытой системе
– состояние равновесия
– процессы не протекают
Энтропия, определяемая в стандартных условиях ( ,
,  ) называется стандартной
) называется стандартной  .
.
 – для простых веществ.
– для простых веществ.
Изменение энтропии  в ходе химической реакции определяется как
в ходе химической реакции определяется как 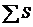 продуктов
продуктов
реакции за вычетом 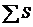 исходных реагентов с учётом стехиометрических коэффициентов:
исходных реагентов с учётом стехиометрических коэффициентов: 
 .
.
Изменение энтропии  в ходе реакции образования соединений из простых веществ называют энтропией образования
в ходе реакции образования соединений из простых веществ называют энтропией образования  .
.
 ,,,
,,,  ,
, 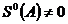

Ионное произведение воды
Вода также диссоциирует, хотя и в небольшой степени:
H2O " H+ + ОН-
Константа диссоциации для этого процесса равна:
К = ([H+]*[OH-])/[H2O]
Концентрация недиссоциированных молекул воды равна общему числу моль в 1 л воды, т. е. [H2O] = 1000/18 = 55,56 моль и [H+]*[ОН-] = 10-14. Произведение концентрации ионов H+ и ОН- при определенной температуре постоянно. При температуре 25°С его называют ионным произведением воды
Концентрации ионов H+ и OH- равны, следовательно [H+] = [OH-] = 10-7 моль/л. Раствор с одинаковыми концентрациями ионов называется нейтральным. Если [H+] > [OH-] то раствор кислый, наоборот - [H+] < [ОН-] - щелочной или основный.
Водоро́дный показа́тель, pH — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:рН = - lg[H+]
Гидроксильный показатель рОН равен отрицательному десятичному логарифму концентрации ионов гидроксила:
рОН = - lg[OH-]
Для нейтральной среды рН = 7, для кислой рН < 7 и для щелочной рН > 7
Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
Методы защиты от каррозии.
Методы защиты от карозии:1)рациональное конструирование металлических изделий.;2)легирование металлов-введение в состав мет. примесей уменьшающих его коррозионную октивность.;3)нанесение защитных покрытий(защитные покрытия: неорганические, органические);4)Электрохимическая защита. Данная защита основана на торможении коррозионного процеса.;5)Изменение коррозионных свойств среды. Способ направлен на снижение концентрации веществ способствующих коррозии. Механизм защиты металлопокрытия определяется значением его электродного потенциала. Возм2 варианта: 1)покрытия потенциал которых меньше чем у основного мет. называются анодными. При нарушении их целостности происходит разрушение металлопокрытия. 2) покрытия потенциал которых > чем у основного мет.называется катодным. При нарушении его целостности происходит разрушение основного метала.
Электролиз
Электролиз – совокупность ОВР процессов протекает на электродах при пропускании постоянного эл. тока через раствор или расплав электролита.
38.
При плавлении солей происходит их диссоциация на ионы. Ионы в зависимости от знака под воздействием эл. тока перемещаются к катоду или аноду где происходит их окисление или восстановление.
Если проводят электролиз водных растворов то в электродных процессах участвуют не только катионы и анионы электролита, конкуренцию им создают молекулы растворителя. Особенность протекания электрохимических процессов заключается в том что молекулы воды подвергаются как окислению так и восстановлению и потенциалы для этих двух процессов различны. Окисление:2Н2О-4е=О2+4Н; Е=+1,23В Востановление:2Н2О+2е=Н2+2ОН;Е=-0,83В
39.
Законы Фарадея
Законы Фарадея: 1- масса вещества образующаяся при электролизе пропорциональна силе тока и времени электролиза, то есть кол-ву электричества прошедшему через электролит.
2- при одинаковом количестве электричества массы прореагировавших веществ относятся друг к другу как эквивалентные массы этих веществ.
Химическая стехиометрия. Эквивалент вещества. Эквивалентная масса и эквивалентный объем. Закон эквивалентов.
Стехиометрия — термин, введенный Рихтером (1793) для обозначения учения о весовых и объемных, отношениях, в которых разнородные вещества соединяются химически. Первое основание этому учению положил немецкий химик Венцель. Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях.
Эквивалентная масса элемента - это масса 1 эквивалента элемента; эквивалентом элемента называют такое его количество, которое реагирует с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. При образовании соединений элементы взаимодействуют друг с другом в количествах, пропорциональных их эквивалентным массам или величинам, кратным этим массам. Для численного выражения эквивалентных масс необходим эталон; в качестве такого эталона приняты атомная масса водорода или ее эквивалент, например атомная масса хлора (Cl-), 1/2 атомной массы кислорода (O2-) или 1/3 атомной массы алюминия (Al3+). Таким образом, эквивалентная масса элемента равна его атомной массе, деленной на его валентность или степень окисления.
Эквивалентный объем - это объем, который занимает при данных условиях 1 эквивалент рассматриваемого вещества. При нормальных условиях эквивалентный объем водорода равен 11,2 л/моль.
Закон эквивалентов формулируется так: эквивалентные количества всех веществ, участвующих в реакции, одинаковы. Для необратимой химической реакции
nАА + nВВ+ …= nСС + nDD + …
в соответствии с законом эквивалентов всегда будет справедливо равенство:
пeqA = пeqB = …=пeqC = пeqD = …
т.е. эквивалентные количества вступивших в реакцию реагентов и образовавшихся продуктов одинаковы.
2. Расчет эквивалентов и эквивалентных масс различных классов неорганических соединений. Закон эквивалентов формулируется так: эквивалентные количества всех веществ, участвующих в реакции, одинаковы. Для необратимой химической реакции
nАА + nВВ+ …= nСС + nDD + …
в соответствии с законом эквивалентов всегда будет справедливо равенство:
пeqA = пeqB = …=пeqC = пeqD = …
т.е. эквивалентные количества вступивших в реакцию реагентов и образовавшихся продуктов одинаковы. Поэтому если эквивалентное количество одного из веществ (реагента или продукта) известно по условию задачи, то определены и эквивалентные количества всех остальных веществ, участвующих в данной реакции, а необходимость их расчета отпадает. В этом состоит преимущество проведения стехиометрических расчетов по закону эквивалентов.
Определять эквивалент вещества, в общем-то, нужно для КОНКРЕТНОЙ реакции.
Например, эквивалент одного и того же основания Э(ОН)n может быть и 1/n, и 1, и 1/n-m...
Существуют формулы для расчёта эквивалентных масс представителей различных классов веществ (это для кислотно-основных и ионообменных реакций)
Но ведь, если в кислоте замещаются не все атомы водорода, т.е. образуются кислые соли, то тогда её эквивалент будет равен делению молярной массы ТОЛЬКО на то количество атомов водорода, которые заместились на металл... Также и с основаниями в реакциях образования основных солей. Поэтому и отмечено: что всё нужно считать для конкретной реакции.
А в окислительно-восстановительных - это обязательно нужно знать во что в результате реакции превращается окислитель или восстановитель и сколько при этом затрачивается электронов на восстановление или окисление соответственно. Эквивалент тогда будет равен 1/число электронов.
Ну а фактор эквивалентности - это всего лишь число, на которое нужно умножить молярную массу вещества для получения его эквивалентной массы.
Наберите в любом поисковике "Расчёт эквивалентных масс" или "Эквивалент вещества", или любую иную вариацию. Очень много статей будет на эту тему.



 ,
,  ) называется стандартной
) называется стандартной  .
. – для простых веществ.
– для простых веществ. в ходе химической реакции определяется как
в ходе химической реакции определяется как 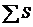 продуктов
продуктов
 .
. .
. ,,,
,,,  ,
,