Общая характеристика: – классификация, номенклатура, изомерия.
Альдегидами и кетонами называются соединения, содержащие в молекуле оксо– или карбонильную группу:

Отсюда другое их название – карбонильные соединения. В молекуле альдегидов атом углерода карбонильной группы связан с углеводородным радикалом и атомом водорода:
В молекуле кетонов атом углерода карбонильной группы связан с двумя углеводородными радикалами:
Классификация
В зависимости от характера углеводородных радикалов, входящих в молекулу альдегидов и кетонов различают: предельные, непредельные, ароматические и др. Кетоны могут быть смешанного типа: радикалы с которыми связана кетогруппа, могут принадлежать к разным классам. По количеству карбонильных групп различают монокарбонильные, дикарбонильные и поликарбонильные соединения.
| Альдегиды
| Кетоны
|

| 
|

| 
|

| 
|

| Кетоны смешанного типа

|
Номенклатура. Изомерия.
Альдегиды часто называют по наименованию кислот, в которые они превращаются после окисления (уксусный альдегид). По рациональной (радикально-функциональной) при наименовании кетонов называют углеводородные радикалы и добавляют слово кетон (диметилкетон). По ИЮПАК в основе наименования альдегидов и кетонов лежит название углеводорода с тем же числом углеродных атомов, включая углеродный атом карбонильной группы. Для альдегидов добавляют окончание «-аль» (бутаналь), для кетонов – «-он» (пентанон). Нумерацию углеродной цепи начинают с того конца, к которому ближе расположен карбонильный углерод.
Изомерия альдегидов и кетонов определяется строением углеводородных радикалов.
Физические свойства альдегидов и кетонов
Первый член гомологического ряда – предельных альдегидов – формальдегид, представляет собой при обычной температуре газ. Раствор формальдегида в воде (37-40%) называют формалином. Низшие альдегиды и кетоны (уксусный альдегид и ацетон) смешивается с водой во всех соотношениях, бензальдегид растворим в воде лишь около 3%. Формальдегид имеет острый, удушающий запах, бензальдегид имеет запах горького миндаля. Температура кипения низших членов ряда альдегидов и кетонов выше, чем у соответствующих углеводородов и ниже чем у соответствующих спиртов. Плотности у альдегидов и кетонов ниже единицы.
Высокомолекулярные альдегиды (С10 и С11) обладают приятным запахом, применяются в парфюмерии. Альдегиды и некоторые кетоны участвуют в формировании вкуса и аромата хлеба и вина и др. продуктов.
Способы получения
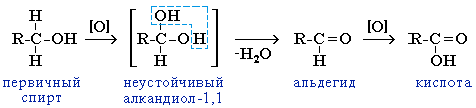
1.Окисление спиртов
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
2.Гидратация алкинов (реакция Кучерова)
Присоединение воды к ацетилену в присутствии солей ртути (II) приводит к образованию ацетальдегида:

3. Окисление алкенов (катализаторы - хлориды Pd и Cu)

Химические свойства
Реакции присоединения
Восстановление.
НСНО + НН → СН3ОН
Присоединение синильной кислоты..
R—CHO + HCN → R-CH(OH)-CN
Присоединение гидросульфита натрия.
R—CHO + NaHSO3 → R-CH(OH)-SO3Na
2 Окисление. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты.
Реакция «серебряного зеркала».
СН3СНО + Ag2O--NH4OH,t--> CH3COOH + 2Ag↓
Реакция полимеризации
nHCHO → [CH2O]n
26.Аминокислоты. Общая характеристика: строение, классификация и номенклатура. Физические и химические свойства. Методы получения и идентификации. Биологически значимые аминокислоты.
Аминокисло́ты (аминокарбо́новые кисло́ты) — органические соединения, в молекуле которых одновременно содержатсякарбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водородазаменены на аминные группы.
Физические свойства
Аминокислоты — бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом.
Общие химические свойства
Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы — COOH, так и основныесвойства, обусловленные аминогруппой — NH 2. Аминокислоты взаимодействуют с кислотами и щелочами:
NH 2 — CH 2 — COOH + HCl → HCl • NH 2 — CH 2 — COOH (хлороводородная соль глицина)
NH 2 — CH 2 — COOH + NaOH → H 2 O + NH 2 — CH 2 — COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, т.е. находятся в состоянии внутренних солей.
NH 2 — CH 2 COOH  N + H 3 — CH 2 COO -
N + H 3 — CH 2 COO -
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
NH 2 — CH 2 — COOH + CH 3 OH → H 2 O + NH 2 — CH 2 — COOCH 3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
HOOC — CH 2 — NH — H + HOOC — CH 2 — NH 2 → HOOC — CH 2 — NH — CO — CH 2 — NH 2 + H 2 O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Получение
CH 3 COOH + Cl 2 +(катализатор) → CH 2 ClCOOH + HCl; CH 2 ClCOOH + 2NH 3 → NH 2 — CH 2 COOH + NH 4 Cl
27.Белки. Общая характеристика: строение и свойства белков. Классификация белков. Функции белков.
Белки́ (протеи́ны, полипепти́ды [1]) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс.
Функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров — полисахаридов и ДНК. Так, белки-ферменты катализируют протекание биохимических реакций и играют важную роль в обмене веществ. Некоторые белки выполняют структурную или механическую функцию, образуя цитоскелет, поддерживающий форму клеток. Также белки играют важную роль в сигнальных системах клеток, при иммунном ответе и в клеточном цикле.
Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы), поскольку в их организмах не могут синтезироваться все необходимые аминокислоты и часть из них поступает с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются прибиосинтезе белков организма или подвергаются дальнейшему распаду для получения энергии.
Значение изоэлектрической точки является характерной константой белков. Белки с pI меньше 7 называются кислотными, а белки с pI больше 7 — основными. В целом, pI белка зависит от выполняемой им функции: изоэлектрическая точка большинства белков тканей позвоночных лежит в пределах от 5,5 до 7,0, однако в некоторых случаях значения лежат в экстремальных областях: так, например, для пепсина — протеолитического фермента сильнокислого желудочного сока pI ~ 1[9], а для сальмина — белка-протамина молок лосося, особенностью которого является чрезвычайно высокое содержание аргинина, pI ~ 12. Белки, связывающиеся с нуклеиновыми кислотами за счёт электростатического взаимодействия с фосфатными остатками нуклеиновых кислот, часто являются основными белками. Примером таких белков служат гистоны и протамины.
Белки различаются по степени растворимости в воде, но большинство белков в ней растворяются. К нерастворимым относятся, например, кератин (белок, из которого состоят волосы, шерсть млекопитающих, перья птиц и т. п.) и фиброин, который входит в состав шёлка и паутины. Белки также делятся на гидрофильные и гидрофобные. К гидрофильным относятся большинство белков цитоплазмы, ядра и межклеточного вещества, в том числе нерастворимые кератин и фиброин. К гидрофобным относятся большинство белков, входящих в составбиологических мембран интегральных мембранных белков, которые взаимодействуют с гидрофобными липидами мембраны[10] (у этих белков обычно есть и небольшие гидрофильные участки).
Функции белков
1. Ферментативная (каталитическая). В биологических системах почти все реакции катализируются специфическими белками – ферментами. В настоящее время открыто около 300 различных ферментов, каждый из которых служит катализатором определенной биологической реакции. Синтез и распад веществ, их регуляция, перенос химических групп и электронов от одного вещества к другому осуществляется с помощью ферментов.
2. Строительная, структурная функция. Белки образуют основу протоплазмы любой живой клетки, в комплексе с липидами они являются основным структурным материалом всех клеточных мембран всех органелл.
3. Двигательная функция. Любые формы движения в живой природе (работа мышц, движение ресничек и жгутиков у простейших, движение протоплазмы в клетке и т.д.) осуществляется белковыми структурами.
4. Транспортная функция. Перенос различных молекул, ионов осуществляется специфическими белками. Например, белок крови гемоглобин переносит кислород к тканям. Перенос жирных кислот по организму происходит с участием другого белка крови-альбумина.
5. Регуляторная функция. Регуляция углеводного, белкового, липидного обменов осуществляется с помощью гормонов, которые по своему строению относятся к белкам (инсулин) или пептидам (окситоцин, вазопрессин и др.).
6. Защитная – эту функцию выполняют иммуноглобулины (антитела). Они обладают способностью обезвреживать бактерии, вирусы, чужеродные белки, попавшие в организм извне. Процесс свертывания крови, защищающий организм от ее потери, основан на превращениях белка – фибриногена. Кератин – белок волосяного защитного покрова.
Классификация белков
Белки в зависимости от химического строения делят на простые и сложные. Простые белки при гидролизе распадаются только на аминокислоты. При гидролизе сложных белков наряду с аминокислотами образуется вещество небелковой природы – простетическая группа. Классификация простых белков основана на их растворимости.
Альбумины – водорастворимые белки с высокой гидрофильностью, выпадают в осадок при 100%-ом насыщении сульфатом аммония. К этим белкам относятся белок куриного яйца, белки зародыша семян злаковых и бобовых культур. Альбумин пшеницы называют лейкозин, гороха – легумелин. Альбумины содержат все незаменимые аминокислоты.
Глобулины – растворяются в солевых растворах, чаще всего для извлечения глобулинов используют 2 –10%-ый раствор хлорида натрия. Они осаждаются 50%-ым раствором сульфата аммония. Белки семян бобовых и масличных культур в основном представлены глобулинами; легумин – гороха и чечевицы, фазеолин – фасоли; глицин – соевых бобов. Многие альбумины и глобулины обладают ферментативным действием.
Проламины. Эта группа белков характерна исключительно для семян злаков. Эти белки растворяются в 60-80%-ом растворе этилового спирта. Эти белки содержат значительные количества пролина и глютаминовой кислот. Лизина они не содержат или содержат его в следовых количествах. Хорошо изучены проламины пшеницы – глиадины, ячменя – гордеин, кукурузы – зеин. Проламины – это комплексы белков различающиеся по составу и молекулярной массе.
Глютелины находятся, как правило, с проламинами. Растворяются они в щелочах (чаще 0,2%-ым NaOH). Глютелины не однородные белки, а смеси разных белков со сходными свойствами. Наиболее исследованы глютелин пшеницы, орезенин риса.
Глютенин и глиадин пшеницы образуют комплекс, который называют клейковиной. Клейковина муки влияет на структурно-механические свойства теста, а, следовательно на качество хлеба.
Протамины – самые низкомолекулярные белки. Встречаются эти белки в молоках рыб. На 2/3 эти белки состоят из аргинина, поэтому имеют основной характер. Протамины не содержат серы.
Гистоны – содержаться в хромосомах клеточных ядер, они участвуют в стабилизации пространственной структуры ДНК. Гистоны на 20-30% состоят из основных аминокислот. Из растворов их осаждают аммиаком.
28.Углеводы. Общая характеристика. Моносахариды. Строение, классификация, номенклатура. Оптическая изомерия. Физические и химические свойства.
Углеводы наряду с белками и липидами являются важнейшими химическими соединениями, входящими в состав живых организмов. У человека и животных углеводы выполняют важные функции: энергетическую, структурную и защитную.
При окислении углеводов выделяется значительное количество энергии, которая накапливается в виде АТФ.
Углеводы (рибоза и дезоксирибоза) используются для синтеза нуклеиновых кислот, они являются составными компонентами нуклеиновых коферментов, играющих исключительно важную роль в метаболизме у живых существ.
Промежуточные продукты распада углеводов служат исходными веществами для синтеза других соединений, необходимых живой клетке.
С нарушением обмена углеводов тесно связан ряд заболеваний: сахарный диабет, галактоземия и т.д.
На долю углеводов приходится 60-70% пищевого рациона. Они содержатся преимущественно в растительных продуктах, являются основными компонентами хлеба, круп, макарон, кондитерских изделий, служат сырьем в бродильной промышленности, в производстве пищевых кислот: уксусной, молочной, лимонной.
Классификация углеводов основана на структуре и физико-химических свойствах.
Углеводы подразделяются на три основные группы: моносахариды, олигосахариды и полисахариды.
 Моносахариды (простые сахара) – углеводы, которые не способны гидролизоваться до более простых соединений.
Моносахариды (простые сахара) – углеводы, которые не способны гидролизоваться до более простых соединений.
Олигосахариды (низкомолекулярные сахара) – углеводы, которые при гидролизе распадаются на 2-8 моносахарида («олигос» – по-гречески немногий).
Полисахариды (сложные сахара) – продукты конденсации моносахаридов, они способны гидролизоваться с образованием простых углеводов (от десятков до сотен тысяч молекул моносахаридов).
Моносахариды (монозы) классифицируют по количеству атомов углерода и по характеру карбонильной группы.
По количеству атомов углерода различают: триозы – сахара с тремя атомами углерода, тетрозы – с четырьмя, пентозы – с пятью, гексозы – с шестью и т.д. Сахара, содержащие семь и более атомов углерода, называют высшими сахарами.
Моносахариды, содержащие альдегидную группу, называют альдозами, кетонную – кетозами. Часто эти названия объединяют, чтобы одновременно показать и число углеродных атомов, и характер карбонильной группы. Например: глюкоза является альдогексозой, а фруктоза – кетогексозой, простейшей альдотриозой является глицериновый альдегид, а простейшей кетотриозой – дигидроксиацетон:
Пространственная изомерия

| | 
|
| Слева D-глицеральдегид, справа L-глицеральдегид.
|
Изомерия (от др.-греч. ἴσος — равный, и μέρος — доля, часть) — существование химических соединений (изомеров), одинаковых по составу и молекулярной массе, различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Стереоизомерия моносахаридов: изомер глицеральдегида у которого при проецировании модели на плоскость ОН-группа у асимметричного атома углерода расположена с правой стороны принято считать D-глицеральдегидом, а зеркальное отражение — L-глицеральдегидом. Все изомеры моносахаридов делятся на D- и L- формы по сходству расположения ОН-группы у последнего асимметричного атома углерода возле СН2ОН-группы (кетозы содержат на один асимметричный атом углерода меньше, чем альдозы с тем же числом атомов углерода). Природные гексозы — глюкоза, фруктоза, манноза и галактоза — по стереохимической конфигурациям относят к соединениям D-ряда[5].
Номенклатура
Наличие в молекуле асимметрических атомов, углерода делает моносахариды оптически активными соединениями, причем величина удельного вращения является хараткеристическим параметром моносахарида.
Номенклатура моносахаридов основывается на соединениях с неразветвленной цепью атомов углерода. Углеродные атомы нумеруют таким образом, чтобы карбонильный углерод имел наименьший номер. Заместители (атомы функциональные группы) получают тот же номер, что и углеродный атом, с которым они соединены. Если в молекуле имеется более одной функциональной группы, они перечисляются в алфавитном порядке. Отсутствие ОН-группы отражается префиксом «дезокси».
























 N + H 3 — CH 2 COO -
N + H 3 — CH 2 COO - Моносахариды (простые сахара) – углеводы, которые не способны гидролизоваться до более простых соединений.
Моносахариды (простые сахара) – углеводы, которые не способны гидролизоваться до более простых соединений.




