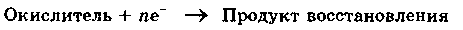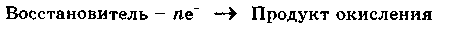Все химические реакции можно разделить на два типа.
– к первому типу относятся реакции, которые идут без изменения степени окисления атомов реагирующих веществ
-ко второму типу относятся реакции, которые идут с изменением степени окисления атомов реагирующих веществ.
Реакции, при которых изменяются степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окислительно-восстановительная реакция — это единый процесс, состоящий из двух разных полуреакций: полуреакции окисления и полуреакции восстановления, которые идут одновременно.
Окисление - это процесс потери электронов атомом, молекулой или ионом.
Восстановление — это процесс присоединения электронов атомом, молекулой или ионом.
Окислителем называется вещество, атомы, молекулы или ионы которого присоединяют электроны:
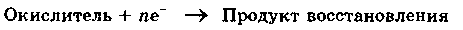
Окислитель восстанавливается в процессе восстановления.
Восстановителем называется вещество, атомы, молекулы или ионы которого отдают электроны:
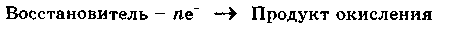
при окислении степень окисления (окислительное число) атома изменяется в положительную сторону, а при восстановлении — в отрицательную.
Cтепень окисления – это условный заряд атома в соединении, вычисленный исходя из предположения, что данный атом связан с другими ионной связью.
Типы окислительно-востановительных реакций. Типичные окислители и восстановители. Составление уравнений окислительно-восстановительных реакций (метод электронного баланса, метод полуреакций).
Типы ОВР
Различают четыре типа окислительно-восстановительных реакций: межмолекулярные, внутримолекулярные, реакции диспропорционирования и конпропорционирования.
1. Межмолекулярные ОВР - это реакции, которые идут с изменением степени окисления атомов в молекулах разных веществ:
2. Внутримолекулярные ОВР - это реакции, которые идут с изменением степени окисления разных атомов в одной молекуле. При этом атом элемента с более высокой степенью окисления является окислителем и окисляет атом элемента с меньшей степенью окисления.
3.Реакции диспропорционирования (дисмутации) - это реакции, которые идут с изменением степени окисления одинаковых атомов в молекуле (или молекулах) одного и того же вещества
4.Реакции конпропорционирования (конмутации) — это реакции, обратные реакциям диспропорционирования. В результате этих реакций атомы одного элемента, находящиеся в разных степенях окисления, переходят к общей степени окисления, промежуточной между исходными степенями.
ТИПИЧНЫЕ ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ
В качестве окислителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в низшей из возможных для них степеней окисления, а поэтому могут понижать свою степень окисления.
В качестве типичных окислителей могут выступать:
1) простые вещества, образуемые атомами с большой электроотрицательностью, т. е. типичные неметаллы, расположенные, прежде всего, в главных подгруппах шестой и седьмой групп периодической системы;
2) вещества, содержащие элементы в высших и промежуточных положительных степенях окисления, в том числе в виде ионов, как простых, элементарных (Fе3+), так и кислородсодержащих, оксоанионов (перманганат-ион);
3) перекисные соединения (пероксиды, супероксиды и т. д.);
4) Кислородсодержащие анионы, содержащие атом неметалла в высшей положительной степени окисления (SO4 (степень окисления серы +6), NO3 (степень окисления азота +5)
Конкретными веществами, применяемыми на практике в качестве окислителей, являются, например, кислород и озон, хлор, бром, пероксид водорода и пероксиды металлов, хроматы, дихроматы и перманганаты, кислородные кислоты хлора и их соли, азотная кислота, концентрированная серная кислота, диоксид марганца.
В качестве восстановителей могут выступать простые или сложные вещества, содержащие атомы, которые находятся не в высшей из возможных для них степени окисления, а потому могут повышать свою степень окисления.
В качестве типичных восстановителей могут выступать:
1) простые вещества, атомы которых имеют низкую электроотрицательность («активные» металлы);
2) катионы металлов в низших степенях окисления (Fе2+);
3) простые, элементарные анионы, например сульфид-ион;
4) кислородсодержащие анионы (оксоанионы), соответствующие низшим положительным степеням окисления элемента (нитрит, сульфит);
5) катод электролизной ячейки.
Вещества, применяемыми на практике в качестве восстановителей, являются, щелочные и щелочноземельные металлы, сульфиды, сульфиты, галогеноводороды (кроме НF), соли двухвалентного железа, органические вещества - формальдегид, глюкоза, щавелевая кислота, а также водород, углерод, монооксид углерода и алюминий при высоких температурах.