Основные типы органических реакций. Гомолитические и гетеролитические реакции. Нуклеофильные и электрофильные реакции.
Органические реакции, так же как и неорганические, делят на три основных типа:
1. Реакция замещения: СН4 + Cl2 → CН3Cl + НCl
2. Реакция отщепления (расщепления): СН3СН2Br → СН2=СН2 + НBr
3. Реакция присоединения: СН2=СН2 + НBr → CН3СН2Br.
Так же органические реакции классифицируют и по механизму разрыва ковалентных связей в реагирующих молекулах:
1. Если общая электронная пара при разрыве связи делится между атомами, то образуются радикалы – частицы, имеющие неспаренные электроны. Такой разрыв связи называется радикальным (гомолитическим). Образовавшиеся радикалы легко взаимодействуют с имеющимися в системе молекулами или радикалами.
По радикальному механизму обычно протекают реакции, в которых разрыву подвергаются связи малой полярности (С-С, С-Н, N-N) при высокой температуре, под действием света или радиоактивного излучения.
2. Если при разрыве связи общая электронная пара остается у одного атома, то образуются ионы – катион (имеет положительный заряд, т.к. отдает свой электрон при разрыве), называемый электрофилом, т.к. легко присоединяется к молекулам, имеющим свободную электронную пару,ианион (заряжен отрицательно) - наоборот нуклеофил. Такой механизм разрыва называется ионным или гетеролитическим. Ионный механизм характерен для разрыва полярной ковалентной связи (углерода с галогеном, кислородом, азотом и т.п.).
Органические ионы, в отличие от неорганических, возникают только в момент реакции, и затем сразу же взаимодействуют с имеющимися в системе веществами. Поэтому говорят о реакциях, протекающих по электрофильному типу, когда на разрыв связей влияет катион, либо нуклеофильному, когда течение реакции определяет анион.
Соответственно для органических соединений выделяют девять типов реакций: SR - радикальное замещение, SE - электрофильное замещение, SN - нуклеофильное замещение, ER - радикальное отщепление, EE - электрофильное отщепление, EN - нуклеофильное отщепление, AR - радикальное замещение, AE - электрофильное замещение, AN - нуклеофильное замещение.
Электронное строение органических соединений. Гибридные орбитали. Образование и характеристика сигма и пи связей.
Свойства органических соединений определяются: химическим, электронным и пространственным строением молекул; типом химических связей; природой и электронным строением атомов; типом атомных орбиталей и характером их взаимодействия.
Электрон имеет двойственную природу, проявляя свойства, как частицы, так и волны. Движение электрона подчиняется законам квантовой механики.
Электронные облака (электронные орбитали)– это области наибольшей вероятности пребывания электрона. Различаются по форме, размерам, направленности в пространстве. Например, в атоме водорода единственный электрон при своем движении образует отрицательно заряженное облако сферической (шаровидной) формы. Такие электроны называются s-электроны. p-электроны образуют орбиталь в виде объемной восьмерки. s-, p-, d-, f- и др. орбитали различаются энергией, формой, размерами и пространственной направленностью.
Для органических веществ наиболее характерно нахождение валентных электронов на s- и p-атомных орбиталях.
Гибридизация – это взаимодействие разных по типу, но близких по энергии атомных орбиталей с образованием такого же числа гибридных орбиталей. Для атома углерода, образовавшиеся гибридные орбитали будут иметь одинаковую форму и энергию.
Гибридизация атома углерода сопровождается его возбуждением и переносом одного электрона с s на свободную p орбиталь, обеспечивая возможность образовывать четыре связи.
sp3-гибридизация образуется за счет одной s и трех p орбиталей. В результате оси гибридных орбиталей оказываются направлены к вершинам правильного тетраэдра, угол между ними составляет 109°28'. Такие орбитали могут образовывать четыре  -связи - ковалентные одинарные связи, образованные при максимальном перекрывании атомных орбиталей по одной оси. (метан CH4)
-связи - ковалентные одинарные связи, образованные при максимальном перекрывании атомных орбиталей по одной оси. (метан CH4)
sp2-гибридизация образуется за счет одной s и двух p орбиталей, образуя три гибридные орбитали расположенные в одной плоскости под углом 120°. Эти орбитали образуют три  -связи. Третья р -орбиталь остается негибридизованной и ориентируется перпендикулярно плоскости расположения гибридных орбиталей, участвуя в образовании
-связи. Третья р -орбиталь остается негибридизованной и ориентируется перпендикулярно плоскости расположения гибридных орбиталей, участвуя в образовании 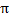 -связи - связи, образованные при боковом перекрывании негибридизированных p-орбиталей по обе стороны от оси соединяющей ядра атомов. (этилен C2H4)
-связи - связи, образованные при боковом перекрывании негибридизированных p-орбиталей по обе стороны от оси соединяющей ядра атомов. (этилен C2H4)
sp-гибридизация образуется за счет одной s и одной p орбиталей, образуя две гибридные орбитали расположенные на одной оси, т.е. под углом 180°. Эти орбитали образуют две  -связи. Две р-орбитали остаются негибридизованными и располагаясь во взаимно перпендикулярных плоскостях, участвуют в образовании двух
-связи. Две р-орбитали остаются негибридизованными и располагаясь во взаимно перпендикулярных плоскостях, участвуют в образовании двух 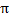 -связей. (ацетилен C2H2)
-связей. (ацетилен C2H2)
Основные понятия науки о полимерах. Основные отличия высокомолекулярных соединений от низкомолекулярных.
Полимерами (от греч. " поли " - много, " мерос " - часть) называют высокомолекулярные вещества, состоящие из больших молекул цепного строения. Например, полиэтилен, получаемый при полимеризации этилена (CH2=CH2):
...-CH2-CH2-CH2-CH2-CH2-CH2-... или (-CH2-CH2-)n
Молекула полимера называется макромолекулой (от греч. " макрос " - большой). Молекулярная масса макромолекул достигает десятков - сотен тысяч (и даже миллионов) атомных единиц.
Низкомолекулярные соединения, из которых образуются полимеры, называются мономерами. Например, указанный выше этилен или α-аминокислоты, служащие мономерами при синтезе природных полимеров – белков. Группа атомов, многократно повторяющаяся в цепи макромолекулы, называется ее структурным звеном, оно определяется мономером (или мономерами), из которых и состоит полимер.
Степенью полимеризации называют число, показывающее сколько молекул мономера соединилось в макромолекулу.
Важную роль, как и вообще в органической химии, имеет геометрическая форма макромолекулы, ее пространственная структура в целом. Для макромолекул характерны три основные разновидности геометрических форм.
Линейная форма (полиэтилен низкого давления, невулканизованный натуральный каучук), разветвленная форма (полиэтилен высокого давления) и пространственная (трехмерная или сетчатая) форма (вулканизованный каучук).
Геометрическая форма макромолекул в значительной степени влияет на свойства полимеров. Например, линейные и разветвленные полимеры термопластичны, растворимы. Линейные полимеры имеют наибольшую плотность, т.к. их макромолекулы способны к ориентации вдоль одной оси. Полимеры пространственного строения, не плавятся, не растворяются, а только набухают в растворителях.
Наибольшие отличия полимеров от низкомолекулярных соединений, проявляются в механических свойствах, в поведении растворов и в некоторых химических свойствах.
Особые механические свойства. Эластичность - способность к высоким обратимым деформациям при относительно небольшой нагрузке (каучуки). Малая хрупкость стеклообразных и кристаллических полимеров (пластмассы, органическое стекло). Способность макромолекул к ориентации под действием направленного механического поля (волокна и пленки).
Особенности растворов полимеров. Высокая вязкость раствора при малой концентрации полимера. Растворение полимера происходит через стадию набухания.
Особые химические свойства. Способность резко изменять свои физико-механические свойства под действием малых количеств реагента (вулканизация каучука, дубление кож).
Особые свойства полимеров объясняются не только большой молекулярной массой, но и тем, что макромолекулы имеют цепное строение и обладают гибкостью.
Поликонденсация.
Пoликонденсация – процесс образования высокомолекулярных соединений, протекающий по механизму замещения и сопровождающийся выделением побочных низкомолекулярных продуктов. Элементные составы исходных мономеров и полимера отличаются, при этом, на группу атомов, выделившихся в виде низкомолекулярного продукта. Большинство биополимеров в природе образуется именно реакцией поликонденсации (белки, ДНК, РНК, целлюлоза, хитин и др.).
Например, получение капрона из аминокапроновой кислоты:
nH2N-(CH2)5-COOH → H-[-NH-(CH2)5-CO-]n-OH + (n-1)H2O
В реакцию поликонденсации могут вступать соединения, содержащие не менее двух функциональных групп, способных к химическому взаимодействию.
Например, соединение с двумя разнородными функциональными группами, т.е. одинаковые молекулы будут реагировать друг с другом за счет наличия в одной молекулы различных функциональных групп - гомополиконденсация: аминокислоты H2N-R-COOH дают полиамиды, гидроксикислоты HO-R-COOH - полиэфиры.
H2N-R-COOH → H-(-NH-R-CO-)n-OH + (n-1)H2O
Или два соединения, содержащие по две одинаковые функциональные группы, способные взаимодействовать с группами другой молекулы - гетерополиконденсация: двухатомные спирты и двухосновные кислоты HO-R-OH + HOOC-R`-COOH дают полиэфиры, диамины и двухосновные кислоты - H2N-R-NH2 + HOOC-R`-COOH - полиамиды.
H2N-R-NH2 + HOOC-R`-COOH → H-(-NH-R-NH-CO-R-CO-)n-OH + (n-1)H2O
Поликонденсация ступенчатый процесс, при котором мономеры, взаимодействуя друг с другом, исчерпываются сравнительно быстро, и высокомолекулярные полимеры образуется обычно в результате реакций ранее образовавшихся олигомеров.
Углеводороды
1. Алканы, предельные углеводороды, парафины CnH2n+2 – CH4 мет ан, C2H6 эт ан, C3H8 проп ан, C4H10 бут ан, C5H12 пент ан и т.д. Радикалы, образованные при отрыве одного атома водорода в название имеют замену окончания с –ан на –ил: CH3– мет ил, C2H5– эт ил, C3H7– проп ил, C4H9– бут ил, C5H11– пент ил и т.д. Радикалы, образованные при отрыве двух атомов водорода в название имеют замену окончания с на –илиден (при отрыве от одного углерода) или –илен (при отрыве от соседних атомов углерода). Радикал CH2=, однако, имеет название метилен.
2. Циклоалканы, циклические предельные углеводороды, CnH2n – C3H6 циклопроп ан, C4H8 циклобут ан, C5H10 циклопент ан.
3. Алкены, непредельные углеводороды с одной двойной связью, названия образованы заменой –ан на –ен (или по старой номенклатуре –илен), CnH2n – C2H4 эт ен (этилен), C3H6 проп ен (припилен), C4H8 бут ен, C5H10 пент ен и т.д. При этом указывается номер атома углерода при двойной связи. Особо можно выделить радикал этена – винил CH2=CH–.
4. Алкины, непредельные углеводороды с одной тройной связью, названия образованы заменой –ан на –ин, CnH2n-2 – C2H2 эт ин (ацетилен), C3H4 проп ин (припилен), C4H6 бут ин, C5H8 пент ин и т.д. При этом указывается номер атома углерода при тройной связи.
5. Алкадиены, углеводороды содержащие две двойные связью, названия образованы с окончанием –диен, CnH2n-2 – C3H4 проп адиен, C4H6 бут адиен -1,3, C5H8 пент адиен -1,3 и т.д. При этом указывается номера атомов углерода при двойных связях. Выделяют сопряженные диены, в которых двойные связи разделены одинарной (типичны 1,3-диены), кумулированные диены (аллены, 1,2-диены) и диены с изолированными двойными связями разделенными несколькими одинарными. Сопряженные диены отличаются наличием двух конформаций – цис- и транс-формы. Наиболее типичными являются бутадиен-1,3 (дивинил) и 2-метилбутадиен-1,3 (изопрен). К диенам относят и циклические 1,3-диены с обшей формулой CnH2n-4.
6. Арены, ароматические углеводороды, CnH2n-6 – бензол (C6H6) и его гомологи. C6H5CH3 – толуол (метилбензол), C6H4(CH3)2 – ксилол (диметилбензол), C6H5C2H5 – толуол.
Основные типы органических реакций. Гомолитические и гетеролитические реакции. Нуклеофильные и электрофильные реакции.
Органические реакции, так же как и неорганические, делят на три основных типа:
1. Реакция замещения: СН4 + Cl2 → CН3Cl + НCl
2. Реакция отщепления (расщепления): СН3СН2Br → СН2=СН2 + НBr
3. Реакция присоединения: СН2=СН2 + НBr → CН3СН2Br.
Так же органические реакции классифицируют и по механизму разрыва ковалентных связей в реагирующих молекулах:
1. Если общая электронная пара при разрыве связи делится между атомами, то образуются радикалы – частицы, имеющие неспаренные электроны. Такой разрыв связи называется радикальным (гомолитическим). Образовавшиеся радикалы легко взаимодействуют с имеющимися в системе молекулами или радикалами.
По радикальному механизму обычно протекают реакции, в которых разрыву подвергаются связи малой полярности (С-С, С-Н, N-N) при высокой температуре, под действием света или радиоактивного излучения.
2. Если при разрыве связи общая электронная пара остается у одного атома, то образуются ионы – катион (имеет положительный заряд, т.к. отдает свой электрон при разрыве), называемый электрофилом, т.к. легко присоединяется к молекулам, имеющим свободную электронную пару,ианион (заряжен отрицательно) - наоборот нуклеофил. Такой механизм разрыва называется ионным или гетеролитическим. Ионный механизм характерен для разрыва полярной ковалентной связи (углерода с галогеном, кислородом, азотом и т.п.).
Органические ионы, в отличие от неорганических, возникают только в момент реакции, и затем сразу же взаимодействуют с имеющимися в системе веществами. Поэтому говорят о реакциях, протекающих по электрофильному типу, когда на разрыв связей влияет катион, либо нуклеофильному, когда течение реакции определяет анион.
Соответственно для органических соединений выделяют девять типов реакций: SR - радикальное замещение, SE - электрофильное замещение, SN - нуклеофильное замещение, ER - радикальное отщепление, EE - электрофильное отщепление, EN - нуклеофильное отщепление, AR - радикальное замещение, AE - электрофильное замещение, AN - нуклеофильное замещение.



 -связи - ковалентные одинарные связи, образованные при максимальном перекрывании атомных орбиталей по одной оси. (метан CH4)
-связи - ковалентные одинарные связи, образованные при максимальном перекрывании атомных орбиталей по одной оси. (метан CH4)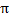 -связи - связи, образованные при боковом перекрывании негибридизированных p-орбиталей по обе стороны от оси соединяющей ядра атомов. (этилен C2H4)
-связи - связи, образованные при боковом перекрывании негибридизированных p-орбиталей по обе стороны от оси соединяющей ядра атомов. (этилен C2H4)


