Электролиты- в-ва,водн. растворы и расплавы кот. проводят электрич. ток.Их электропроводность зависит от концентрации.Исследуя р-ры электролитов,Аррениус показал,что электролиты в р-рах распадаются на ионы.
Электролитич. диссоциация-это распад электролита на ионы под действием м-л растворителя.
Опыт показыв.,что не все электролиты полностью диссоциируют на ионы,часть м-л остается недиссоциируемой.Между ионами и непродиссоциировавшими -лами в р-ре устанавливается динамич. равновесие.С колличественной стороны процесс диссоциации хар-ся степенью диссоциации а(альфа) и К(константой степени диссоциации).Альфа показывает отношение числа продиссоциировавших м-л к общ. числу растворенных м-л.
Основания. Название "основание" первоначально было отнесено к вещ-вам, кот.в реакциях с кис-тами образуют соли. К основаниям принадлежат гидроксиды многих металлов.
Прим: NaOH - гидроксид натрия, KOH - гидроксид калия, Ca(OH)2 - гидроксид кальция.
Основания, кот.хорошо растворяются в воде, назыв. щелочами. К ним относятся гидроксиды щелочных и щелочно-земельных металлов. С точки зрения ТЭД основания-это вещ-ва, диссоциирующие в водном р-ре с образованием анионов одного вида - гидроксид - ионов ОН-.
В общем виде уравнение электролитич. диссоциации основания имеет вид:
Основание -> Катион основания + Гидроксид-ион
NaOH  Na++ OH- Ba(OH)2 Na++ OH- Ba(OH)2  Ba2++ 2OH- NH3·H2O Ba2++ 2OH- NH3·H2O  NH4++ OH- NH4++ OH-
|
Кислоты. Кис-ты исторически получили своё название из-за кислого вкуса водн. р-ров таких вещ-в, как хлороводород или уксусная кислота. С точки зрения ТЭД кислоты-это вещ-ва, диссоц. в водн. р-ре с образованием катионов одного вида - катионов водорода Н+.
В общ.виде ур-ние электролитич. диссоциации кислоты имеет вид:
Кислота -> Катион водорода + Анион кислотного остатка
H2SO4  2H+ + SO42- CH3COOH 2H+ + SO42- CH3COOH  H+ = CH3COO- H+ = CH3COO-
|
Соли. С точки зрения ТЭД соли - это вещ-ва, кот.в водном р-ре диссоциируют с образованием катионов основания и анионов кислотного остатка.
В общ.виде ур-ние электролитич. диссоциации солей имеет следующий вид:
Соль -> Катион основания + Анион кислотного остатка
BaCl2  Ba2+ + 2Cl- K2CO3 Ba2+ + 2Cl- K2CO3  K+ + CO32-
18. Слабые электролиты
Слабые электролиты-со степенью диссоциации <3.К ним относятся слаб. кис-ты(H2CO3,HCN,HSCN,CH3COOH),слаб. основания и некоторые соли.Cлаб. электролиты диссоциируют незначительно, и между ионами и непродиссоциировавшими м-лами устанавливается динамич. равновесие.Можно применить ЗДМ и написать константу равновесия,кот назыв. константой диссоциации.Слаб. многоосновн. кис-ты диссоциируют ступенчато и каждая ступень характеризуетя своей Кд. K+ + CO32-
18. Слабые электролиты
Слабые электролиты-со степенью диссоциации <3.К ним относятся слаб. кис-ты(H2CO3,HCN,HSCN,CH3COOH),слаб. основания и некоторые соли.Cлаб. электролиты диссоциируют незначительно, и между ионами и непродиссоциировавшими м-лами устанавливается динамич. равновесие.Можно применить ЗДМ и написать константу равновесия,кот назыв. константой диссоциации.Слаб. многоосновн. кис-ты диссоциируют ступенчато и каждая ступень характеризуетя своей Кд.
 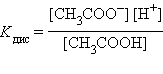 I ступень: H2SO4 ↔ H+ + HSO4¯
II ступень: HSO4¯ ↔ H+ + SO42–
Слабыеоснования:гидроксиды d-элементов,амфотерныегидроксиды,NH4OH,Mg(OH)2,CU(OH)2,Cr(OH)3.
Слабые электролиты диссоциируют ступенчато.Для каждой ступени своя Кд.
I ступень: H2SO4 ↔ H+ + HSO4¯
II ступень: HSO4¯ ↔ H+ + SO42–
Слабыеоснования:гидроксиды d-элементов,амфотерныегидроксиды,NH4OH,Mg(OH)2,CU(OH)2,Cr(OH)3.
Слабые электролиты диссоциируют ступенчато.Для каждой ступени своя Кд.
| I ступень: Mg(OH)2 ↔ MgOH+ + OH¯
II ступень: MgOH+ ↔ Mg2+ + OH¯
| Влияние одноименного иона на диссоциацию слабого электролита:
Одноименными называются ионы,кот входят в состав данного элемента

Если к р-ру слаб. эл-та уксусной кислоты прибавить ее соль ацетат натрия,то при этом вводится одноименный ион CH3COO
CH3COONACH3COO+Na
При введении одноименных ионов в -р слаб. эл-та его диссоциация уменьшается. |
Вопрос 20
Ионное произведение воды.
KВ=[Н⁺][ОН⁻]= 10⁻14 при 25ᵒС
Это произведение концентрации ионов водорода и гидроксильных групп. Величина постоянная const=10⁻14 при 25ᵒС
Т.к. КВ(константа воды)≠0, то в любом водном р-ре есть ионы [Н⁺]≠0, [ОН⁻]≠0.
В кислой среде: [H⁺]>[OH⁻], [H⁺]>10⁻⁷ моль-ионов/литр
В нейтральной среде: [H⁺]=[OH⁻] =√10⁻⁴=10⁻⁷ м-и/л
В щелочной среде: [H⁺]<[OH⁻] [H⁺]<10⁻⁷
Водородный показатель. pH= -lg[H⁺], [H⁺]=10⁻ ᵖᴴ. В.п – это отрицательный десятичный логарифм концентрации ионов водорода.
Гидроксильный показатель. pОH= -lg[ОH⁻] [ОH⁻]= 10⁻ᵖᴼᴴ.
Для сильных электролитов более правильно писать pH=-lgaᴴ⁺
Активность аᴴ⁺=fᴴ⁺•Cᴴ⁺
f – коэффициент активности, учитывает все силы взаимодействия между ионом в растворе.чем сильнее взаимодействие, тем меньше коэффициент активности f<1.
Вопрос №22г
Амфотерные оксиды – это оксиды, которым соответствуют амфотерные гидроксиды. Амфотерные оксиды – оксиды металлов в с. о. атомов +3, +4, а также BeO, ZnO, PbO, SnO и некоторые другие. Амфотерные оксиды могут проявлять и кислотные, и основные свойства в зависимости от веществ, с которыми они взаимодействуют. С кислотами и кислотными оксидами амфотерн. оксиды проявл.св-ва основн.оксидов, а с основаниями и основными оксидами – cв-ва кислотн.оксидов. Однако не у всех амфотерных оксидов кислотн. и основные св-ва выражены в одинаковой мере. Например, у оксида мышьяка(III) кислотные свойства преобладают над основными, а у оксида сурьмы(III) основные свойства преобладают над кислотными.

Амфотерные оксиды с водой не взаимодействуют, например:
 +
+  ≠
≠

Амфотерные оксиды при взаимодействии с кис-тами проявл. св-ва основн. оксидов, образуя соль и воду, например:
 +
+  =
=  +
+ 
При избытке многоосновной кис-ты образуется кислая соль, например:
 +
+ 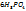 (изб.)=
(изб.)= 
При избытке оксида образуется основная соль, например:
ZnO (изб.) + HCl = ZnOHCl.
Двойные оксиды образуют две соли, например:
 Fe
Fe 

Например:


Амфотерн. оксиды при взаимодействии со щелочами проявл.св-ва кислотн. оксидов.
Состав продуктов реакции зависит от условий реакции. При сплавлении образуется средняя соль и вода, в р-ре – комплексная соль, например:
ZnO + 2NaOH (тв.) 
ZnO + 2NaOH + 
Оксид алюминия при взаимодействии со щелочью в зависимости от ее концентрации образует одну из двух комплексных солей – с четырьмя и шестью ОН-группами(Na  и N
и N  )
)
Оксиды  взаимодействуют со щелочами только при сплавлении. С нерастворимыми основаниями амфотерные оксиды не взаимодействуют.
взаимодействуют со щелочами только при сплавлении. С нерастворимыми основаниями амфотерные оксиды не взаимодействуют.

Например:

Гидратные формы амфотерных оксидов получают косвенно, например, из солей:
H2SiO3 → SiO2 + H2O
23 вопрос
Гидролиз солей.
Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц.
Сущность гидролиза сост. в ом,что в рез-те обменна ионов соли с мол-лами воды происх смещение равновесия электролитич.диссоциации воды,и в рез-те накаплив.избыток тонов Н или ОН.
Согласно ТЭД все соли,как правило,сильн.электролиты,т.е.в водн.р-ре полностью диссоц.на ионы. «Все ионы в р-ре окружены м-лами воды,кот.образуют гидратную оболочку»(по теории Каблукова). Со своей гидратной оболочкой ионы взаимодействуют по-разному: анионы слаб.кис-т связаны с волой Н-связью.Если это анионы слаб.к-ты,то они могут «оторвать» и присоед. к себе ион Н. При этом образуется слаб.к-та или кисл.анион. Анионы сильн.к-т с водой не взаимодействуют.
Катионы связаны с м-лами воды донорно-акцепторной связью. Такое взаимодействие тем сильнее, чем больше заряд катиона и чем меньше его размер. Катионы, образующ.слаб.основания,будут взаимодействовать с мол-лами воды,притягивая к себе ОН. При этом образ. слаб.основаниеили гидроксокатион.Катионы сильн.оснований с водой не взаимодейств.,т.к. сильн.основания полностью диссоциированы в р-ре.
Степень гидролиза – отношение кол-ва соли,подвергшиеся гидролизу общему кол-ву соли в р-ре. (h)
При разбавлении р-ров солей и нагревании гидролиз усиливается. Степень гидролиза для солей,образован. слаб.к-той и сильн.основанием или сильной к-той и слаб.основанием невелика(~1%). Если в рез-те гидролиза накаплив. ионы Н,то чтобы подавить гидролиз, надо добавить к-ту, а чтобы усилить – основание. Если в резте гидролиза накаплив.ионы ОН, то чтобы подавить гидролиз надо добав. основание, чтобы усилить – к-ту.
Вопрос.
Реакции между электролитами в р-ре – это реакции между ионами, или ионные реакции. Реакция обмена между электролитами в р-ре возможна, т.е. практически необратима, если один из продуктов уходит из сферы реакции: выпадает в осадок, выделяется в виде газа или явл. малодиссоциированным соединением. Ионные реакции записыв. с помощью ионно-молекулярных ур-ний(полных и сокращенных). При этом слаб. электролиты, практич. нерастворимые в-ва, неэлектролиты(простые в-ва, оксиды, газообразные в-ва) необходимо записывать в молекулярной, а сильные электролиты – в ионной форме. Сумма электрич. зарядов левой части уравнения должна быть равна сумме электрич. зарядов правой части.
Многочислен.ионообменные реакции в р-рах электролитов, кот. протекают необратимо, можно разбить на 4 типа:
1. Реакции с образованием осадков:
AgNO3 +HCl=AgCl ↓+HNO3
Ag+ + NO3− + H+ + Cl− = AgCl ↓+ H+ + NO3−
Ag+ + Cl− = AgCl↓
2. Реакции с образованием газообразных малорастворимых веществ:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ +H2O
2Na+ + CO32- + 2H+ + SO42- → 2Na+ + SO42- + CO2↑ + H2O
CO32- + 2H+ → CO2↑ + H2O
3. Реакции с образованием малодиссоциирующих в-в(слабых электролитов):
HCl + KOH → KCl + H2O
H+ + Cl- + K+ +OH-→K+ +Cl- + H2O
H++OH-→H2O
4. Реакции с образованием комплексных соединений(ионов):
CuSO4*5H2O+4NH3 = [Cu(NH3)4]SO4+5H2O
[Cu(H2O)4]2++SO42-+ H2O+4NH3 = [Cu(NH3)4]2++ SO42-+5H2O
[Cu(H2O)4]2++4NH3 = = [Cu(NH3)4]2++4H2O
Таким образом, реакции обмена в р-рах электролитов практич. протекают необратимо в сторону образования осадков(малорастворимых в-в), газов(летучих в-в), слабых электролитов(малодиссоциирующих соединений) и комплексных ионов(в-в).
Реакции нейтрализации - обменные реакции взаимодействия к-т и оснований, в рез-те кот.образуются соль и вода.
При нейтрализации фиксир. св-ва к-т, такие, как изменение под их воздействием окраски некот. растворим. красителей-индикаторов (напр.,фиолетового лакмуса — в красный цвет),каталитич.действие на некот.хим.реакции (напр., инверсиясахаров), растворяющее действие на активн.металлы (Mg, Zn и др.), карбонаты и некот. др. малорастворим. соединения, кисл. вкус водных р-ров, а также потеря всех этих св-в при реакциях с основаниями.
Рассмотрим различные типы реакций нейтрализации.
1. Нейтрализация сильного основания сильной кис-той:
КОН + HNO3 – KNO3 + Н2O.
Молекулярно-ионное уравнение такой реакции Н+ + OН- → Н2O
и отрицательное знач. энергии Гиббса ΔG° показыв., что равновесие практич. смещено в сторону образования воды.
Общим случаем реакции нейтрализации явл. взаимодействие кис-т и оснований, различающихся по силе (степени диссоциации). Эти реакции не доходят до конца вследствие протекания обратной реакции гидролиза соли.
2. Нейтрализация слабой кислоты сильн. основанием: 
или в молекулярно-ионном виде: 
В данном случае реакция нейтрализации обратима. Обратима и реакция нейтрализации слабого основания сильн.кис-той: 
или в молекулярно-ионном виде: 
а также – слабого основания слабой кис-той: 
или в молекулярно-ионном виде: 
В данных системах равновесие сильно смещено вправо, т.к. вода значительно более слабый электролит, чем синильная к-та, аммиак и уксусная к-та.
Окислители и восстановители
Окисли́тельно-восстанови́тельные реа́кции (ОВР) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих в-в, реализующихся путём перераспределения е между атомом-окислителем и атомом-восстановителем. В процессе ОВР восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая ОВР представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
Окисление - процесс отдачи электронов, с увеличением степени окисления.
При окислении в-ва в рез-те отдачи электронов увеличив.его степень окисления. Атомы окисляемого в-ва назыв. донорами, а атомы окислителя — акцепторами. В некот.случаях при окислении м-ла исходн. в-ва может стать нестабильной и распасться на более стабильн.и более мелк.составные части.При этом некот. из атомов получившихся м-л имеют более высокую степень окисления, чем те же атомы в исходн. м-ле. Окислитель, принимая электроны, приобретает восстановительн. св-ва, превращаясь в сопряжённый восстановитель:
окислитель + e− ↔ сопряжённый восстановитель.
Восстановление
Восстановление - процесс присоединения электронов атомом в-ва, при этом его степень окисления понижается.При восстановлении атомы или ионы присоединяют электроны. При этом происходит пониж.степени окисления эл-та. Прим.: восстановление оксидов металлов до свободных металлов при помощи Н, углерода, др.в-в; восстановление органич. к-т в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные св-ва, превращаясь в сопряжённый окислитель:
восстановитель — e− ↔ сопряжённый окислитель.
Несвязанный, свободный электрон является сильнейшим восстановителем.
Существует три типа ОВР:
1) Реакции МЕЖМОЛЕКУЛЯРНОГО окисления-восстановления (когда окислитель и восстановитель – разные в-ва);
2) Реакции ДИСПРОПОРЦИОНИРОВАНИЯ (когда окислителем и восстановителем может служить одно и то же в-во);
3) Реакции ВНУТРИМОЛЕКУЛЯРНОГО окисления-восстановления (когда одна часть молекулы выступает в роли окислителя, а другая – в роли восстановителя).
Примеры



 Na++ OH- Ba(OH)2
Na++ OH- Ba(OH)2 
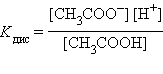 I ступень: H2SO4 ↔ H+ + HSO4¯
II ступень: HSO4¯ ↔ H+ + SO42–
Слабыеоснования:гидроксиды d-элементов,амфотерныегидроксиды,NH4OH,Mg(OH)2,CU(OH)2,Cr(OH)3.
Слабые электролиты диссоциируют ступенчато.Для каждой ступени своя Кд.
I ступень: H2SO4 ↔ H+ + HSO4¯
II ступень: HSO4¯ ↔ H+ + SO42–
Слабыеоснования:гидроксиды d-элементов,амфотерныегидроксиды,NH4OH,Mg(OH)2,CU(OH)2,Cr(OH)3.
Слабые электролиты диссоциируют ступенчато.Для каждой ступени своя Кд.

 +
+  ≠
≠
 =
=  +
+ 
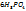 (изб.)=
(изб.)= 
 Fe
Fe 





 и N
и N  )
) взаимодействуют со щелочами только при сплавлении. С нерастворимыми основаниями амфотерные оксиды не взаимодействуют.
взаимодействуют со щелочами только при сплавлении. С нерастворимыми основаниями амфотерные оксиды не взаимодействуют.










