

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
Топ:
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Интересное:
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Дисциплины:
|
из
5.00
|
Заказать работу |
I.Типы химических связей
Ионная связь (электровалентная, гетерополярная). Возникает между атомами, сильно отличающимися по электроотрицательности. Не имеет определенного направления в пространстве, т.к. электрическое поле ионов одинаково и симметрично во всех направлениях. Отличительные черты соединений с ионной связью: мгновенность протекания реакций, диссоциация ионов в водных растворах, высокие температуры кипения и плавления, растворимость в полярных растворителях.
Ковалентная связь (гомеополярная). Образуется за счет обобществления электронов. Обладает высокой прочностью. Энергия зависит от степени перекрывания между атомнымиорбиталями. Имеет направленность в пространстве. Неполярная ковалентная связь – между атомами с одинаковойэлектроотрицательностью. Полярная ковалентная связь – между атомами с разнойэлектроотрицательностью.
II.Ковалентная связь
1.Виды гибридизации атома углерода
Близкие по энергии и имеющие общие элементы симметрии молекулярные орбитали могут взаимодействовать между собой, образуя гибридные орбитали с более низкой энергией.
При взаимодействии s-орбитали с 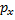 -орбиталью образуются две sp-гибридизированныеорбитали, имеющиеся, например, у атомов углерода в ацетилене. Такой тип гибридизции называется sp-гибридизацией (или диагональной гибридизацией).
-орбиталью образуются две sp-гибридизированныеорбитали, имеющиеся, например, у атомов углерода в ацетилене. Такой тип гибридизции называется sp-гибридизацией (или диагональной гибридизацией).
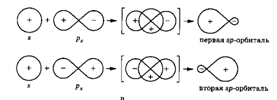
Если взаимодействует две p-орбитали ( ) и s-орбиталь, то три образовавшиеся
) и s-орбиталь, то три образовавшиеся  орбитали (тригональная или
орбитали (тригональная или  -гибридизация) лежат в одной плоскости, образуя между собой угол в 120 градусов (например, этилен).
-гибридизация) лежат в одной плоскости, образуя между собой угол в 120 градусов (например, этилен).

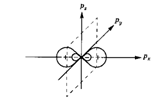
При взаимодействии s-орбитали с тремя p-орбиталями( ) четыре образовавшиеся орбитали (тетраэдрическая, или
) четыре образовавшиеся орбитали (тетраэдрическая, или  -гибридизация) направлены к вершинам правильного тетраэдра и образуют между собой угол
-гибридизация) направлены к вершинам правильного тетраэдра и образуют между собой угол 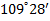 (например, метан).
(например, метан).

2.Понятие орбитали, способы перекрывания орбиталей:  - и
- и 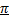 - связи, циклические орбитали (ароматические соединения)
- связи, циклические орбитали (ароматические соединения)
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
Образовавшуюся орбиталь называют сигма (σ)-орбиталью, а связь – σ -связью, если перекрывание орбиталей осуществляется вдоль оси связыванияатомов. Так, например, при образовании связей с атомами водорода в метанечетыре sp3-гибридных орбитали атома углерода перекрываются с 1s-орбиталями четырёх атомов водорода, образуя четыре одинаковых прочных σ–связи под углом 109°28´ (тетраэдрический угол).
При перекрывании атомных орбиталей вне оси связывания атомов образуется так называемая π-молекулярная орбиталь, а связи называются π - связями. Образуется при взаимодействии двух p-орбиталей соседних атомов. В этом случае возникает две области максимальной электронной плотности условно выше и ниже оси связи. Поэтому π-связь менее прочна и ее электроны могут значительно легче смещаться в сторону одного из атомов.
Циклическиеорбитали (на примере бензола). Шесть атомов углерода, связанные друг с другом σ-связями одинаковой длины образуют правильный шестиугольник, причем все 6 атомов углерода расположены в одной плоскости. Атомы углерода находятся в  -гибридизации. В результате сопряжения р-электронов р-орбиталей шести атомов углерода образуется единое π-электронное облако, расположенное над и под кольцом. Эти электроны не связаны с каким-либо одним атомом углерода и могут перемещаться относительно них. Это обусловливает особую устойчивость бензола.
-гибридизации. В результате сопряжения р-электронов р-орбиталей шести атомов углерода образуется единое π-электронное облако, расположенное над и под кольцом. Эти электроны не связаны с каким-либо одним атомом углерода и могут перемещаться относительно них. Это обусловливает особую устойчивость бензола.
3.Свойства ковалентной связи: энергия связи, полярность связи, направленность в пространстве (примеры)
Энергия связи. Энергия связи – энергия, которую необходимо затратить, чтобы разорвать химическую связь между атомами. Если элементы имеют высокую или низкую электроотрицательность, связи непрочные (F-F, Na-Na). Если связь образована неодинаковыми атомами, то чем больше разница в электроотрицательности, тем связь прочнее(H-F). Энергия связи зависит от природы заместителей, находящихся у связанных атомов.
Полярность связи. Ковалентная связь между двумя одинаковыми атомами является неполярной, в том случае, если электронная плотность распределена равномерно между ядрами атомов, образующих связь. Например, С-Ссвязи в молекулах этана, этилена, бензола являются ковалентными неполярными связями.
Если ковалентная связь образована атомами с разной электроотрицательностью, то электроны связи сдвинуты к атому, имеющему большее еёзначение. В этом случае связь является ковалентной полярной (H-Cl).
Направленность связи. Направленность – определяет пространственную структуру молекулы (форму молекулы). Направленность зависит: 1) – от числа атомов в молекуле; 2) – от типа взаимодействующих электронных облаков. Формы молекул: линейная (НСl, H2, Cl2), угловая (Н2О, Н2S), пирамидальная (NH3, PH3), треугольная (BCI3, AICI3), тетраэдрическая (CCI4, CH4).
4.Гомолитический и гетеролитический разрыв ковалентной связи (на примерах)
Любая простая (одинарная) связь образована парой электронов. При разрыве связи двухатомной молекулы может реализоваться ситуация, когда у каждого из атомов остается по одному электрону – такой разрыв связи называется гомолитическим. При этом образуются свободные радикалы.
H – Cl 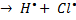
При изменении условий реакции или характера связи связь может рваться так, что оба электрона останутся у одного из атомов – это гетеролитический разрыв связи. Это способ, обратный образованию ковалентной связи по донорно-акцепторному механизму.
H – O – H 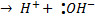
Алкены CnH2n
1.Характеристики углерод-углеродных связей:

| Еσ+π (энергия двойной связи) С=С (σ+π) | 620 кДж/моль |
| Еσ (энергия σ-связи) С-С | 348 кДж/моль |
| Отсюда Еπ (энергия π-связи) | 272 кДж/моль, |
| т.е. Еπ на 76 кДж/моль меньше Еσ. |
Поэтому для алкенов наиболее характерны реакции, протекающие за счет раскрытия менее прочной π-связи. При этом π-связь (в исходном алкене) преобразуется в σ-связь в продукте реакции. Исходное ненасыщенное соединение превращается в насыщенное без образования других продуктов, т.е. происходит реакция присоединения.
2.Способы образования двойной связи: фрагментация и дегидрирование алканов в их термических и каталитических превращениях, частичное гидрирование тройной связи, дегидрогалогенирование, дегалогенирование, дегидратация, термическое разложение четвертичных аммониевых оснований, превращение карбонильной группы в двойную углерод-углеродную связь. Качественное описание двойной связи в терминах локализованных s - и p -МО на основе представлений о sp2-гибридизации углерода. Отсутствие свободного вращения относительно двойной связи как причина геометрической изомерии алкенов.
3.1) Галогенирование. Алкены при обычных условиях присоединяют галогены, приводя к дигалогенопроизводнымалканов, содержащим атомы галогена у соседних углеродных атомов.
H2C=CH2 + Br2 ® BrCH2–CH2Br(1,2-дибромэтан)
Приведенная реакция - обесцвечивание алкеном бромной воды является качественной реакцией на двойную связь.
2) Гидрирование. Алкены легко присоединяют водород в присутствии катализаторов (Pt, Pd, Ni), образуя предельные углеводороды.
CH3–CH=CH2 + H2 ––Ni® CH3–CH2–CH3(пропан)
3) Гидрогалогенирование. Этилен и его гомологи присоединяют галогеноводороды, приводя к галогенопроизводным углеводородов.
H2C=CH2 + HBr ® CH3–CH2Br(бромистый этил)
Присоединение галогеноводородов к пропилену и другим алкенам происходит в соответствии с правилом В.В.Марковникова (водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи).
| CH3−CH=CH2 + HCl ® CH3− | CH−CH3(2-хлорпропан) I Cl |
Для более полного изучения материала по присоединению галогеноводородов к алкенам (реакция гидрогалогенирования) необходимо просмотреть анимационный фильм "Электрофильное присоединение к алкенам" (доступен только на CD-ROM). Обращаем внимание на то, что текст, сопровождающий этот фильм, в полном объеме перенесен в данный подраздел и ниже следует.
Электрофильное присоединение к алкенам
"Двойная связь алкенов легко поляризуется под влиянием заместителей. Рассмотрим влияние метильной группы и атома фтора как заместителей на распределение электронной плотности при двойной связи.
В молекуле этилена распределение электронной плотности равномерно вследствие симметричности молекулы. Электроно-донорные заместители (например, метильная группа) смещают электронную плотность двойной связи в сторону незамещенного атома углерода, в результате чего на атомах углерода возникают частичные заряды – d+ и d-. При наличии электроно-акцепторного заместителя (например, атома фтора) смещение электронной плотности осуществляется в сторону атома углерода, связанного с галогеном.
Реакция присоединения хлористого водорода к несимметричным алкенам идет по правилу Марковникова, а именно: атом водорода присоединяется к наиболее гидрогенизированному атому углерода при двойной связи, то есть к атому углерода с наибольшим числом водородных атомов.
| CH3−CH=CH2 + HCl ® CH3− | CH−CH3 I Cl |
Рассмотрим механизм приведенной реакции. На начальной стадии осуществляется диссоциация хлористого водорода на протон (электрофил) и хлорид-анион (нуклеофил).
HCl «H+ + Cl-
Образующийся протон атакует двойную связь исходногоалкена, приводя к вторичному карбониевому катиону.
CH3−CH=CH2 + H+ ® CH3−C+H−CH3
На конечной стадии механизма хлорид-анион присоединяется к карбониевому катиону и образуется конечный продукт – хлористый изопропил.
| CH3−C+H–CH3 + Cl- ® CH3− | Cl I CH−CH3.” |
4) Гидратация. В присутствии минеральных кислот олефины присоединяют воду, образуя спирты.
| OH I | ||
| CH3− | C=CH2(2-метилпропен-1) + H2O ––H+® CH3− | C−CH3(2-метилпропанол-2) |
| I CH3 | I CH3 |
5) Сульфатация (O- сульфирование). Взаимодействие алкенов с серной кислотой приводит к кислым эфирам серной кислоты.
| CH2=CH−CH3 + HO−SO2−OH ® CH3− | CH−O−SO2−OH(изопропилсернаякислота) I CH3 |
Как видно, направление реакций гидратации и сульфирования также определяется правилом Марковникова.
4 Полимеризация – реакция образования полимера без образования низкомолекулярных продуктов. В качестве мономера используется молекула, содержащая кратную связь. При полимеризации этилена роль бифункциональной структурной единицы играет двойная связь, которая под влиянием инициатора (например, органического пероксида перикисибензолоила (C6H5COO)2), легко переходит в радикальное состояние R∙; присоединение радикала создает условия для роста цепи:
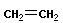 + + 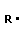 → → 
| инициирование | |
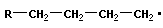
| рост цепи |
Для реакции полимеризации характерны три стадии: инициирование, рост цепи и обрыв цепи:

| обрыв цепи |
Этот тип полимеризации называется радикальным.
Полимеризация может инициироваться катионами или анионами (ионами). Ионная полимеризация включает те же стадии (инициирование, рост цепи, обрыв цепи). Инициаторами катионной полимеризации могут быть H+, неорганические апротонные кислоты SnCl4, AlCl3, металлоорганические соединения Al(C2H5)3. Инициаторами анионной полимеризации обычно служат электронодонорные соединения (щелочные металлы, их алкоголяты и т. д.).
Катионная полимеризация:
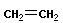 + + 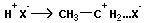
| ||
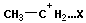 + + 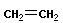 → → 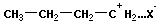
| и т. д. |
Анионная полимеризация:
 + +  
| ||
 + +  
| ||
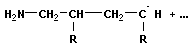
| рост цепи | |
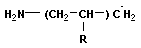 + +   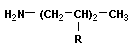
| обрыв цепи |
Диеновые углеводороды
1(Типы диеновых углеводородов)
Диеновые углеводороды – это углеводороды с двумя двойными связями.
Общая формула диеновых углеводородов: СnН2n-2.
Алкадиены, в молекулах которых две двойных связи разделены одной простой связью, называются соединениями с сопряженными двойными связями (дивинил и его гомологи).
СН2=СН-СН =СН2 бутадиен-1,3 (дивинил).
Алкадиены, в молекулах которых две двойных связи примыкают к одному углеродному атому, называются углеводородами с кумулированными двойными связями (аллен и его гомологи):
СН2=С=СН2 пропадиен-1,2 (аллен);
R-СН =С=СН2 алкилаллены.
Углеводороды, в молекулах которых две двойных связи разделены двумя и более простыми связями, называются алкадиенами с изолированными двойными связями.
СН2=СН—СН2—СН=СН2 пентадиен-1,4.
Химические свойства диеновых углеводородов.
Имея двойные связи в молекулах, диеновые углеводороды вступают в обычные реакции присоединения.
Например: а) обесцвечивают бромную воду; б) присоединяют галогеноводороды.
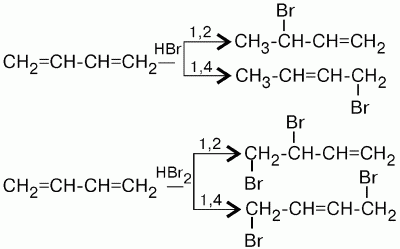
3(Реакция 1,4 и 1,2 присоединения)
Характерной особенностью реакции присоединения является то, что наряду с обычным 1,2-присоединением идет 1,4-присоединение, при этом между 2-м и 3-м углеродными атомами возникает двойная связь. При реакции бутадиена-1,3 с бромистым водородом получается два продукта:
2(Строение п связи в сопряженных диенах)
1,3-Диены отличаются рядом особенностей в своем
химическом поведении, которое обусловлено их электроннымстроением.
CH2 = CH - CH = CH2
В молекуле бутадиена-1,3 между атомами углерода имеются три σ-связи,
образованные sр2-электронами, и две π-связи, образованные четырьмя р-
электронам. При этом происходит перекрывание всех четырех р-орбиталей, т.е образуется единое облако р-электронов, которое находится в плоскости,
перпендикулярной плоскости σ-связей. Это взаимодействие двух π-связей
получило название эффекта сопряжения.
В этом случае отдельные пары π-электронов не закреплены за определенными связями, а распределены (делокализованы) по всей молекуле. р-Орбитали нескольких атомов могут перекрываться друг с другом, образуя
общую π-электронную систему. Такой особый вид взаимного влияния атомов
называется сопряжением.
Сопряжение - это образование в молекуле единогоделокализованного
электронного облака в результате перекрывания негибридизованных p-орбиталей. Возможно два типа сопряжения:
а) π,π-сопряжение - делокализованные МО могут принадлежать двум или более
π-связям.
б) р,π- сопряжение -в сопряжении могут участвовать π-связи и соседний атом с р-орбиталью.
Сопряжение приводит к тому, что в молекуле другие длины связей (стремление к выравниванию). Молекулы с делокализованными связями имеют по сравнению с молекулами с изолированными связями, энергию.
4(Мономеры для каучуков)
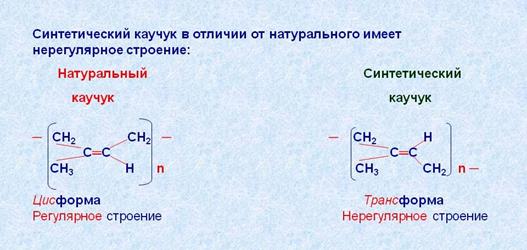
Продуктом полимеризации 2-метилбутадиена-1,3 (изопрена) является природный каучук.
Алкины
1 Кислотность
Особенность электронного строения алкинов — повышенная полярность ацетиленовой связи С—Н. Она обусловлена следующими причинами. Известно, что 2s-электроны в среднем Расположены ближе к ядру, чем 2p-электроны: 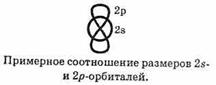
Орбитали ацетиленового атома углерода (sp-гибридные орбитали) содержат значительно больший вклад p-характера, чем sp3-и sp2-орбитали. Это приводит к увеличению электронной плотности вблизи атома углерода. Если такой атом образует за счет sp-орбитали связь, то в ней, соответственно, электронная плотность сдвинута в сторону атома углерода (по сравнению с такой же связью, образованной sp3-гибридизованным атомом). Иными словами можно сказать, что у sp-гибридизованного атома углерода электроотрицательность выше, чем у sp3- и sp2-гибридизованных атомов. Соответственно, у алкинов с тройной связью на конце цепи (терминальных алкинов) соответствующая связь С-Н более полярна, чем в алкенах и алканах, и имеет слабокислотный характер.
в терминальныхалкинах (с тройной связью на конце цепи) концевой атом водорода проявляет слабокислотные свойства. Соответственно такие алкины могут вступать в реакции с сильными основаниями и образовывать соли — ацетилениды:  (ацетилениддинатрия)
(ацетилениддинатрия)
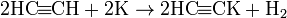 (ацетиленид калия)
(ацетиленид калия)
2

Циклические углеводороды
1) Виды
Алициклические - углеводороды, в которых углеродные цепи образуют циклы, не обладающие ароматическим характером.(не содержат бензольного кольца)
Циклобутенциклопентадиен
Ароматические соединения — циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными свойствами являются повышенная устойчивость ароматической системы и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения.(содержат бензольное кольцо)
2)Типы напряжения
Торсионное-взаимодействие связей в заслоненнойкомформаии.
Ван –Дер –Вальса Отталкивание взаимных заместителей близкое сумме радиусов.
Угловое отклонение валентных углов между с-с в цикле.Кресло –нет напряжение.
Ароматические соединения
Понятие
Склонны к реакции замещения при этом ненасыщенные.Бензол насыщенный все связи в одной плоскости.Ароматические соединения — циклические органические соединения, которые имеют в своём составе ароматическую систему. Основными отличительными свойствами являются повышенная устойчивость ароматической системы и, несмотря на ненасыщенность, склонность к реакциям замещения, а не присоединения. 4n+2
Бензо́л (C6H6, PhH) — органическое химическое соединение, бесцветная жидкость со специфическим сладковатым запахом.Бензол по составу относится к ненасыщенным углеводородам (гомологический ряд CnH2n-6), но в отличие от углеводородов ряда этилена C2H4 проявляет свойства, присущие насыщенным углеводородам (для них характерны реакции присоединения) только при жёстких условиях, а вот к реакциям замещения бензол более склонен. Такое «поведение» бензола объясняется его особым строением: нахождением всех связей и молекул на одной плоскости и наличием в структуре сопряжённого 6π-электронного облака. Современное представление об электронной природе связей в бензоле основывается на гипотезе ЛайнусаПолинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
Бензойдные и небензойдные
Различают бензоидные (арены и структурные производные аренов, содержат бензольные ядра) и небензоидные (все остальные) ароматические соединения. Среди небензоидных ароматических соединений хорошо известны азулен, аннулены, гетарены (пиридин, пиррол, фуран, тиофен), ферроцен. Бензойдные с изолированными ядрами (дифенилметан,полистирол).С конденсированными (нафталин,пирен)Арены.
Электрофильное замещение
1. Электрофильное замещение (SE) – механизм реакции взаимодействия ароматических углеводородов с молекулами, содержащими электрофильные частицы. Примеры электрофильных частиц: Cl+, Br+, NO2+, CH3+, CH3CH2+ и т.п. Катионы типа CH3+, Cl+ существуют в составе комплексов CH3+[AlCl4]- и Cl+[FeCl3]-.
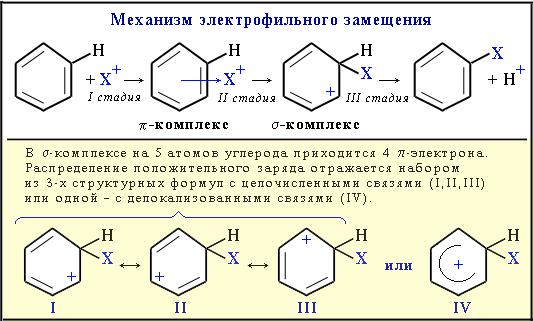
I стадия: образование p-комплекса, в котором электрофильная частица Х+притягивается к p-электронному облаку бензольного кольца.
II стадия (лимитирующая): образование s-комплекса. Два электрона изp-системы идут на образование s-связи С–Х. При этом ароматичность кольца нарушается. Атом углерода, соединившись с электрофилом Х, переходит из sp2- в sp3-гибридизованное состояние и выходит из системы сопряжения. В системе сопряжения остаются 4 p-электрона, которые делокализованы на 5-ти углеродных атомах кольца (заряд +1).
III стадия: отщепление протона Н+ и восстановление ароматичности кольца, поскольку два электрона разрывающейся связи С–Н переходят в p-систему кольца.
Влияние заместителей на скорость SE
1) Электронодонорные заместители (D) повышают электронную плотность кольца и увеличивают скорость реакции SE(активирующие заместители): -NH2, -OH, -OR, -NHR, -NR2, -NH-C(O)R,алкильные группы
2) Электроноакцепторные заместители (А) понижают электронную плотность кольца и уменьшают скорость реакции SE(дезактивирующие заместители): -NO2, -CF3, -SO3H, -NR3, -CN
Спирты и фенолы
Водородная связь)
Она образуется между молекулами, содержащими электроотрицательные атомы (О, N, F, реже CI, Br, S), которые имеют неподеленную электронную пару, и молекулами с активными атомами водорода. Активными называются атомы водорода, связанные с другим атомом сильно полярной кова-лентной связью. 
2(Амфотерность спиртов)
Наличие полярной связи между кислородом и водородом в группе -ОН обуславливает кислотные свойства спиртов, а неподеленные пары электронов на атоме кислорода — основные свойства.
Кислотные свойства убывают в ряду:
первичный спирт > вторичный спирт > третичный спирт.
Основные свойства в этом ряду, наоборот, возрастают, что обусловлено электронодонорными алифатическими радикалами.
Многоатомные спирты являются более сильными кислотами, чем одноатомные, что обусловлено -I эффектом групп ОН, стабилизацирующим анион:
Благодаря более выраженным кислотным свойствам многоатомные спирты реагируют с Сu (OH)2, образуя растворимые комплексные соединения -хелаты.
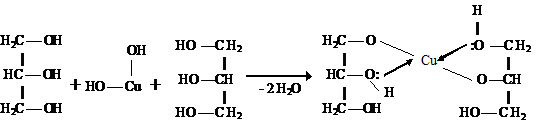
Наличие слабых кислотных и основных центров в одной и той же молекуле приводит к образованию водородных связей. В растворе спиртов молекулы связаны друг с другом межмолекулярными водородными связями.
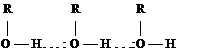
Энергия водородной связи небольшая, примерно 10 - 30 кДж/ моль, но обычно их образуется много и действует кооперативный эффект. Образование водородных связей в спиртах приводит к повышению температуры кипения по сравнению с углеводородами.
Водородные связи играют важную роль в стабилизации пространственной структуры белков, двойной спирали ДНК.
3(Сходство и различие спиртов и фенолов)
Сходство:
1)как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
2C6H5OH + 2Na ->2C6H5ONa + H2(фенол)
2C2H5OH + 2K ->2C2H5O–K+ + H2 (спирт)
2) р.горения (она,правда, всем свойственна)
2 C2H4(OH)2 + 5 O2 = 4 CO2 + 6 H2O
C6H5OH + 7 O2 = 6 CO2 + 3 H2O
3) +активные металлы (опять же, это свойственно не только фенолу и многоатомным спиртам)
С2H4(OH)2 + 2 Na = C2H4(-O-Na)2 + H2
2 C6H5OH + 2 Na = 2 C6H5-O-Na + H2
Отличие:
-фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
-фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
-фенол не вступает в реакции дегидратации.
Кислотные свойства фенола ярко выражены
Фенол при действии с щелочью дает соли – феноляты
C6H5OH + NaOH = C6H5ONa + HOH
Карбоновые кислоты
Окисление альдегидов.
Для окисления альдегидов используют те же реагенты, а также оксид серебра

Окисление алкилбензолов.
В качестве окислителей используют перманганат калия, соединения хрома(VI), азотную кислоту и т.д
Гидролиз нитрилов.
Нитрилы подвергаются гидролизу как в кислой, так и в щелочной среде, например:
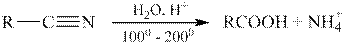
Гидролиз нитрилов.
Нитрилы подвергаются гидролизу как в кислой, так и в щелочной среде, например:
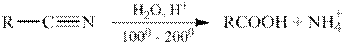
Гидролиз функциональных производных карбоновых кислот (ацилгалогенидов, ангидридов, сложных эфиров, амидов и т.д.).
Все функциональные производные карбоновых кислот при гидролизе в кислой или щелочной среде образуют карбоновые кислоты или их соли.
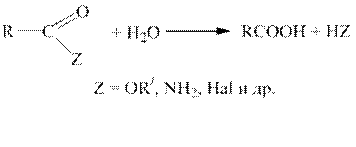
Жиры
Жиры – сложные эфиры глицерина и высших одноосновных карбоновых кислот
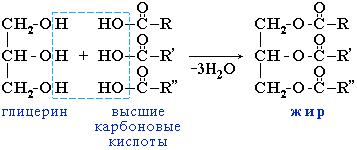
Общее название таких соединений – триглицериды или триацилглицерины, где ацил – остаток карбоновой кислоты -C(O)R.
В состав природных триглицеридов входят остатки насыщенных (предельных) кислот (пальмитиновой C15H31COOH, стеариновой C17H35COOH и др.) и ненасыщенных (непредельных) кислот (олеиновой C17H33COOH, линолевойC17H31COOH, линоленовой C15H29COOH и др.).
Природные кислоты, образующие молекулы жира, имеют неразветвленное строение и содержат четное число углеродных атомов (от 4 до 24). В ненасыщенных кислотах присутствуют связи С=С в цис-форме. Эти особенности строения жиров обусловлены процессами биосинтеза.
Жиры содержатся во всех растениях и животных. Они представляют собой смеси полных сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
· Физические свойства жиров
При комнатной температуре жиры (смеси триглицеридов) – твердые, мазеобразные или жидкие вещества. Как любая смесь веществ, они не имеют четкой температуры плавления (т.е. плавятся в некотором диапазоне температур). Определенной температурой плавления характеризуются лишь индивидуальные триглицериды.
Консистенция жиров зависит от их состава:
в твердых жирах преобладают триглицериды с остатками насыщенных кислот, имеющие относительно высокие температуры плавления;
для жидких жиров (масел), напротив, характерно высокое содержание триглицеридов ненасыщенных кислот с низкими температурами плавления.
Причиной снижения температуры плавления триглицеридов с остатками ненасыщенных кислот является наличие в них двойных связей с цис-конфигурацией. Это приводит к существенному изгибу углеродной цепи, нарушающему упорядоченную (параллельную) укладку длинноцепных радикалов кислот.
Сравним пространственное строение ненасыщенной и насыщенной и кислот с равным числом углеродных атомов в цепи: олеиновой C17H33COOH и стеариновой C17H35COOH.
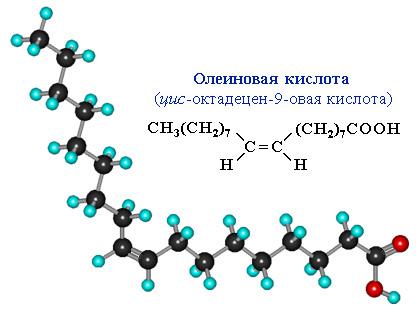
На молекулярной модели олеиновой кислоты виден изгиб цепи по связи С=С, препятствующий плотной упаковке молекул.
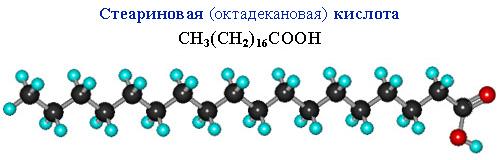
В углеродной цепи стеариновой кислоты отсутствуют изгибы, поэтому ее молекулы способны к плотной параллельной укладке.
Чем плотнее упаковка молекул вещества, тем выше температуры его фазовых переходов (т.плав., т.кип.). Соответственно, температура плавления тристеарата глицерина (71 oC) существенно больше, чем у триолеата (–17 oC).
Жиры практически не растворимы в воде, но при добавлении мыла или других поверхностно-активных веществ (эмульгаторов), они способны образовывать стойкие водные эмульсии. Жиры ограниченно растворимы в спирте и хорошо растворимы во многих неполярных и малополярных растворителях – эфире, бензоле, хлороформе, бензине.
Животные жиры (бараний, свиной, говяжий и т.п.), как правило, являются твердыми веществами с невысокой температурой плавления (исключение – рыбий жир). В твёрдых жирах преобладают остатки насыщенных кислот.
Растительные жиры – масла (подсолнечное, соевое, хлопковое и др.) – жидкости (исключение – кокосовое масло, масло какао-бобов). Масла содержат в основном остатки ненасыщенных (непредельных) кислот.
Жидкие жиры превращают в твердые путем реакции гидрогенизации (каталитического гидрирования). При этом водород присоединяется по двойной связи, содержащейся в углеводородном радикале молекул масел.
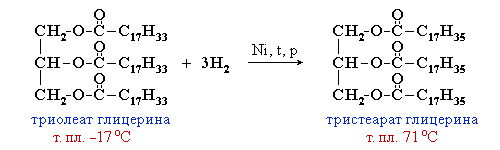
Натриевые соли – твердые мыла, калиевые – жидкие. Реакция щелочного гидролиза жиров, и вообще всех сложных эфиров, называется также омылением.
Высшие карбоновые кислоты можно выделить из мыла действием более сильных кислот.
При длительномхранениии жиры портятся (прогоркают). Под действием воздуха, света и микроорганизмов происходит частичный гидролиз жиров с образованием свободных жирных кислот и продуктов их превращения, обычно имеющих неприятный запах и вкус. Срок годности жиров увеличивается при низкой темературе и в присутствии консервантов (чаще всего поваренной соли).
Жиры, содержащие остатки ненасыщенных кислот, способны к окислению по связям С=С. Важное значение имеют так называемые высыхающие масла (льняное, тунговое и др.), которые входят в состав красок и лаков (в частности, олифы). Эти масла отличаются высоким содержанием остатков кислот с двумя или тремя двойными связями и способны к образованию на окрашиваемой поверхности прочной пленки за счет полимеризации по кратным связям под действием кислорода воздуха.
Альдегиды и кетоны
Амины как основнования)
I. Основные свойства
Для аминов характерны основные свойства, которые обусловлены наличием не поделённой электронной пары на атоме азота
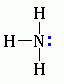
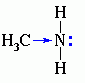

Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет + I -эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами.
Ряд увеличения основных свойств аминов:
| C6H5-NH2 < NH3 < R3N < R-NH2 < R2NH -------------------------------------------------→ возрастание основных свойств |
В растворах оснoвные свойства третичных аминов проявляются слабее, чем у вторичных и даже первичных аминов, так как три радикала создают пространственные препятствия для сольватации образующихся аммониевых ионов. По этой же причине основность первичных и вторичных аминов снижается с увеличением размеров и разветвленности радикалов.
Водные растворы аминов имеют щелочную реакцию (амины реагируют с водой по донорно-акцепторному механизму):

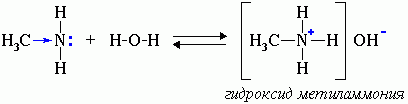
R-NH2 + H2O → [R-NH3]+ + OH-
ион алкиламмония
ВИДЕО:
Получение гидроксида диметиламмония и изучение его свойств
Анилин с водой не реагирует и не изменяет окраску индикатора!!!
ВИДЕО:
Изучение среды раствора анилина
Взаимодействие с кислотами (донорно-акцепторный механизм):
CH3-NH2 + H2SO4 → [CH3-NH3]HSO4
(соль - гидросульфат метиламмония)
2CH3-NH2 + H2SO4 → [CH3-NH3]2SO4
(соль - сульфат метиламмония)
Соли неустойчивы, разлагаются щелочами:
[CH3-NH3]2SO4 + 2NaOH → 2CH3-NH2 ↑ + Na2SO4 + H2O
Способность к образованию растворимых солей с последующим их разложением под действием оснований часто используют для выделения и очистки аминов, не растворимых в воде. Например, анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси, а затем, добавив раствор щелочи (нейтрализация водного раствора), выделить анилин в свободном состоянии.
Амины как нуклеофилы)
Алкилирование аминов
Амины обладают нуклеофильными свойствами и алкилируютсяалкилгалогенидами и спиртами (см. методы получения).
Ацилирование аминов
Амины ацилируются карбоновыми кислотами и их производными с образованием амидов карбоновых кислот (см. лек. №12).
2RNH2 + R/COX ® R/CONHR + RNH3X
2R2NH + R/COX ® R/CONR2 + R2NH2X
(X=Cl, OCOR/)
I.Типы химических связей
Ионная связь (электровалентная, гетерополярная). Возникает между атомами, сильно отличающимися по электроотрицательности. Не имеет определенного направления в пространстве, т.к. электрическое поле ионов одинаково и симметрично во всех направлениях. Отличительные черты соединений с ионной связью: мгновенность протекания реакций, диссоциация ионов в водных растворах, высокие температуры кипения и плавления, растворимость в полярных растворителях.
Ковалентная связь (гомеополярная). Образуется за счет обобществления электронов

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!