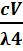Элементарная коллоидная частица – мицелла – содержит нерастворимое в данной дисперсионной среде ядро, состоящее из диспергированного твердого вещества (агрегата) с адсорбированными ионами (потенциалопределяющими ионами – ПОИ).По правилу Панета – Фаянса «на поверхности твердого вещества адсорбируются ионы, способные достраивать его кристаллическую решетку, т. е. ионы имеющие общую атомную группировку с агрегатом». Эти ионы и придают поверхности ядра электрический заряд. После возникновения заряда ядро притягивает из раствора ионы с противоположным знаком (противоионы), образуется двойной электрический слой. Часть противоионов прочно притягивается к ядру, образуя адсорбционный слой противоионов. Ядро вместе с адсорбционным слоем называется частицей или гранулой. Гранула характеризуется двойным электрическим слоем, который образуется из потенциалопределяющих ионов и противоионов. Противоионы, которые находятся вне гранулы, образуют диффузный слой противоионов.
Схема строения мицеллы.
Пример: золь иодида серебра, полученного по реакции взаимодействия АgNO3 и KI при избытке KI.
АgNO3 + KI → АgI¯ + К NO3
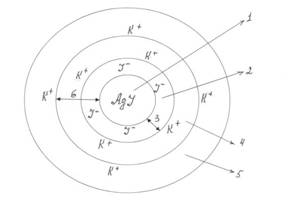
1 – агрегат; 2 – потенциалопределяющие ионы; 3 – ядро; 4 – противоины адсорбционного слоя; 5 – противоионы диффузного слоя; 6 – гранула.
6. Свойства лиофобных коллоидных растворов: молекулярно-кинетические, оптические, диализ, электродиализ.
Основные свойства лиофобных золей связаны с их ультрамик-рогетерогенностью, т. е. мельчайшими размерами частиц дисперсной фазы, и огромной суммарной поверхностью раздела между дисперсной фазой и дисперсионной средой.
Молекулярно-кинетические свойства (МКС). К ним относятся свойства, связанные с тепловым движением частиц: броуновское движение, диффузия, осмос. Эти свойства зависят от размеров и массы частиц дисперсной фазы (броуновское движение и диффузия), а также от числа частиц в единице объема системы (осмотическое давление). Так как размеры коллоидных частиц значительно больше размеров отдельных ионов и молекул, то, при одинаковой массовой концентрации, число коллоидных частиц в единице объема коллоидного раствора будет гораздо меньше, чем число молекул или ионов в единице объема истинных растворов низкомолекулярных веществ. Этим объясняется тот факт, что МКС в коллоидных растворах выражены менее интенсивно, чем в истинных: скорость диффузии коллоидных частиц очень мала, осмотическое давление коллоидных растворов низкое. Так, осмотическое давление 1% истинного раствора сахара составляет 79,5 кПа, а 1% коллоидного раствора сульфида мышьяка(3) AS2S3 - всего 3,4 × 10-3кПа.
Оптические свойства. Специфическим свойством коллоидных растворов является их способность рассеивать свет. Это обусловлено гетерогенностью коллоидных систем и размерами коллоидных частиц.
Грубодисперсные системы, размеры частиц в которых (r > > 10-6 м) значительно превышают длины волн видимого света ( 𝝀 = (3,6-7,6) ×10-7 м), отражают свет и поэтому выглядят мутными. В истинных растворах низкомолекулярных веществ молекулы и ионы имеют размеры 10-10-10-9 м, что значительно меньше длин волн видимого света, поэтому они пропускают свет и являются прозрачными.
Если размеры коллоидных частиц (r = 10-7-10-6 м) соизмеримы с длинами волн видимого света, то такие коллоидные растворы рассеивают свет вследствие явления дифракции. Рассеяние света можно наблюдать при боковом освещении коллоидного раствора: в случае точечного источника света - в виде светящегося конуса (эффект Тиндаля), а при обычном боковом освещении - в виде голубоватой опалесценции раствора. Согласно закону Рэлея интенсивность рассеянного света I зависит от интенсивности I0и длины волны 𝝀падающего света, объема частиц V и их концентрации с:
I = IoK 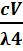
где К - константа, зависящая от соотношения коэффициентов преломления дисперсионной среды и дисперсной фазы.
Из этого выражения следует, что чем меньше длина волны падающего излучения, тем больше будет рассеяние. Этим объясняется голубоватая опалесценция при боковом освещении коллоидных растворов. Красный свет имеет наибольшую длину волны (620-760 нм) в видимой части спектра и рассеивается в меньшей степени. Поэтому запрещающие сигналы имеют красный цвет. Рассеянный солнечный свет, который образуется из-за аэрозольных частиц в атмосфере, имеет голубую окраску и создает голубой цвет неба. На способности золей рассеивать свет основаны такие методы анализа, как нефелометрия и ультрамикроскопия, которые используются для определения концентрации частиц и их размеров в гетерогенных биологических средах.
Диализ. Биологические жидкости, как правило, содержат одновременно вещества в коллоидном состоянии и в виде отдельных молекул и ионов. Очистка коллоидных растворов от истинно растворенных веществ основывается на том, что относительно крупные коллоидные частицы, в отличие от молекул и ионов, не проникают сквозь поры животных и растительных мембран. На практике в качестве мембраны используется пленка из коллодия или целлофана (производные целлюлозы), а также кишечная ткань.
Диализ - процесс очистки коллоидных растворов от ионов и молекул низкомолекулярных примесей в результате их диффузии в чистый растворитель сквозь полупроницаемую мембрану.
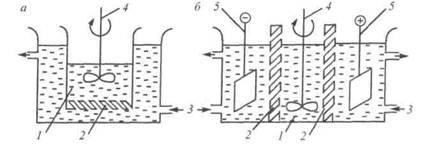
Простейший способ диализа заключается в том, что коллоидный раствор помещают во внутренний сосуд, дно или стенки которого представляют собой мембрану с избирательной проницаемостью, погруженный во внешний сосуд с чистым растворителем (обычно вода). В результате диффузии молекулы и ионы, способные проникать сквозь поры мембраны, переходят в наружный сосуд. В обычных условиях диализ протекает очень медленно. Для ускорения процесса необходимо увеличить градиент концентраций растворенных веществ по обе стороны мембраны. Это легко осуществить периодической или непрерывной сменой растворителя в наружном сосуде (рис. 7 а).
Для ускорения очистки коллоидных растворов от ионов растворенных электролитов используют также метод электродиализа. В этом случае во внешний сосуд помещают электроды и подают постоянный электрический ток (рис. 7 б).
Электродиализ - это диализ в условиях наложения постоянного электрического поля, под действием которого катионы и анионы приобретают направленное движение к электродам.
Электродиализ особенно эффективен при малых концентрациях удаляемого электролита, когда градиент концентраций невелик.
Рис. 7. Схемы диализатора (а) и электродиализатора (б):
1 - диализуемый коллоидный раствор; 2 - мембрана; 3 - подача растворителя; 4 - мешалка; 5 - электроды
В биологических жидкостях количественное определение низкомолекулярных веществ часто проводят методом компенсационного диализа, или вивидиализа. В этом случае биологическая жидкость в диализаторе омывается не чистым растворителем, а растворами с различными концентрациями определяемого вещества. Так, содержание сахара в сыворотке крови определяется путем диализа сыворотки по сравнению с изотоническим раствором, к которому добавляют различные количества сахара. Концентрация сахара во внешнем растворе не изменяется лишь в том случае, когда она равна концентрации сахара в анализируемой сыворотке. Таким образом было выявлено наличие глюкозы и мочевины в крови.
По принципу диализа работает аппарат «искусственная почка» (АИП), применяемый при острой почечной недостаточности, которая может наступить в результате отравления сулемой, сульфаниламидными препаратами, при уремии после переливания крови, при тяжелых ожогах и т. п. АИП подключается к системе кровообращения больного, и кровь протекает через систему, снабженную мембранами с избирательной проницаемостью, которые снаружи омываются физиологическим раствором. При этом кровь в процессе диализа очищается от вредных примесей, после чего поступает обратно в организм.
7. Устойчивость коллоидных растворов: седиментационная, агрегативная. Факторы, влияющие на устойчивость лиозолей.
Устойчивость коллоидных растворов. Биологические жидкости живого организма, такие как кровь, плазма, лимфа, спинномозговая жидкость, моча, представляют собой коллоидные системы. О состоянии организма можно судить по многим показателям этих жидкостей, и прежде всего крови. Наличие патологических процессов сопровождается изменением количества форменных элементов крови (эритроцитов, лейкоцитов и др.), скорости оседания эритроцитов (СОЭ), свертываемости крови и др. Все эти свойства связаны с устойчивостью биологических жидкостей, поэтому изучение устойчивости коллоидных растворов и факторов, влияющих на нее, очень важно для медиков и биологов.
Устойчивость дисперсных систем характеризует способность дисперсной фазы сохранять состояние равномерного распределения частиц дисперсной фазы во всем объеме дисперсионной среды.
В дисперсных системах различают седиментационную и агрегативную устойчивость.
Седиментационная устойчивость характеризует способность частиц дисперсной фазы находиться во взвешенном состоянии и не оседать под действием сил тяжести.
Агрегативная устойчивость характеризует способность частиц дисперсной фазы противодействовать их слипанию между собой и тем самым сохранять неизменными cвои размеры.
Грубодисперсные системы гетерогенны и неустойчивы. Они самопроизвольно расслаиваются на дисперсную фазу и дисперсионную среду, так как относительно крупные частицы дисперсной фазы под действием сил тяжести оседают (седиментируют).
Истинные растворы гомогенны и неограниченно устойчивы, поскольку в них не происходит самопроизвольное выделение растворенного вещества из системы.
Коллоидные растворы относятся к ультрамикрогетерогенным системам и по устойчивости занимают промежуточное положение между грубодисперсными системами и истинными растворами. Коллоидные растворы обычно представляют собой седиментационно устойчивые системы, что обусловлено малыми размерами частиц и их интенсивным броуновским движением.
Агрегативная устойчивость коллоидных растворов с ионным стабилизатором обусловлена наличием на поверхности частиц «рыхлой» ионной атмосферы из гидратированных противоионов, которая увеличивает сродство коллоидных частиц к дисперсной среде и препятствует их слипанию (коагуляции). Ее можно рассматривать как результат взаимодействия двух противоположно направленных сил, которые одновременно действуют на сближающиеся коллоидные частицы: вандерваальсовых сил межмолекулярного притяжения и электростатических сил отталкивания, которые возникают между одноименно заряженными частицами. При сближении коллоидных частиц на расстояние 10-9-10-6 м в области перекрывания их ионных атмосфер, в тонких жидких пленках, разделяющих две твердые поверхности (поверхности ядер), возникает так называемое расклинивающее давление. Оно складывается из трех основных составляющих:
- электростатическое отталкивание одноименно заряженных частиц за счет большого скопления противоионов в области контакта ионных атмосфер;
-
расклинивание за счет упругих свойств гидратных оболочек, окружающих противоионы и состоящих из ориентированных (упорядоченных) диполей воды;
Рис. 8. Схема агрегативной устойчивости мицелл коллоидных растворов
- расклинивание за счет осмотического всасывания молекул растворителя в область контакта ионных атмосфер, т. е. в область большого скопления противоионов.
В коллоидных растворах с ионным стабилизатором главной составляющей расклинивающего давления является электростатическое отталкивание одноименно заряженных частиц. Величина расклинивающего давления зависит от заряда твердой фазы, т. е. от значения межфазного потенциала Фмф, а также от толщины ионной атмосферы, главным образом ее диффузного слоя, т. е. от значения ζ-потенциала (рис. 8). Чем выше заряд твердой фазы, чем больше толщина диффузного слоя и больше значение ζ-потенциала, тем больше расклинивающее давление между частицами и выше агрегативная устойчивость коллоидного раствора. Когда диффузный слой мицеллы тонкий и ζ-потенциал меньше 30 мВ, упругие свойства диффузного слоя невелики, и поэтому при столкновении мицелл происходит перекрывание этих слоев, что приводит к преобладанию сил притяжения и потере агрегативной устойчивости. Таким образом, коллоидные растворы с ионным стабилизатором агрегативно неустойчивы, если их мицеллы имеют ζ<30 мВ относительно устойчивы, если 30 < ζ < 50 мВ и устойчивы, если ζ > 50т мВ.