Первое слагаемое в правой части уравнения Нернста – это стандартный окислительно-восстановительный потенциал, т.е. потенциал, измеренный или чаще вычисленный при стандартных условиях.
В стандартных условиях концентрации всех частиц в растворе по определению равны 1 моль/л, и второе слагаемое в правой части уравнения обращается в нуль.
В нестандартных условиях, когда хотя бы одна из концентраций не равна 1 моль/л, определяемый уравнением Нернста потенциал отличается от стандартного. Потенциал в нестандартных условиях часто называют реальным потенциалом.
Если в ОВР принимают участие один или несколько газов, их стандартными состояниями являются состояния при давлении 1 атм = 101300 Па. Температура при определении стандартных состояний и стандартных потенциалов не стандартизуется и может быть любой.
Таким же образом в общем виде можно рассмотреть и химически обратимые ОВР с Δφо < 0. Вместо этого обсудим возможности управления конкретной химической реакцией
Cu(т) + 2H2SO4 = CuSO4 + SO2(г) + 2H2O
или в ионном виде:
Cu(т) + 4H+ + SO42-= Cu2+ + SO2(г) + 2H2O
с Δφо = – 0,179 В. В стандартных условиях, когда концентрации ионов H+, SO42-, Cu2+ в водном растворе равны 1 моль/л, а давление SO2 составляет 1 атм, эта реакция протекает в обратном направлении, т.е. диоксид серы восстанавливает катион Cu2+ до порошка металлической меди.
92) Во внешней электронной оболочке атомы содержат шесть электронов – два на s-орбитали, и четыре на р-орбитали. Число неспаренных электронов может быть увеличено путем перевода s- и р- электронов на d-подуровень внешней электронной оболочки. В связи с этим сера проявляет валентность,равную не только 2, но также 4 и 6:
S (-2):
FeS; + 2HCl=FeCl(2)+H(2)S;
S(+4):
SO(2)+NaOH=NaHSO(3);
S(+6):
4FeS(2)+11O(2)=2Fe(2)O(3)+8SO(2).
Серная кислота H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). Качественная реакция- с растворимыми солями Ba (2+) => выпадает белый осадок, нерастворимый в HCl, HNO(3).
H2SO4 (p)+ 2Ba(OH)2= Ba(2)SO(4)+ 2H(2)O
Концентрированная H2SO4 c:
1) Fe,Al,Cr пассивирует (не вступает в реакцию) Fe+ H(2)SO(4)k =/=
2) С активными металлами дает S, H(2)S и в редких случаях SO(2): 4 H2SO4 + 3Mg= 3MgSO4+4H2O+S
3) С малоактивными металлами дает только SO(2).
Соли:
Na2SO4 + Ba(OH)2 = BaSO4(осад) + 2NaOH
Zn + CuSO4 = ZnSO4 + Cu(осад)
Сернистая кислота H2SO3. Двухосновная кислота средней силы. Неустойчива. В свободном состоянии не выделена.
Соли: H2SO3+Ba(OH)2=BaSO3+ H2O
H2SO3+ BaO= BaSO3+H2O
H2SO3+BaCl2=BaSO3+2HCl
93) Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в хим.реакциях.
NaH2PO4+HCl=NaCl+H3PO4
В данной реакции 1 атом натрия замещает 1 атом водорода в NaH2PO4. Следовательно, эквивалентное число =1
94) По методу МО кратность связи (к. с.) определяется по формуле:
nē на связывающих МО − nē на разрыхляющих МО
Диаграммы МО, приведенные на рисунке 3.9, показывают, что−
возможно существование таких частиц, как Н2+, Н2 и НеН. Кратность−
такой связи для молекулярного иона Н2 равна 0,5.
Такие частицы действительно обнаруживаются в газовой фазе. В то
же время для молекулы Не2 к.с. = 0, и она не существует.
H2 H2 HеН
p p p
σs σs σs
−
Н Н H Н Не Н
св св св
σs σs σs
Рис. 3.9. Диаграммы МО Н2, Н2−, НеН
За счет неспаренных электронов атомов образуется две связи (С=О), но в атоме кислорода имеется неподеленная электронная пара, а у тома углерода − вакантная АО.
Атом кислорода при этом называют донором, а углерода − акцептором электронной пары. Связь, образованная по такому механизму называется донорно-акцепторной. Таким образом, в молекуле СО между атомами образуется тройная связь, кратность связи равна трем.
Кратность связи – число связей между атомами двух элементов.
Чем больше кратность связи, тем больше энергия связи и тем
меньше длина связи.
95).
При повышении температуры на каждые 10 градусов скорость реакции возрастает в 2-4 раза. Правило Вант-Гоффа V2=V1*y^T2-T1/10
де  — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
96)
Kдис=c*a^2/1-a, Kдис=c*a^2
c - концентрация, K - константа диссоциации, a - степень диссоциации. Этому закону подчиняются только слабые электролиты.
Примеры
Окислительно-восстановительная реакция между водородом и фтором

Разделяется на две полуреакции:
1) Окисление: 
2) Восстановление: 
Окисление, восстановление. В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
 ,
,  ,
,  ,
, 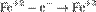 ,
, 
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
 ,
,  ,
, 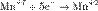 ,
,  ,
, 
Атомы или ионы, которые в данной реакции присоединяют электроны, являются окислителями, а которые отдают электроны — восстановителями.
98 Образование комплексных соединений
Комплексные соединения имеют сложный состав. В них выделяют центральный атом (комплексообразователь) и связанные с ним лиганды (заряженные или нейтральные неорганические или органические частицы, т. е. ионы или молекулы). Комплексообразователь вместе с лигандами составляет внутреннюю координационную сферу соединения. Кроме внутренней сферы, в большинстве случаев имеется также внешняя координационная сфера, состоящая из отрицательных или положительных ионов.Способность к образованию комплексов всего сильнее проявляют элементы, расположенные в средней части больших периодов Периодической системы элементов Д. И. Менделеева (Cu, Ni, Co, Fe, Mn, Zn, Ag и т. д.).
Устойчивость комплексных соединений. Константа нестойкости В растворах комплексных соединений существует система динамических равновесий, т. е. комплексные соединения подвержены в значительной степени электролитической диссоциации. Ионы
или молекулы, находящиеся во внешней сфере, связаны в комплексном соединении гораздо слабее, чем ионы или молекулы, находящиеся во внутренней сфере. Такая различная прочность связи обусловливает характер диссоциации комплексных соединений.
Диссоциация комплексных соединений протекает по стадиям. На первой стадии комплексное соединение диссоциирует как сильный электролит, т. е. практически полностью. Далее, комплексный ион диссоциирует как слабый электролит по ступеням, т. е. лиганды отделяются от комплексообразователя постепенно.
Диссоциация комплекса идет лишь в незначительной степени и может быть охарактеризована величиной общей константы ионизации данного комплекса, которая определяется как произведение констант диссоциации по отдельным ступенямЧем больше величина этой константы, тем сильнее комплекс диссоциирует, тем менее он устойчив. Эта константа
называется константой нестойкости. Обратная величина константы нестойкости называется константой устойчивости:
Константы нестойкости для различных комплексных ионов различны и могут служить мерой устойчивости комплекса. Наиболее устойчивые в растворах комплексные ионы имеют наименьшие константы нестойкости.
Значения констант нестойкости и устойчивости приводятся в справочниках по химии. С помощью этих величин можно предсказать течение реакций между комплексными соединениями: при сильном различии констант устойчивости реакция пойдет в сторону образования комплекса с большей константой устойчивости или, что равноценно, с меньшей константой нестойкости. Например, для иона [Ag(NH3)2] + Kнест = 5,8 · 10 -8, а для иона [Ag(CN)2] - Kнест = 1,4 · 10 -20, поэтому при действии раствора КСN аммиакат серебра разрушается с образованием иона [Ag(CN)2]-:
[Ag(NH3)2]Cl = 2KCN = K[Ag(CN)2] + 2NH3 = KCl
Зная константы нестойкости различных комплексов, можно теоретически вычислить концентрацию соответствующих простых ионов в растворах комплексных солей.



 — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).


 ,
,  ,
,  ,
, 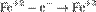 ,
, 
 ,
,  ,
, 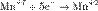 ,
,  ,
, 



