44. Реакция ионного обмена — один из видов химических реакций, характеризующаяся выделением в продукты реакции воды, газа или осадка.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Реакция прекратится тогда, когда весь хлорат калия превратится в хлорид калия и кислород. Необратимых реакций не так много. Большинство реакций являются обратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
Признаки необратимости реакции
1)
Реакция идет с выделеним большого количества теплоты
2)хотя бы один продукт реакции покидает сферу реакции(выпадает осадок)
3)в результате реакции образуется малодиссоциируемые вещества.
45. К равновесным системам следует отнести также и систему труднорастворимый электролит – его насыщенный раствор. В этом случае мы имеем дело с динамическим гетерогенным равновесием 
В насыщенном растворе труднорастворимого сильного электролита произведение концентрации его ионов в степенях стехиометрических коэффициентов при данной температуре есть величина постоянная, называемая произведением растворимости (ПР).
Произведение растворимости характеризует растворимость труднорастворимого электролита при данной температуре. Из двух однотипных солей, например, CaSO4 с ПР = 2,5∙10–5 и BaSO4 с ПР = 1,1∙10–10, большей растворимостью обладает та соль, у которой ПР больше.
46.
Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды.
Водоро́дный показа́тель, pH — мера активности ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:
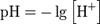
pH воды - один из важнейших рабочих показателей качества воды, во многом определяющих характер химических и биологических процессов, происходящих в воде. В зависимости от величины pH может изменяться скорость протекания химических реакций, степень коррозионной агрессивности воды, токсичность загрязняющих веществ и т.д.
Диссоциация воды
Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды распадаться (диссоциировать) на два иона которые и являются проводниками электрического тока в чистой воде (ниже под диссоциацией подразумевается электролитическая диссоциация - распад на ионы):
H2O ↔ H+ + OH-
47. Гидролиз (от греч. hydro – вода, lysis – разложение) означает разложение вещества водой. Гидролизом соли называют обратимое взаимодействие соли с водой, приводящее к образованию слабого электролита. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей[1]:
- 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):

 (раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
- 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):

 (раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
- 3. Гидролиз соли слабой кислоты и слабого основания:

 (равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
Образование кислых и основных солей имеет большое значение при объяснении процессов гидролиза (см. § 6, гл. [1]
Их ступенчатая диссоциация обусловливает образование кислых и основных солей. [2]
Ступенчатость диссоциации обусловливает возможность образования кислых и основных солей. [3]
Ступенчатая диссоциация обусловливает возможность образования кислых и основных солей. [4]
Ступенчатость диссоциации обусловливает возможность образования кислых и основных солей. [5]
Ступенчатость диссоциации кислот и оснований обусловливает возможность образования кислых и основных солей. Известны электролиты, которые при диссоциации образуют и ионы водорода и ионы гидроксила. Такие соединения называются амфотерными электролитами.
____________________________________________________________
48.константу гидролиза можно выразить через:
Kw-ионное произведение воды
Kg-константа диссоциации
49.Окисли́тельно-восстанови́тельные реа́кции, ОВР,— это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
В зависимости от того, находятся ли атомы, выполняющие в реакции функцию окислителя (акцептора электронов) и восстановителя (донора электронов) в одном или в различных веществах, все окислительно-восстановительные процессы можно разделить на три типа: межмолекулярные, внутримолекулярные и диспропорционирования.
В межмолекулярных (межатомных) реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например, в реакции H2S + Cl2 = S + 2HCl электроны от восстановителя – молекулы сероводорода – переходят к окислителю – молекуле Cl2.
В реакциях внутримолекулярного окисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества:
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
Образование кислых и основных солей имеет большое значение при объяснении процессов гидролиза (см. § 6, гл. [1]
Их ступенчатая диссоциация обусловливает образование кислых и основных солей. [2]
Ступенчатость диссоциации обусловливает возможность образования кислых и основных солей. [3]
Ступенчатая диссоциация обусловливает возможность образования кислых и основных солей. [4]
Ступенчатость диссоциации обусловливает возможность образования кислых и основных солей. [5]
Ступенчатость диссоциации кислот и оснований обусловливает возможность образования кислых и основных солей. Известны электролиты, которые при диссоциации образуют и ионы водорода и ионы гидроксила. Такие соединения называются амфотерными электролитами.
____________________________________________________________
48.константу гидролиза можно выразить через:
Kw-ионное произведение воды
Kg-константа диссоциации
49.Окисли́тельно-восстанови́тельные реа́кции, ОВР,— это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
В зависимости от того, находятся ли атомы, выполняющие в реакции функцию окислителя (акцептора электронов) и восстановителя (донора электронов) в одном или в различных веществах, все окислительно-восстановительные процессы можно разделить на три типа: межмолекулярные, внутримолекулярные и диспропорционирования.
В межмолекулярных (межатомных) реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например, в реакции H2S + Cl2 = S + 2HCl электроны от восстановителя – молекулы сероводорода – переходят к окислителю – молекуле Cl2.
В реакциях внутримолекулярного окисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества:
Реакции диспропорционирования (самоокисления-самовосстановления) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Они характерны для соединений или простых веществ, состоящих из промежуточных степеней окисления данного элемента:
Важнейшие восстановители и окислители
| Восстановители
| Окислители
| | Металлы,
водород,
уголь.
Окись углерода (II) (CO).
Сероводород (H2S);
оксид серы (IV) (SO2);
сернистая кислота H2SO3
и ее соли.
| | Окислители
Галогены.
Перманганат калия(KMnO4);
манганат калия (K2MnO4);
оксид марганца (IV) (MnO2).
Дихромат калия (K2Cr2O7);
хромат калия (K2CrO4).
Азотная кислота (HNO3).
Серная кислота (H2SO4) конц.
Метод электронного балланса
В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путем, либо на основе известных свойств элементов. Рассмотрим применение этого метода на примерах.
Электронный баланс - метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем.
Уравнение составляется в несколько стадий:
1. Записывают схему реакции.
KMnO4 + HCl ® KCl + MnCl2 + Cl2 + H2O
2. Проставляют степениокисления над знаками элементов, которые меняются.
KMn+7O4 + HCl-1 ® KCl + Mn+2Cl2 + Cl20 + H2O
3. Выделяют элементы, изменяющие степени окисления и определяют число электронов, приобретенных окислителем и отдаваемых восстановителем.
Mn+7 + 5ē ® Mn+2
2Cl-1 - 2ē ® Cl20
4. Уравнивают число приобретенных и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления.
| Mn+7 + 5ē ® Mn+2
|
| | 2Cl-1 - 2ē ® Cl20
|
| ––––––––––––––––––––––––
2Mn+7 + 10Cl-1 ® 2Mn+2 + 5Cl20
5. Подбирают коэффициенты для всех остальных участников реакции.
2KMn+7O4 + 16HCl-1 ® 2KCl + 2Mn+2Cl2 + 5Cl20 + 8H2O
B Электронно-ионный баланс (метод полуреакций) метод нахождения коэффициентов, в которомрассматривается обмен электронами между ионами в растворе с учетом характера среды
_______________________________
50. Электродный потенциал, разность электростатических потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение электродный потенциал обусловлено пространственным разделением зарядов противоположного знака на границе раздела фаз и образованием двойного электрического слоя.
Стандартный водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
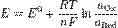 , ,
| 51.Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — red uction- ox idation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно-восстановительный потенциал выражают вмилливольтах (мВ). Примером окислительно-восстановительного электрода: Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение (Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением:
Aox + n·e− → Ared,
то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей) реагирующих веществ выражается уравнением Нернста.
Окислительно-восстановительный потенциал определяют электрохимическими методами с использованием стеклянного электрода с red-ox функцией[2] и выражают в милливольтах (мВ) относительно стандартного водородного электрода в стандартных условиях.
Положительный окислительно-восстановительный потенциал электрода Cu2+│Cu (E ° = +0,34 B) показывает, что в стандартных условиях водород окисляется ионами меди, медный электрод по отношению к водороду является катодом, электроны по внешней цепи переходят от водорода к меди:
Отрицательный потенциал Zn2+│Zn (E ° = –0,76 B) означает, что в стандартных условиях цинковый электрод может быть только анодом, его окислительные функции по отношению к водородному электроду 2H+│H2 отрицательные. Цинк здесь восстанавливает катионы водорода, электроны во внешней цепи перетекают от цинка к водороду:
Суммируя эти реакции, получим
то есть электрод с более положительным значением стандартного электродного потенциала является окислителем по отношению к электроду с менее положительным значением E °.
52.Для расстановки коэффициентов в уравнениях окислительно-восстановительных реакций используют два основных метода – электронный баланс и ионно-электронный метод (метод полуреакций).
Электронный баланс основан на схематической записи изменения степеней окисления окислителя и восстановителя по отдельности и уравнивания числа переданных электронов. Например, для реакции описываемой схемой
NH3 + O2  N2 + H 2O
N2 + H 2O
сначала определяем элементы, меняющие свои степени окисления. В левой у азота степень окисления -3, в правой – 0. Азот повышает свою степень окисления и является восстановителем.
N-3  N0
N0
В ходе реакции элемент азот окисляется и, следовательно, отдает электроны. Для того, чтобы выполнялся закон сохранения заряда, один азот должен отдать три электрона:
N-3 - 3е  N0
N0
С учетом того, что в правой части схемы записана молекула азота, удваиваем все коэффициенты:
2N-3 - 6е  N20
N20
В левой части кислород имеет степень окисления 0, в правой -2, т. е. понижает свою степень окисления и в данной реакции является окислителелем:
О0  О-2
О-2
Для этого атому кислорода необходимы два электрона:
О0 + 2е  О-2
О-2

С учeтом того, что в реакции участвует молекулярный кислород, окончательно для кислорода получим:
О20 + 4е  2O-2
2O-2
Запишем процессы окисления и восстановления в одну схему:
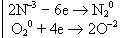
Число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем, поэтому домножаем обе полуреакции на коэффициенты, которые доводят число электронов в каждом процессе до наименьшего общего кратного. Этот коэффициент для первой полуреакции равен 2, для второй - 3, при этом число электронов в обоих полуреакциях будет по 12:
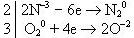
Из полученной схемы следует, что в левой части должно быть 4 атома азота в степени окисления -3, следовательно у аммиака коэффициент равен 4, в правой части будет две молекулы азота. В левой части коэффициент у молекулярного кислорода равен 3, в правой части должно быть 6 атомов кислорода в степени окисления -2. Получаем уравнение:
4NH3 + 3O2 = 2N2 + 6H2O
Проверяем число атомов водорода в обеих частях - в левой 12 и в правой 12.
Метод электронного баланса применяется для составления уравнений окислительно восстановительных реакций, протекающих в газовой или твердой фазе, если реакция протекает в растворе или расплаве с участием электролитов, то используется метод электронно-ионного баланса (метод полуреакций).
Активность твердого вещества (a тв) принимается равной единице, поэтому в случае рассматриваемого нами металлического электрода (a M) уравнение Нернста упрощается:
Потенциал электрода, как видно из этого уравнения, зависит от активности ионов 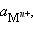 которые являются потенциалопределяющими. Разность потенциалов стандартного водородного электрода и какого-нибудь другого электрода, измеренная при стандартных условиях, называется стандартным электродным потенциалом и обозначается E °.
которые являются потенциалопределяющими. Разность потенциалов стандартного водородного электрода и какого-нибудь другого электрода, измеренная при стандартных условиях, называется стандартным электродным потенциалом и обозначается E °.
Следует подчеркнуть, что:
Уравнение Нернста отдельного электрода условились писать для процесса восстановления независимо от того, в какую сторону сдвинуто равновесие, то есть под знаком логарифма в уравнении Нернста в числителе стоит окисленная форма реагента, в знаменателе – восстановленная.
В дробном индексе при E и E ° над чертой ставится окисленная форма полуэлемента, под чертой – восстановленная.
Активности твердых веществ в уравнение Нернста не входят.
52. Комплексные соединения (лат. complexus — сочетание, обхват) или координационные соединения (лат. co — «вместе» и ordinatio — «упорядочение») — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.
В молекуле любого комплексного соединения один из ионов, обычно положительно заряженный, занимает центральное место и называетсякомплексообразователем (центральным ионом). Вокруг него в непосредственной близости расположено (координировано) некоторое число противоположно заряженных ионов или нейтральных молекул, называемых лигандами и образующих внутреннюю координационную сферу. Остальные ионы находятся на более далеком расстоянии от центрального иона и составляют внешнюю координационную сферу.
Количество лигандов, окружающих центральный ион, называется координационным числом.
Внутренняя сфера комплекса в значительной степени сохраняет стабильность в растворе (ее границы в формуле показывают квадратными скобками). Ионы внешней сферы в растворе легко отщепляются.
Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с лигандами, или координационное число (КЧ). Эта характеристика комплексообразователя определяется главным образом строением его электронной оболочки и обусловливается валентными возможностями центрального атома или условного иона-комплексообразователя (подробнее см. >>>).
Когда комплексообразователь координирует монодентатные лиганды, то координационное число равно числу присоединяемых лигандов. А число присоединяемых к комплексообразователю полидентатных лигандов всегда меньше значения координационного числа.
Между значениями координационного числа и степенью окисления элемента-комплексообразователя существует определенная зависимость. Так, для элементов-комплексообразователей, имеющих степень окисления +I (AgI, CuI, AuI, II и др.) наиболее характерно координационное число 2 – например, в комплексах типа [Ag(NH3)2]+, [Cu(CN)2]-, [IBr2]-.
Элементы-комплексообразователи со степенью окисления +II (ZnII, PtII, PdII, CuII и др.) часто образуют комплексы, в которых проявляют координационное число 4, такие как [Zn(NH3)4]2+, [PtCl4]2-, [Pd(NH3)2Cl2]0,[ZnI4]2-, [Cu(NH3)4]2+.
В аквакомплексах координационное число комплексообразователя в степени окисления +II чаще всего равно 6: [Fe(H2O)6]2+, [Mg(H2O)6]2+, [Ni(H2O)6]2+.
Элементы-комплексообразователи, обладающие степенью окисления +III и +IV (PtIV, AlIII, CoIII, CrIII, FeIII), имеют в комплексах, как правило, КЧ 6.
Например, [Co(NH3)6]3+, [Cr(OH)6]3-, [PtCl6]2-, [AlF6]3-, [Fe(CN)6]3-.
Известны комплексообразователи, которые обладают практически постоянным координационным числом в комплексах разных типов. Таковы кобальт(III), хром(III) или платина(IV) с КЧ 6 и бор(III), платина(II), палладий(II), золото(III) с КЧ 4. Тем не менее большинство комплексообразователей имеет переменное координационное число. Например, для алюминия(III) возможны КЧ 4 и КЧ 6 в комплексах [Al(OH)4]- и[Al(H2O)2(OH)4]-.
Координационные числа 3, 5, 7, 8 и 9 встречаются сравнительно редко. Есть всего несколько соединений, в которых КЧ равно 12 – например, таких как K9[Bi(NCS)12].
Заряд комлексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов.
53. По заряду комплекса
1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
[(Zn(NH3)4)]Cl2 — хлорид тетраамминцинка(II)
[Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II)
2) Анионные комплексы: в роли комплексообразователя выступает атом с положительной степенью окисления, а лигандами являются простые или сложные анионы.
K2[BeF4] — тетрафторобериллат(II) калия
Li[AlH4] — тетрагидридоалюминат(III) лития
K3[Fe(CN)6] — гексацианоферрат(III) калия
3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.
[Ni(CO)4] — тетракарбонилникель
[Pt(NH3)2Cl2] — дихлородиамминплатина(II)





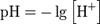

 (раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)

 (раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)

 (равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
Образование кислых и основных солей имеет большое значение при объяснении процессов гидролиза (см. § 6, гл. [1]
Их ступенчатая диссоциация обусловливает образование кислых и основных солей. [2]
Ступенчатость диссоциации обусловливает возможность образования кислых и основных солей. [3]
Ступенчатая диссоциация обусловливает возможность образования кислых и основных солей. [4]
Ступенчатость диссоциации обусловливает возможность образования кислых и основных солей. [5]
Ступенчатость диссоциации кислот и оснований обусловливает возможность образования кислых и основных солей. Известны электролиты, которые при диссоциации образуют и ионы водорода и ионы гидроксила. Такие соединения называются амфотерными электролитами.
____________________________________________________________
48.константу гидролиза можно выразить через:
Kw-ионное произведение воды
Kg-константа диссоциации
49.Окисли́тельно-восстанови́тельные реа́кции, ОВР,— это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
В зависимости от того, находятся ли атомы, выполняющие в реакции функцию окислителя (акцептора электронов) и восстановителя (донора электронов) в одном или в различных веществах, все окислительно-восстановительные процессы можно разделить на три типа: межмолекулярные, внутримолекулярные и диспропорционирования.
В межмолекулярных (межатомных) реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например, в реакции H2S + Cl2 = S + 2HCl электроны от восстановителя – молекулы сероводорода – переходят к окислителю – молекуле Cl2.
В реакциях внутримолекулярного окисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества:
(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален. См. также Электролитическая диссоциация.
Образование кислых и основных солей имеет большое значение при объяснении процессов гидролиза (см. § 6, гл. [1]
Их ступенчатая диссоциация обусловливает образование кислых и основных солей. [2]
Ступенчатость диссоциации обусловливает возможность образования кислых и основных солей. [3]
Ступенчатая диссоциация обусловливает возможность образования кислых и основных солей. [4]
Ступенчатость диссоциации обусловливает возможность образования кислых и основных солей. [5]
Ступенчатость диссоциации кислот и оснований обусловливает возможность образования кислых и основных солей. Известны электролиты, которые при диссоциации образуют и ионы водорода и ионы гидроксила. Такие соединения называются амфотерными электролитами.
____________________________________________________________
48.константу гидролиза можно выразить через:
Kw-ионное произведение воды
Kg-константа диссоциации
49.Окисли́тельно-восстанови́тельные реа́кции, ОВР,— это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
В зависимости от того, находятся ли атомы, выполняющие в реакции функцию окислителя (акцептора электронов) и восстановителя (донора электронов) в одном или в различных веществах, все окислительно-восстановительные процессы можно разделить на три типа: межмолекулярные, внутримолекулярные и диспропорционирования.
В межмолекулярных (межатомных) реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например, в реакции H2S + Cl2 = S + 2HCl электроны от восстановителя – молекулы сероводорода – переходят к окислителю – молекуле Cl2.
В реакциях внутримолекулярного окисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества:

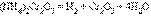



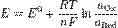 ,
,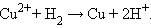


 N2 + H 2O
N2 + H 2O
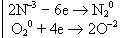
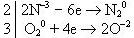
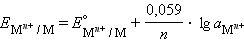
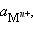 которые являются потенциалопределяющими. Разность потенциалов стандартного водородного электрода и какого-нибудь другого электрода, измеренная при стандартных условиях, называется стандартным электродным потенциалом и обозначается E °.
которые являются потенциалопределяющими. Разность потенциалов стандартного водородного электрода и какого-нибудь другого электрода, измеренная при стандартных условиях, называется стандартным электродным потенциалом и обозначается E °.


