Работа 4. МЕТОДЫ ОПРЕДЕЛЕНИЯ ВЕЛИЧИНЫ ЕСТЕСТВЕННОЙ
КОРМОВОЙ БАЗЫ
Цель работы. Познакомить студентов в кормовыми объектами рыб, научить различать основные группы гидробионтов. Познакомить с методиками взятия проб зоопланктона и бентоса, их обработкой и определением прогнозной естественной рыбопродуктивности прудов по этим группам гидробионтов.
Материалы и оборудование. Фиксированные сборы зоопланктона и бентоса. Планктонная сеть Апштейна, определители, бинокулярные лупы, камеры Богорова, поршневые пипетки, пинцеты, дночерпатель, сачок - промывалка, чашки Петри.
Основные сведения. В прудах рыба питается разнообразной пищей. Различают естественную кормовую пищу (растительные и животные организмы) и вносимую в водоем (корма растительного и животного происхождения). На основе потребляемой рыбами пищи в водоеме образуется рыбная продукция, которую принято делить на общую и естественную. Общая рыбопродуктивность включает в себя продукцию, полученную и за счет корма, вносимого в водоем, и за счет естественной пищи.
|

|
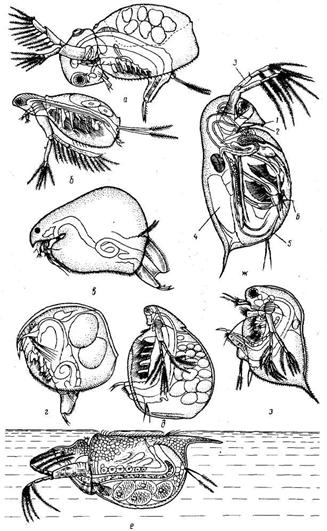
| Рис.14. Представители зоопланкотона (самки):
а - Sida crystalline; б — Diaphanosoma (brachyurum); в -Eurycercus lamellatus г - Chydorus ovaks; д - Simocephalus vetulus; е — Scapholeberis mucronata; ж — Daphnia pulex (1- рот, 2- глотка, 3- антенны, 4-яйцевая камера, 5- постабдомен, 6-гоготок постабдомена); з –Ceriodaphnia sp., k -Eudiaptomus gracffis; и — Cyclops sp.
|
Естественная пища должна быть неотъемлемой частью пищевого рациона рыб, что обязывает специалистов вести постоянные наблюдения за развитием естественной кормовой базы, так как от её количества зависит усвоение вносимых в водоем кормов. Под естественной кормовой базой понимают развитие организмов планктона, бентоса, нектона и высших водных растений.
Планктон представляет собой совокупность растительных (фитопланктон) и животных (зоопланктон) организмов, обитающих в толще воде и находящихся в состоянии парения (рис.14). Лишь немногие представители планктона временно используют субстрат в качестве опоры. Характерная черта планктонных организмов – полное отсутствие или незначительное развитие органов движения.
Поэтому планктонные организмы не способны противостоять движению воды и пассивно увлекаются волнами и течением. Для поддержания
наплаву, например, представители фитопланктона в клетках имеют воздушные или жировые капельки. Представители зоопланктона снабжены двигательными ресничками, ножками, антеннами.

|
| Рис.15. Представители бентоса:
а - личинка вислокрылки Sialis; б - личинка поденки Siphlurella; в - личинка поденки Heptogenia; г - личинка поденки Palingenia; д — личинка ручейника Phryganea striata; e — личинка ручейника Hydropsyche; ж — Metamysis; з - Ancylus fluviatflis (1 - вид сбоку, 2 - сверху)
|
Планктон - важная часть рациона многих рыб, а у некоторых он составляет основу пищевого комка. Например, у белого толстолобика фитопланктон составляет 35-98% рациона. Пелядь питается в основном зоопланктоном. Кормовая ценность планктонных организмов велика. Белки их по аминокислотному составу полноценны, что очень важно для развития и роста рыб. Наиболее полноценными пищевыми организмами являются ветвистоусые рачки, и прежде всего дафнии. Они богаты минеральными солями, витаминами, незаменимыми аминокислотами.
Бентос - это совокупность организмов, обитающих на дне водоема (рис.15). Они находятся на поверхности дна, закапываются в ил, некоторые периодически могут отрываться от дна. К бентосным организмам относят червей, например, трубочника, личинок насекомых, в частности, хирономид или мотыля, моллюсков и других животных. К бентосу относят и водные растения (фитобентос), крепящиеся корнями ко дну водоемов.
Значение бентоса в питании рыб значительно. Большинство мирных рыб питаются зообентосом, а, например, белый амур – фитобентосом. Кормовое значение бентоса велико. Белки зообентоса по аминокислотному составу полноценны.
При снижении количества зоопланктона и зообентоса необходимо принимать экстренные меры по их увеличению. При выращивании разновозрастных рыб важно знать, какие организмы являются преобладающими в том или ином водоеме, так как не все виды могут быть кормовыми для рыб. Для личинок в первые дни жизни предпочтительнее массовое развитие мелких форм зоопланктона (босмины, коловратки, личинки веслоногих и ветвистоусых ракообразных). Их количество более 1000 экз/л свидетельствует о хорошей обеспеченности пищевых потребностей личинок рыб. Если в первые дни жизни личинок рыб в зоопланктоне прудов в значительном количестве представлены хищные виды, такие как циклопы, лептостеридии, стрептоцефалюсы, щитни, то возможно выедание личинок рыб этими хищниками. Молодь карпа массой более 1 г способна потреблять бентосные организмы.
Зная особенности питания рыб на разных этапах развития, можно создавать условия для массового развития тех или иных групп кормовых гидробионтов. Установлено, что для рыб массой более 10 – 20 г количество естественной пищи в пищевом комке должно быть не менее 25 – 30%. Для этого среднесезонная биомасса фитопланктона должна быть не менее 30 мг/л, зоопланктона – не менее 8 – 12 г/м3 , зообентоса – 3 – 5 г/м2. Для определения таких показателей важно проводить регулярное изучение развития зоопланктона и зообентоса.
Сбор и обработка зоопланктона

| |
| |
| Рис.16. Приспособления для отбора проб зоопланктона
а - сеть Апштейна; б - сеть Липина в закрытом; в — цилиндрическая сеть "Цеппелин".
| |
Для учета кормовой базы рыбохозяйственных водоемов не реже одного раза в месяц берут пробы зоопланктона. Затем в условиях лаборатории проводят анализ численности и определяют биомассу гидробионтов. Методов взятия проб зоопланктона и их обработки много, но не все они применимы в прудовых условиях.
В прудовых хозяйствах для взятия проб зоопланктона применяют планктонную сеть Апштейна. Она представляет собой усеченный конус, выполненный из мельничного газа различной плотности, чаще выше 38 – 42-го номера. На широком конце конуса укреплено кольцо диаметром 25 – 30 см, а на узком – стаканчик для концентрации зоопланктона. Длина сетки 55 – 100 см (рис. 16). Технология взятия проб зоопланктона проста. На водоеме устанавливают места (станции), где регулярно берут пробы зоопланктона. Число их зависит от величины водоёма. На каждой станции через планктонную сеть пропускают 50 л воды. В стаканчике концентрируются пойманные гидробионты. Его содержимое сливают в склянку и консервируют 4%-м раствором формалина. Склянку плотно закрывают и снабжают этикеткой с указанием названия водоема, номера станции, даты и глубины взятия пробы.
В лаборатории производят определение собранных видов и их численность. Для этого используют камеру Богорова и поршневую пипетку (рис.17). Из склянки, после тщательного, но осторожного перемешивания, поршневой пипеткой берут 1 мл ее содержимого и помещают в камеру Богорова. С помощью определителей и бинокулярной лупы подсчитывают, каких и сколько организмов находилось в 1 мл фильтра а для точности просчитывают 2 – 4 порции. Количество организмов в 1 м3 определяют по формуле:
 ,
,
где х – количество данного организма в 1 мл; у – объем профильтрованной пробы, мл; n – количество литров профильтрованной воды; 1000 – коэффициент пересчета на 1 м3

| 
| |
| Рис.17. Приборы для взятия порций планктона:
а - штемпель-пипетка Гензена; б —штемпель-пипетка Самышева; в - камера Богорова
| |
|
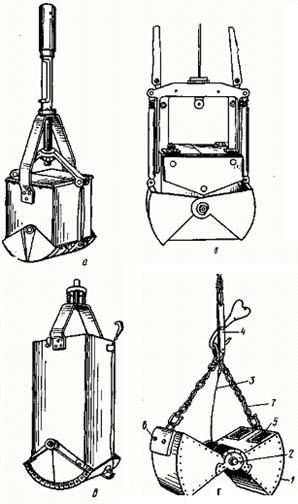
Рис.18. Орудия для количественного учета зообентоса:
а – штанговый беспружинный дночерпатель; б – дночерпатель Экмана-Берджа (модификация Института биологии внутренних вод) в открытом виде; в - дночерпатель Боруцкого в закрытом виде; г – ковшовый дночерпатель в открытом виде: 1 – ковш, 2 – скрепляющая ось, 3 – замыкающий тросик, 4 – замыкающее приспособление, 5 – отверстия с латунными сетками, 6 – свинцовые или чугунные пластины для утяжеления прибора, 7 – цепь.
| |
Для пересчета количества организмов зоопланктона в биомассу находят по таблицам стандартную массу одной особи каждого вида зоопланктона и перемножают на его численность в 1 м3. Полученные результаты. Данные таблиц рассчитаны Ф.Д.Мордухай – Болтовским и другими гидробиологами (прил. 2)
Сбор и обработка зообентоса
Специальными орудиями для количественного сбора зообентоса служат дночерпатели различных конструкций. Все дночерпатели можно разделить на две группы: штанговые и тросовые.
Штанговые дночерпатели имеют прямоугольную или цилиндрическую форму. В верхней их части имеется приспособление для крепления штанги (шест) из дюралевой трубки или дерева (рис. 18). Используют такие дночерпатели в водоемах с относительно плотным грунтом (песчаным или глинистым) и небольшими глубинами.
В глубоких водоемах с илистым дном применяют тросовые дночерпатели. Модификаций их довольно много. Наиболее практичен ковшовый дночерпатель, который имеет два изогнутых глубоких ковша, вращающихся на скрепляющей их оси. Тросиком ковши соединяются с замыкающим приспособлением. Опущенные на дно водоема ковши замыкаются и соскребают грунт с определенной площадки (до 60 см2) глубиной 5 – 7 см. В таком слое грунта находится большая часть зообентоса. Как и при взятии проб зоопланктона, дночерпателем берут пробы грунта на определенных местах (станциях) водоема, учитывая, что концентрация представителей зообентоса различна на разных глубинах.
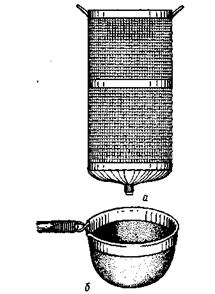
Взятую пробу грунта из дночерпателя помещают в сачок - промывалку (рис.19) и тщательно отмывают ее от иловых частиц. Промытую пробу помещают в плоскую кювету и с помощью пинцета выбирают все организмы, находящиеся в ней. После этого их или сразу определяют и учитывают, или фиксируют 10%-м растворам формалина для последующей обработки.
При обработке проб все бентосные организмы определяют с помощью определителей и рассчитывают их количество на 1 м2. Для вычисления биомассы зообентоса на 1 м2 крупные формы взвешивают по одной, а мелкие в разном количестве, но общая их масса не должна превышать 1 г. После вычисления биомассы по каждому виду или группе зообентоса суммируют полученные данные.
На основании биомассы проб зоопланктона и зообентоса можно рассчитать ориентировочную естественную рыбопродуктивность по этим группам гидробионтов. Существует несколько способов вычисления прогнозной величины естественной рыбопродуктивности прудов.
|
| Рис.19. Приборы для промывания проб бентоса:
а - вертикальное ситоЛипина; б -сачок-промывалка
|
При вычислении величины естественной рыбопродуктивности лучше пользоваться кормовыми коэффициентами. Под кормовым коэффициентом понимают количество корма, расходуемое на единицу прироста. Так, для фитопланктона он равен 50, т.е. на единицу прироста рыбы требуется 50 ед. фитопланктона. Такой же кормовой коэффициент и у высшей водной растительности. Для зоопланктона он равен в среднем 7, а для зообентоса – 6. При этом следует учитывать, что потребление естественной пищи не адекватно общей биомассе фитопланктона, или зоопланктона, или зообентоса. Часть представителей этих групп рыбой не поедается. Из общей биомассы фитопланктона рыбой используется только 40%, а зоопланктона или зообентоса – до 70%.
Пробы фитопланктона, зоопланктона или зообентоса характеризуют наличие биомассы этих групп гидробионтов на конкретной момент. Чтобы определить величину кормовой базы водоема за вегетационный период используют коэффициенты перевода биомассы проб в биопродукцию водоема (табл.1).
Таблица 1 Коэффициенты перевода биомассы проб в продукцию
гидробионтов за вегетационный период
| Группа гидробионтов
| Рыбоводная зона
|
| 1.
| 2.
| 3.
| 4.
| 5.
| 6.
|
| Фитопланктон
| 45,0
| 47,0
|
| 54,0
| 60,0
| 72,0
|
| Зоопланктон
| 12,0
| 14,0
| 16,0
| 18,0
| 20,0
| 22,0
|
| Зообентос
| 4,5
| 5,0
| 5,6
| 6,3
| 7,0
| 8,5
|
Используя эти данные и показатели проб разных групп гидробионтов, вычисляют ориентировочную естественную рыбопродуктивность конкретного водоема.
П р и м е р. В нагульном пруду первой рыбоводной зоны биомасса фитопланктона составила на 10 июня 2,0 г/м3, зоопланктона –3, зообентоса – 5 г/м2. Для приведения биомассы всех 3 групп гидробионтов к одинаковым показателям биомассу фито- и зоопланктона следует просчитать на 1 м2,т.е. удвоить, затем рассчитать с учетом разных коэффициентов. Для удобства все данные записывают в виде таблицы (табл.2).
Таблица 2 Вычисление биомассы, продукции гидробионтов и рыбопродуктивности
| Группа
гидробионтов
| Биомасса пробы, г/м2
| Коэффициенты перевода в биопродукцию
| Продукция
| Коэффициент потребления
| Всего потреблено, кг/га
| Кормовой коэффициент
| Рыбопродукция, кг/га
|
| г/м2
| кг/га
|
| Фитопланктон
|
|
|
|
| 0,4
|
|
| 14,5
|
| Зоопланктон
|
|
|
|
| 0,7
|
|
| 72,0
|
| Зообентос
|
| 4,5
| 22,5
|
| 0,7
| 157,5
|
| 26,2
|
| И т о го
|
|
|
|
|
|
|
| 112,7
|
Выполнение работы
1. Прочитать содержание работы.
2. Познакомиться с представителями зоопланктона и зообентоса.
3. Познакомиться с оборудованием для взятия проб зоопланктона и бентоса.
4. Выполнить расчеты по определению величины естественной рыбопродуктивности по заданию преподавателя.
Работа 5. РАЗВЕДЕНИЕ ПЛАНКТОННЫХ И БЕНТОСНЫХ ОРГАНИЗМОВ
Цель работы. Познакомить студентов с методами разведения планктонных и бентосных организмов, применяемых в прудовых карповых хозяйствах.
Материалы и оборудование. Рисунки, схемы, сборы планктона и бентоса.
Разведение планктонных организмов
Для кормления рыб разного возраста применимы как растительные, так и животные организмы. Среди растительных организмов наиболее успешным является разведение плавающей водоросли – ряски, а среди животных организмов – дафний, моин, аулофорусов.
Выращивание ряски. Различают 4 вида рясок: малая, трехдольная, многокоренниковая и горбатая. Первые три вида чаще встречаются в наших водоемах, чем горбатая.
Ряска очень быстро размножается, давая огромные урожаи зеленой массы с единицы площади водоема. Западно-сибирские малые озера за лето дают 70-80 т/га зеленой массы ряски. При регулярном сборе за лето можно получить 100-150 т сырой массы с 1 га. По некоторым данным, суточный прирост ряски составляет 10-20% от общей массы. Ряска отличается высоким содержанием протеина, количество которого выше, чем в клевере или люцерне. В среднем в ряске 21-30% протеина, в клевере - 19,5, в люцерне – 18%. Ряска содержит 1,1-6% кальция, что в 2 раза больше, чем в люцерне, и 0,46-2,28% фосфора, что в 3 раза больше, чем в люцерне. Соотношение кальция и фосфора в ряске благоприятно для животных.
Ряску используют для кормления животных, птицы и рыб. Добавка в рацион 4% ряски позволяет увеличить темпы роста, например, карпа при снижении расхода комбикорма на 24%. Добавка ряски в корм уткам в соотношении 1:2 снижает затраты корма на единицу прироста на 30-33%.
Технология выращивания ряски проста. Для этого используют мелководные хорошо прогреваемые безрыбные водоемы разной площади. Если в них ряска есть, то вносят органические и минеральные удобрения для её быстрого роста. Если окисляемость воды ниже 15-20 мг/л, то вносят навоз крупного рогатого скота, конский по 5 т/га в береговой зоне. В тех водоемах, где ряска отсутствует, предварительно вносят биомассу ряски по 100-150 г на 1 м2. Чем больше будет внесено ряски, тем быстрее накопится нужное её количество, после чего можно начинать регулярный сбор. Лучше делать сборы раз в 5 – 10 дней. Сбор ряски производят мелкоячеистыми бреднями.
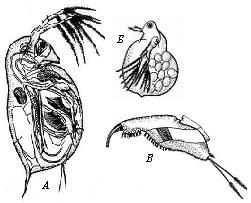
Из животных организмов наибольший интерес представляет выращивание дафний, моин (рис. 20).
|
| Рис.20. Пищевые планктонные организмы:
а - Daphnia pulex (самка); б — Moina rectirostris (самка); в— постабдомен D. Magna.
|
1. Выращивание дафний. Существует большое количество способов выращивания дафний. Все они подразделяются на два типа: выращивания дафний и их пищи в одном водоеме и раздельное выращивание дафний и их пищи. Наиболее простым и доступным является первый тип, но второй более продуктивный. По первому типу дафний выращивают в дафниевых ямах, бассейнах, садках.
Дафниевые ямы. Размер ям произвольный, но обычно 2 – 3 м2 при глубине 0,5 – 0,7 м. На дно такой ямы кладут навоз из расчета 1,5 кг/м2. Затем яму заполняют водой. Желательно брать воду не из естественного водоема. Если воду берут из естественного водоема, то ее желательно пропускать через капроновое мелкоячеистое сито. Через несколько дней, когда процессы гниения навоза утратят бурный характер, в яму вносят дафний из расчета 20 – 25 г/м3. Через 3 недели плотность дафний в отдельных участках ямы может достигать более 1 кг/м3. Каждую неделю вносят навоз по 0,75 кг/м2. Съем продукции или разовый, или раз в 3 – 4 дня до 50% всей биомассы рачков. В первом случае прокапывают от ямы канаву до водоема и по ней сливают в него все содержимое ямы. Затем яму вновь используют для выращивания дафний.
В Донрыбкомбинате организована специальная канава для выращивания дафний, снабженная электроосвещением. В вечернее время лампы загораются поочередно, и рачки постепенно скапливаются в одном месте, откуда их с помощью насоса подают в сетчатый ящик для отделения от воды. Полученную биомассу скармливают рыбам.
Выращивание дафний в бассейнах. Выращивают дафний в бассейнах примерно так же, как и в ямах. Только в этом случае используются минеральные удобрения, что позволяет поддерживать нормальные условия для дафний более продолжительное время. Бассейны устраивают разного размера, вытянутой формы, глубиной не более 0,6 м, непроточные. После заполнения водой вносят 50 г дафний на 1 м3, затем в виде раствора 35 – 40 г аммиачной селитры и 32 г суперфосфата на 1 м3 воды. В дальнейшем удобрения добавляют через каждые 5 – 6 дней в половинном размере. После достижения наивысшей биомассы рачков ежедневный съем может составить 50 г дафний с 1 м3. Этот метод применим в небольших хозяйствах. Чаще он используется на осетровых заводах для кормления молоди рыб.
Сетчатые садки. Строят садки размером 100х60х60 см. Дно и бока обшивают капроновым ситом с ячеей 1 мм. Садки устанавливают непосредственно на водоеме. Для снижения действия волнобоя устраивают защитные приспособления. В садки помещают дафний из расчета 50 г на 1 м3, подкармливают дрожжами и вносят минеральные удобрения. Продукты обмена рачков постоянно удаляются из садков. Взрослые особи остаются в садке, а молодь уходит из них и в водоеме развивается дальше. Происходит постоянное пополнение водоема живым кормом. В опытных садках удавалось получать суточный прирост до 300 – 600 г/м3.
Выращивание дафний в прудах. В простейшем случае рачков можно выращивать в небольшом участке водоема, отгороженном капроновой сеткой. Посадку рачков производят как можно раньше, когда другие гидробионты еще имеют небольшую численность. Рачков подкармливают дрожжами или органикой разного происхождения. При наступлении теплой погоды они начнут интенсивно размножаться. Молодь будет уходить в основную часть водоема. Часть рачков следует отлавливать и пересаживать в основной водоем. Периодически в отгороженный участок вносят органику.
Для выростных прудов И.Б. Богатовой разработан экологический способ увеличения численности дафний. Сущность метода основана на том, что в прерывистых биоценозах при заполнении пруда водой гидробионты в основном находятся в поступающей воде, но их там очень мало. Подсаживая в водоем дафний, мы создаем им благоприятные условия. Они начинают усиленно размножатся и затем своей численностью будет подавлять развитие остальных гидробионтов. Данный способ обогащения кормовой базы выростных прудов делится на 3 этапа.
П е р в ы й э т а п – получение маточной культуры дафний. Если имеется вблизи база ее культивирования, то этот этап выпадает. В других случаях чистую маточную культуру дафний приходится получать самостоятельно. Для этого из любого водоема, где имеются дафнии, отлавливают сачком зоопланктон и помещают в стеклянную банку. Из нее стеклянной трубкой отлавливают крупных особей и помещают в другую банку с чистой водой. Затем дафний снова пересаживают в следующую банку с чистой водой. Эти операции производят для получения чистой культуры дафний. Здесь рачкам дают корм и следят за их размножением. В последующем рачков помещают в большие емкости для получения не менее 100 – 200 г маточной культуры. Такие работы можно проводить как весной, так и осенью. При осенних работах рачков придется сохранять всю зиму. Начало весенних работ связано со сроками посадки рачков в пруды.
В т о р о й э т а п заключается в размножении маточной культуры. Для этого ее помещают в небольшие пруды - рыбоуловители. Желательно, чтобы в них отсутствовали покоящиеся яйца других гидробионтов. Вода в таких емкостях предварительно проходит через капроновое сито № 32 и более. Сначала заполняют небольшой участок прудика и в него вносят 100 – 200 г рачков, одновременно с кормовыми дрожжами в количестве 500 г в виде суспензии. Через несколько дней прудик заполняют водой полностью с теми же предосторожностями. Периодически вносят минеральные вещества или органику. Через 2 – 3 недели рачков в прудике будет столько, что хватит для заселения выростных прудов любого рыбопитомника. Работу по второму этапу приурочивают ко времени заполнения выростных прудов.
Т р е т и й э т а п начинается с заполнения выростных прудов. В начале заполняют небольшой (0,1 га) участок выростного пруда. Поступающая вода также проходят через газовый фильтр. После того, как вода отстоится, вносят рачков из расчета 200 – 250 г на 1 га выростного пруда. Можно вносить и большее количество. Посадку молоди карпа в этом случае производят через 7 – 10 дней после посадки дафний. Если используются моины, то личинок карпа сажают через 10 – 15 дней. Моин молодь карпа поедает почти сразу после вселения, а дафний через 2 – 3 недели.
Одновременно с посадкой молоди карпа в пруды вносят минеральные или органические удобрения согласно принятым в рыбоводстве методикам. Удобрение прудов при этой технологии обязательно.
Внесение 100-250 г рачков на 1 га выростного пруда позволяет осенью получать дополнительно с каждого гектара по 200-300 кг сеголетков.







 ,
,






