

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Оснащения врачебно-сестринской бригады.
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности...
Интересное:
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Работа 3. ОПРЕДЕЛЕНИЕ РАСТВОРЕННОГО В ВОДЕ КИСЛОРОДА
Содержание кислорода в воде ниже по сравнению с воздушной средой и подвержено большим колебаниям. Рыбы различаются по требовательности к концентрации его в воде. Снижение содержания кислорода ниже оптимального уровня для определенного вида рыб ведет к отказу от пищи, снижению темпа роста, а при очень низком содержании даже к гибели. Кислород поступает в воду из воздуха и в результате фотосинтеза водных растений. Потребителей его в воде очень много. Это донные иловые отложения, бактериопланктон, растительные организмы в ночное время. На дыхание рыб расходуется до 5% всего кислорода, содержащегося в воде. Это создает напряженные условия жизни рыб в прудах, поэтому для получения высокой продуктивности необходимо знать содержание в воде кислорода.
Цель работы. Научить студентов определять содержание кислорода в воде химическим методом (по Винклеру) и с помощью специальных приборов (термооксиметров).
Материалы и оборудование. Батометр (прибор для взятия пробы воды из водоема с определенной глубины), штатив, кислородные склянки (по две на каждую пробу) емкостью 50-150 мл, пипетки 1 и 5 мл, конические колбы на 100-150 мл, бюретки, мерные цилиндры, чашки для слива реактивов из бюретки, термооксиметр.
Реактивы и их подготовка
1. Сантинормальный раствор (0,01N) гипосульфита (Na2S2O3). Отвешивают 2,5 г гипосульфита, помещают в колбу на 1 л, добавляют небольшое количество дистиллированной воды, растворяют соль, затем объем доводят до 1 л.
2. Сантинормальный раствор (0,01N) йодовато-кислого калия (KJO3), Отвешивают 0,3567 йодовато-кислого калия, помещают в колбу на 1 л, растворяют в небольшом количестве дистиллированной воды и затем объем доводит до 1 л. Раствор готовят особо тщательно.
|
|
3. 32%-й раствор едкого натрия (NaOH). Отвешивают 32 г едкого натрия и растворяют в 100 мл дистиллированной воды. Затем в полученный раствор добавляют 10 г сухого йодистого калия (KI).
4. 40%-й раствор хлористого марганца (MnCl2). 40 г хлористого марганца растворяют в 100 мл дистиллированной воды.
5. 25%-й раствор серной кислоты (H2SO 4). Раствор готовят путем добавления к трем частям дистиллированной воды одной части концентрированной серной кислоты.
6. 1%-й раствор крахмала. На плитке доводят до кипения 100 мл дистиллированной воды, добавляют 1 г крахмала, предварительно растворив его в небольшом количестве холодной воды. Кипятят несколько минут.
7. Сухой йодистый калий (KI).
Содержание работы
Работа по определению содержания в воде кислорода подразделяется на ряд операций. В хозяйстве она осуществляется как на прудах, так и в лаборатории.
Взятие пробы воды. Батометром возле дна берут пробу воды и разливают в две кислородные склянки. Склянки наполняют доверху, осторожно, не допуская перемешивания в них воды. Пробкой не закрывают.
Фиксация пробы. После наполнения склянки водой немедленно фиксируют растворенный в ней кислород. Для этого в склянку добавляют по 1 мл 32%-го раствора едкого натрия и 40%-го раствора хлористого марганца. При этом пипетку опускают на дно склянки и затем осторожно поднимают к поверхности. Выдувать раствор нельзя. Прилитые растворы реагируют между собой. Образуется гидрат закиси марганца, который взаимодействует с растворенным в воде кислородом. В результате образуется гидрат окиси марганца в виде хлопьевидного осадка. После прилития растворов склянку закрывают пробкой. Следят за тем, чтобы под пробкой не было пузырьков воздуха. Склянку осторожно переворачивают до полного перемешивания в ней содержимого.
2MnCl2 + 4NaOH = 2 Mn(OH)2 + 4 NaCl
Mn (OH)2 + O + H2O = Mn (OH)3
Фиксацию пробы воды проводят непосредственно на прудах. После фиксации пробы её можно хранить в темном и прохладном помещении до 2 дней.
|
|
Титрование пробы. Через 15-20 минут после фиксации пробы воды и полного оседания осадка на дно склянки ее открывают и осторожно приливают 3 мл раствора серной кислоты. Чтобы осадок не поднимался, пипетку осторожно опускают на дно склянки и осторожно поднимают к поверхности. Выдувать содержимое пипетки нельзя. Затем склянку закрывают, а содержимое перемешивают. Кислота взаимодействует с гидратом окиси марганца и йодистым калием. В результате выделяется свободный йод.
2Mn (OH)3 + 2KI + 3 H2SO4 = K2SO4 + 2MnSO4 + 6H2O +2I
Причем йода выделяется столько, сколько было в пробе кислорода. После растворения осадка берут 50 мл содержимого склянки и переливают в коническую колбу. Из бюретки по каплям добавляют раствор гипосульфита. С начала содержимое колбы титруют до бледно-желтого цвета.
2I + 2Na2S2O3 = Na2S4O6 + 2NaI
Для установления точного конца реакции в колбу добавляют 1 мл раствора крахмала. Жидкость синеет от наличия в пробе йода. Затем снова по каплям титруют пробу раствором гипосульфита до обесцвечивания. В этом случае крахмал служит индикатором, показывающим конец реакции.
Количество кислорода, содержащегося в пробе воды, определяют по формуле
О2 = 1,6 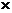 П
П 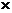 К,
К,
где О2 – количество растворенного в воде кислорода, мг/л; П – количество раствора гипосульфита, израсходованного на титрование 50 мл пробы воды, мл; К - поправка к концентрации раствора гипосульфита.
Определение поправки на нормальность гипосульфита (К). Раствор гипосульфита по мере хранения меняет свою концентрацию, поэтому каждые 10 дней определяют поправку к ней. Для этого в колбу наливают 10 мл раствора йодновато-кислого калия. Для усиления реакции добавляют 0,5 г сухого йодистого калия. Затем добавляют 3 мл раствора серной кислоты. Полученную жидкость титруют раствором гипосульфита сначала до бледно-желтого цвета, а после добавления 1 мл раствора крахмала – до обесцвечивания. Содержимое колбы в период титрования постоянно перемешивают круговыми движениями. Поправку определяют по формуле
 ,
,
где В – количество гипосульфита, израсходованного на титрование 10 мл раствора йодновато-кислого калия.
Выполнение работы
1. Прочитать содержимое работы.
2. Записать в тетрадь методику анализа.
3. Провести анализ воды на наличие кислорода в одном из аквариумов.
4. Познакомиться с методикой определения содержания кислорода при помощи термооксиметра.
|
|
|

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!