2) реакции, в которых одно и то же вещество одновременно взаимодействует с одним или несколькими реагентами, участвуя в одновременно протекающих реакциях;
3) реакции, из которых одна вызывает протекание в системе другой реакции, не осуществимой в отсутствии первой;
4) реакции, в которых продукты реакции разлагаются с образованием исходных веществ.
36. Какие реакции называются параллельными?
1) реакции, в которых продукт первой элементарной стадии вступает в реакцию второй стадии и т.д. пока не образуется конечный продукт;
2) реакции, в которых одно и то же вещество одновременно взаимодействует с одним или несколькими реагентами, участвуя в одновременно протекающих реакциях;
3) реакции, из которых одна вызывает протекание в системе другой реакции, не осуществимой в отсутствии первой;
4) реакции, в которых продукты реакции разлагаются с образованием исходных веществ.
37. Скорость параллельных реакций определяется:
1) скоростью самой медленной стадии;
2) разностью скоростей всех стадий;
3) суммой скоростей всех стадий;
4) скоростью самой быстрой стадии.
38. Реакции, в которых продукт первой элементарной стадии вступает в реакцию второй стадии и т.д. пока не образует конечный продукт называется:
1) параллельными;
2) последовательными;
3) сопряженными;
4) конкурирующими.
39. Реакции, в которых одно и то же вещество одновременно взаимодействует с одним или несколькими реагентами, участвуя в одновременно протекающих реакциях называют:
1) параллельными;
2) последовательными;
3) сопряженными;
4) конкурирующими.
40. Экспериментально установлено, что кинетическое уравнение реакции: 2 NO (г)+ О2(г)→2NO2(г) имеет вид u = kc2(NO)c(О2)
1) реакция является тримолекулярной;
2) реакция протекает в одну стадию;
3) реакция имеет третий порядок;
4) реакция идет первый порядок как по кислороду, так и по монооксиду азота.
41. С ростом температуры увеличивается скорость реакций:
1) экзотермических;
2) экзо- и эндотермических;
3) эндотермических;
4) обратимых.
42. К какому типу реакции относятся реакции гидролиза бедков?
1) последовательные;
2) параллельные;
3) сопряженные;
4) простые.
43. Процесс окисления глюкозы в организме – это: а) совокупность последовательных реакций, б) совокупность последовательно-параллельных реакций, в) экзэргонический процесс, г) эндэргонический процесс.
1) а, б, в, г;
2) б, в;
3) а, б, г;
4) а, б, в;
44. Как формулируется правило Вант-Гоффа?
1) при повышении температуры на 10 градусов скорость химической реакции увеличивается в 2-4 раза;
2) для большинства химических реакций скорость реакции увеличивается с ростом температуры;
3) скорость реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные их стехиометрическим коэффициентам реакции;
4) при понижении температуры на 10 градусов скорость химической реакции увеличивается в 2-4 раза.
45. при повышении температуры на каждые 10 градусов скорость большинства реакций:
1) увеличивается в 2-4 раза;
2) не изменяется;
3) уменьшается в 2-4 раза;
4) увеличивается в 7-8 раз.
46. Укажите возможные значения температурного коэффициента скорости реакций, протекающих в живых организмах:
1) 2-4;
2) 7-9;
3) больше 9;
4) меньше 2.
47. Увеличение скорости реакции с повышением температуры вызывается главным образом:
1) увеличением средней кинетической энергии молекул;
2) возрастанием числа активных молекул;
3) ростом числа столкновений;
4) уменьшением энергии активации реакции.
48. Каковы причины влияния температуры на скорость реакции?
1) изменение концентрации реагирующих веществ вследствие теплового расширения или сжатия жидкости;
2) температурная зависимость константы скорости;
3) изменение энергии активации при изменении температуры;
4) возрастания числа активных молекул.
49. Укажите правило Вант-Гоффа о температурной зависимости скорости реакции:
1) υ 2=υ1g∆t\10;
2) K = A e-Ea\RT;
3)  =K CaCb;
=K CaCb;
4)  = ±
= ± 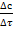 ;
;
50. Укажите уравнение Аррениуса о температурной зависимости скорости реакции:
1)  = γ;
= γ;
2) K = A e-Ea\RT;
3)  =K CaCb;
=K CaCb;
4) υ 2=υ1g∆t\10.
51. Если константа скорости одной реакции (к) больше константы скорости второй реакции (к*), то такое соотношение между энергиями активации этих реакций:
1) Еа › Еа*;
2) Еа ‹ Еа*;
3) нельзя определить;
4) Еа ›› Еа*;
52. Если прямая реакция экзотермична, а обратная эндотермична, то какая из них характеризуется более высоким значением энергии активации?
1) прямая;
2) обратная.
53. Как можно увеличить скорость реакции синтеза аммиака N2(г)+3H2(г)↔2NH3(г), ∆Н‹0?а) повысить температуру, б) уменьшить концентрацию азота, в) увеличить давление, г) уменьшить объем реакционной смеси:
1) а, в;
2) а, в, г;
3) а, б;
4) в, г.
54. Чем объяснить повышение скорости реакции при введении в систему катализатора? а) уменьшением энергии активации, б) увеличением средней кинетической энергии молекул, в) возрастанием числа столкновений, г) ростом числа активных молекул.
1) а, г;
2) а, в, г;
3) а, б, в, г;
4) в, г;
55. действие катализатора на скорость химической реакции объясняется:
1) возникновением активированных комплексов;
2) увеличением числа столкновений;
3) возникновением активированных комплексов и изменением энергии активации;
4) изменением энергии активации.
56. Чем обусловлено ускоряющее действие катализаторов?
1) существенным уменьшением энергии активации соответствующего превращения;
2) существенным увеличением энергии активации соответствующего превращения;
3) образованием активированного комплекса;
4) существенным увеличением числа столкновений.
57. Действие ферментов: а) изменяет тепловой эффект реакции, б) снижает энергию активации, в) увеличивает скорости прямой и обратной реакций, г) является избирательным.
1) а, б, в, г;
2) б, в, г;
3) б, г;
4) а, б, г.
58. Действие катализаторов: а) а) изменяет тепловой эффект реакции, б) снижает энергию активации, в) увеличивает скорости прямой и обратной реакций, г) является избирательным.
1) а, б, в, г;
2) б, в, г;
3) б, г;
4) б, в;
59. При действии ферментов: а) снижается энергия активации, б) увеличивается скорость прямой и обратной реакций, в) изменяется тепловой эффект реакции, г увеличивается скорость только прямой реакции.
1) а, б, в;
2) а, б;
3) б, в;
4) а, г;
60. чем объясняется повышение скорости биохимической реакции при введении в систему фермента: а) уменьшением энергии активации, б) увеличением средней кинетической энергии молекул, в) ростом числа активных молекул, г) уменьшением числа столкновений молекул.
1) а, в;
2) а, б, в, г;
3) б, в;
4) а, в, г.
БИОГЕННЫЕ ЭЛЕМЕНТЫ. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ. ХИМИЧЕСКИЕ ОСНОВЫ ЭКОЛОГИЧЕСКИХ ПРОБЛЕМ.
Строение атома, химическая связь, свойства элементов и их соединений
1. К элементарным частицам относятся: а) атомы; б) молекулы; в) протоны; г) электроны; д) ядра атомов 4)в,г
2. Выберите правильное утверждение: у изотопов элемента одинаково: а) число нейтронов; б)число протонов; в) число электронов; г) массовое число; д) атомная масса; е) порядковый номер 1)б, в, е;
3. Расположите частицы по увеличению уровня химической организации вещества: а) е, 14N,SO42-, NaClкрист., б) атом, молекула, молекулярный кристалл; в) молекула, атом, элементарная частица; г) SO42-, NaClкрист, атом азота, протон. 1)а,б;
4. Принцип наименьшей энергии справедлив для атома: а) в основном состоянии; б) в возбужденном состоянии; в) в основном и возбужденном состоянии; г) имеющего минимальную энергию. 2) а.г
5. В какой последовательности в многоэлектронном атоме заполняются энергетические подуровни: а) 2p3s3p3d; б) 2p3s3p4s3d; г) 4s4p4d4f: 2) б,в
6. Какие значения принимает магнитное квантовое число для орбиталей d – подуровня? 2)-2, -1, 0, +1, +2;
7. Чему равно число орбиталей на р- уровне? 3)3;
8. Как обозначается подуровень, для которого n=4, l=0? 4)4s.
9. Какое квантовое число характеризует размер электронного облака? 1)n;
10. Чем меньше энергия ионизации, тем: а) атом легче отдаёт электрон; б) атом труднее отдает электрон; в) сильнее металлические свойства; г) слабее металлические свойства. 3)а, в;
11. Какие из электронных конфигураций соответствуют элементам, проявляющим высшую степень окисления +5: а) 3d54s2; б) 3s23p5; в) 3s23p3; г) 3d34s2; д) 4s24p3; е) 3d54s1. 3)в, г, д
12. Какова электронная конфигурация атома олова Sn? 1)[Kr] 4d105s25p2
13. Распределение электронов в атомах подчиняется: а) принципу минимума энергии; б) принципу Паули; в) правилу Гунда; г)правилу Клечковского. а, б, в, г
14. Предложенная формулировка: Электроны в невозбужденном атоме распределяются по энергетическим уровням так, чтобы их суммарная энергия была минимальна – это: принцип минимума энергии;
15. Назовите элемент с формирующим 4d2-электроном Zr;
16. Электроны принадлежат р -подуровню 4-го энергетического уровня. Чему равны значения главного и орбитального квантовых чисел для этих электронов? n=4; l=1;
17. Выберите правильное утверждение: а) масса молекулы О2 равна 32 г; б) 1 моль молекул кислорода имеет массу 32 г; в) 1 моль атомов кислорода имеет массу 16 г; г) масса молекулы О2 равна 5,3∙10-23 г. б, в, г;
18. Назовите элемент, атом которого имеет в основном состояние 3 неспаренных электрона на 4 р -подуровне: As;
19. Назовите элемент 4-го периода с максимальным числом неспаренных электронов. Cr;
20. На основании электронного строения атомы серы определите число электронов, принимающих участие: а) в восстановлении; б) в окислении. а-2; б-6;
21. Какое квантовое число характеризует направление электронного облака в пространстве? m;
22. Простой ион, имеющий в своем составе 18 и 16 протонов, имеет заряд ядра, равный :+16;
23. Какой атом наиболее сильный окислитель? …2 s2p5;
24. Каково строение внешнего энергетического уровня s- элементов? ns1-2;
25. Каково строение внешнего энергетического уровня р-элементов? ns2np1-6;
26. Какова электронная формула валентных электронов d-элементов? (n- 1 ) d1-10ns1-2;
27. Выберите ряд элементов, состоящих только из:
a) d- элементов: б) p-элементов:
а) Ge, Ti, Zn, Sn, Si б) Si, As, S, Te, Kr
в) La, Ge, Zr, V, Co г) La, Zn, Zr, V, Co
1) а)-г, б)-б;
28. d-элементы – это: металлы;
29. Какой из частиц соответствует электронная формула 1s22s22p63s23p6? S2-.
30. Какова электронная формула иона Zn2+? 1s22s22p63s23p63d104s0;
31. Атом какого элемента имеет электронную конфигурацию: 1s22s22p63s23p64s1? K;
32. У атома какого элемента 4-го периода на d-подуровне наибольшее число неспаренных электронов? Mn;
33. Какова формула валентных электронов атома Fe? …4s23d6;
34. Какова формула валентных валентных электронов атома Cu? …4s13d10;
35. Какова формула валентных электронов атома Cr? …4s13d5;
36. Какова формула валентных электронов атома Mn? …4s23d5;
37. Какова формула валентных электронов атома Ag? 5s14d10;
38. Сколько неспаренных электронов имеет ион Со3+? 4;
39. Какова степень окисления и валентность углерода в оксиде углерода СО? +2, III;
40. Энергия отрыва электрона от атома элемента с образованием катиона – это :энергия ионизации;
41. Энергия присоединения электрона атомом элемента с образованием аниона – это :энергия сродства к электрону;
42. Выберите правильное утверждение. В главных подгруппах ПСЭ сверху вниз: а) радиус атома увеличивается; б) сродство к электрону уменьшается; в) электроотрицательность увеличивается; г) энергия ионизации увеличивается. б, в;
43. Выберите правильную последовательность увеличения энергии ионизации у атомов элементов: Na, Al, K. K<Na<Al;
44. Энергия сродства к электрону у атомов элементов в главных подгруппах сверху вниз: уменьшается;
45. Чем больше энергия ионизация атома, тем :металлические свойства выражены слабее;
46. С увеличением относительной электроотрицательности элементов: возрастает кислотность их оксидов и гидроксидов;
47. Химическая связь, образуемая за счёт одной или нескольких электронных пар, существенно взаимодействующих с ядрами с ядрами обоих соединяемых атомов, называется: ковалентной;
49. Число общих электронных пар между соединяемыми атомами – это: кратность связи;
50. Число возможных ковылентных связей, образованных данным атомом, зависит от: a) числа неспаренных электронов на внешних энергетических уровнях у атомов в основном состоянии; б) числа неспаренных электронов на внешних энергетических уровнях у атомов в возбужденном состоянии; в) числа свободных атомных орбиталей на внешних энергетических уровнях как акцепторов электронных пар; г) наличия донорных электронных пар на внешних энергетических уровнях. а, б, в, г.
51. Ковалентные связи обычно образуются: между атомами двух неметаллов;
52. Механизм образования ковалентной связи: а) радикальный б) обменный в) донорно-акцепторный г) гетеролитический. а, б;
53. Металлическая связь характерна для металлов: а) в любом агрегатном состоянии; б) в твёрдом состоянии; в) в расплавленном состоянии; г)в газообразном состоянии. б, в;
54. Способность электронной плотности химической связи смещаться под действием внешнего электрического поля или других воздействий – это: поляризуемость связи;
55. Выберите неправильное утверждение: степень ионности связи тем выше, чем меньше разность ОЭО между соединенными атомами;
56. Чем выше электроотрицательность элементов, тем: а) сильнее выражены неметаллические свойства; б)сильнее выражены окислительные свойства; в) слабее выражены неметаллические свойства; д)слабее выражены восстановительные свойства. а, б, д;
57. Выберите правильную последовательность уменьшения атомных радиусов S, Cl и Ar:
1) S>Cl>Ar;
2) S>Ar>Cl;
3) Ar>Cl>S;(нет ответа!)
4) Ar>Cl>S.
58. Высший оксид элемента отвечает формуле ЭО3. Его водородное соединение содержит 2, 47% водорода. Этот элемент: Se;
59. Как меняется восстановительная активность в ряду Ве-Ва? увеличивается;
60. Металлический характер свойств атомов элементов в ряду: Mg-Ca-Sr-Ba: возрастает;
61. Какие элементы: C, Si, N, Se, P, V образуют летучие водородные соединения с формулой ЭН3? N, P;
62. Выберите элементы, высший оксид которых имеет формулу ЭО3: Al, Se, Sn, Cr, Cl, S, As. Se, Cr, S;
63. В ряду H2SiO3- H3SiO4 – H2SO4 – HClO4 кислотные свойства: усиливаются;
64. Выберите элемент, высший гидроксид которого является сильной кислотой :Cl;
65. Выберите последовательность элементов, записанных в порядке увеличения основного характера их высших оксидов и гидроксидов: а) Ba, Sr, Ca, Mg, Be; б) Na, Mg, Al, Si, P; в) P, Si, Al, Mg, Na; г) Be, Mg, Ca, Sr, Ba. в, г.
66. Элементы II- А группы являются: слабыми восстановителями;
67. В ряду молекул LiF4-BeF2-BF3-CF4-NF4-NF3-OF2-F2 ковалентный характер связи усиливается;
68. С атомами каких элементов характерны химические связи атомов азота в организме? с Н и С;
69. Выбрать ряд соединений, в которых есть только ковалентная полярная связь: HCl, NH3, SiH4.
70. Для Na и К наиболее характерно образование: а) ионных соединений; б) соединений с ковалентной связью; в) прочных комплексов с биолигандами; г) аквакомплексов. а, г;
71. Катионы s-элементов относятся к:«жестким» кислотам Льюиса;
72. Какая химическая связь возникает между атомами элементов с порядковыми номерами 8 и 16? ковалентная полярная;
73. Ковалентная связь, образующаяся по донорно- акцепторному механизму, присутствует в соединении: [Ag(NH3)2]Cl.
74. Укажите соединения, в которых есть ионная связь: а) HF; б) CaBr2; в) BF3; г) K[BF4]. б, г.
75. Молекула будет полярной, если: а) содержит полярные связи; б) имеет симметричную структуру; г) имеет высокие температуры плавления и кипения. а, б;
76. Укажите тип химической связи в молекуле NaCl. ионная;
77. Молекула воды имеет пространственное строение: угловое;
78. Для большинства солей характерна: ионная решетка;
79. С позиции реакционной способности соединений большую роль играет поляризуемость связей. Какая связь легче поляризуется? C=S.
80. В зависимости от способности поляризоваться атомы, молекулы, ионы подразделяют на «мягкие» и «жесткие». Выберите правильное утверждение: а) «мягкие» частицы – легкополяризуемые; б) «мягкие» частицы – малополяризуемые; в) «жесткие» частицы – легкополяризуемые; г) «жесткие» частицы – малополяризуемые. а, г;
81. Выберите правильное утверждение :чем больше поляризаемость связей, тем выше ее реакциооная способность;
82. у какого соединения полярность связи выше? H2O;
83. Выберите вещества только с ковалентным типом связи: KCl, CO2, H2O, N2, BaCl2, (H2O)n, (C2H5OH)n CO2, H2O,N2;
84. Чем больше энергии, тем: связь прочнее;
85. Укажите молекулы и ионы, в которых центральный атом находится в sp3-гибридизации: а) H2O; [AlF6]3-; в) [AlCl4]; г) ССl4; д) SF6; е) H2CO3. а, в, г, е;
86. Укажите молекулы и ионы, в которых центральный атом находится в sp3d2-гибридном состоянии: а) H2O; б) [AlF6]3-; в) [AlCl4]-; г) NH; д) H2CO3. б;
87. Водородная связь образуется между: а) молекулами воды; б) молекулами всех галогенодородов; в) группами нуклеиновых кислот, г) молекулами спиртов. а, в, г;
88. Наличие водородной связи: а) отражается на физических свойствах веществ; б) объясняет аномалии в свойствах воды; в) возможно внутри молекул; г) характерно для почти всех биохимических процессов. а, б, в, г.
89. Между какими молекулами более прочная водородная связь: H2O;
90. Гомолитическое расщепление расщепление характерно для связи: а) полярной; б) неполярной; в) малополярной; г) ионной. б, в;
91. Гетеролитический механизм характерен для расщепления ковалентной связи:
1) полярной ;(нет ответа)
2) неполярной;
3) малополярной;
4) полярность связи не имеет значения.
92. Выберите частицы, являющиеся электрофилами: а)Fe+3; б) BF3; в) CH3СОО-; г) R-COOH; д) RC=СR. а, б, г;
93. Выберите частицы, являющиеся нуклеофилами: а) Na+; б) NH; в) СN-; г) ОН-; д) Н2О; RC=СR. в, г, д, е;
94. Для какого вещества характерно образование атомной решетки? алмаз.
95. Для какого из веществ характерно образование молекулярной решетки? лед;
96. Для какого вещества характерно образование ионной решетки? иодид цезия;
97. Веществами молекулярного строения является: HCl(ТВ),S8,SiO2;
98. Какие вещества имеют молекулярную решетку: а)I2; б)CO2; в)NaCl; г) KOH;д) Si; е) SiO2. в,г,д;
99. Для атомной кристаллической решетки характерно: а) связь ковалентная; б) малая прочность; в) высокая прочность; г) растворимость в воде; д) тугоплавкость. а,в,д;
100. Почему соли CaCO3,BaSO4 практически нерасворимы в воде: а) энергия решетки больше энергии гидратации; б) многозарядные ионы прочно взаимодействуют друг с другом; в) энергия решетки меньше энергии гидратации; г) энергия решетки равна энергии гидратации. а,б.
101. В основе образования ассоциатов: фермент-кофермент, фермент-субстрат, антиген-антитело, играющих огромную роль в жизнедеятельности организмов, преимущественно лежат: а) ион-дипольные взаимодействия; б) ион-ионные взаимодействия; в) ориентационные взаимодействия; г) индукционные взаимодействия. а,б;
102. Межмолекулярные взаимодействия- это: а) силы Ван-Ваальса; б) ион-дипольные; в) ион-ионные; г) гидрофобные. все;
103. К ион-дипольным взаимодействиям относятся: Mg2++6H2O=[Mg(H2O)6]2+;
104. К ион-ионным взаимодействиям относятся: R1- + R2-COO-=R2-CO-NH-R +H2O;
105. Выберите правильное утверждение: ориентационное взаимодействие возникает между полярными молекулами, характеризуется постоянным дипольным моментом;
106. Ион-ионные взаимодействия возникают: а) между веществами с ионной кристаллической решеткой; б) в белках; в) в нуклеиновых кислотах; г) между молекулами белков и катионами металлов. а, б, в, г;
107. Выберите правильное утверждение: а)гидрофобные взаимодействия основаны на отталкивании гидрофобными группами полярных молекул воды; б) гидрофобные взаимодействия – это взаимное притяжение неполярных групп; в) гидрофобные взаимодействия повышают упорядоченность расположения частиц в системе; г) гидрофобные взаимодействия играют важную роль при формировании мицелл ПАВ в растворах и глобул из белков. а, в, г.
108. Межмолекулярные взаимодействия: а) необходимы для молекулярной гибкости и молекулярного узнавания при ферментативном катализе; б) ответственны за агрегатное состояние вещества и его превращение при изменении внешних условий; в) способствуют образованию различных видов ассоциатов из взаимодействующих частиц; г) лежат в основе процессов сорбции, образовании мицелл. а, б, в, г;
109. Укажите химические процессы: а) переваривание пищи в ЖКТ; б) ржавление железа; в) скисание молока; г) брожение глюкозы. а, б, в, г.
110. Какие процессы относятся к химическим: а) возгонка иода; б) фильтрация раствора; в) растворение газов в крови; г) горение спички; д) гликолиз. г, д.
111. Какие свойства характеризуют и молекулу, и вещество, состоящее их этих молекул: а) агрегатное состояние; б) электрическая проводимость; в) состав; г) химические свойства. в, г;
112. Как изменяется химическая активность щелочных металлов с ростом порядкового номера элемента? увеличивается;
113. Выберите справедливое утверждение: а) все щелочные металлы имеют отрицательный стандартный ОВ - потенциал; б) все щелочные металлы – сильные восстановители; в) Na и Li по своим свойствам отличаются от других щелочных металлов; г) энергия ионизации от Li к Cs уменьшается. а, б, в, г;
114. Выберите неправильное утверждение: а) водород – самый легкий из всех газов; б) водород очень активен, даже при комнатной температуре; в) водород в ОВР может быть только восстановителем; г) водород взаимодействует с Cl2, S, O2 при нагревании. б, в;
115. Какими свойствами обладает вода как реагент? а) кислотно-основными; б) окислительно-восстановительными; в) активный лиганд; г) способна образовывать ассоциаты: а, б, в, г.
116. Какова роль воды в реакциях: а)2F2 + 2H2O→4HF+O2; б) 6 СО2 + 6Н2О=С6H12O6+6O2 а – вода восстановитель, б- вода восстановитель;
117. Какова роль воды в реакциях: а) C+H2O=CO+H2, б) NaH+H2O=NaOH+H2? а – окислитель, б – окислитель;
118. Активность взаимодействий с водой в ряду Ca-Sr-Ba: возрастает;
119. Ионы какой соли в воде гидролизуются? ZnSO4;
120. С каким веществом может взаимодействовать молекулярный водород? Na;
121. Определите роль водорода в реакции: H2+KMnO4+H2SO4=… восстановитель;
122. Определите роль пероксида водорода в реакции: Н2O2+KMnO4+H2SO4=… восстановитель;
123. Какие продукты реакции образуются при взаимодействии H2O2 и PbS? PbSO4, H2O.
124. Какие продукты реакции образуются при пропускании NO2 через раствор КОН? KNO2, KNO3,H2O;
125. Какие продукты реакции образуются при взаимодействии NaNO2, KI в присутствии серной кислоты? NaNO3,I2, K2SO4, H2O;
126. Какие свойства более характерны для H2O2, если: H2O2+2H++2e=2H2O (+1,78B); O2+2H++2e=H2O2 (+0,68В)? окислительные;
127. Водные растворы какого вещества имеют щелочную (рН>7) реакцию среды? NaHCO3;
128. Добавление какого вещества к воде приведет к возрастанию рН? Na2CO3;
129. Какую реакцию среды имеет раствор питьевой соды, применяемый для полоскания горла? щелочную;
130. На чем основано антисептическое действие тетрабората натрия? способности гидролизоваться с образованием борной кислоты;
131. Ионный характер связи в ряду соединений NaCl-MgCl2-AlCl3-SiCl4: уменьшается;
132. В ряду NaOH, Mg(OH)2, Al(OH)3: основные свойства ослабевают;
133. С какими веществами может взаимодействовать Са при комнатной температуре? а)Н2О; б)HClр-р; в)O2; г)Сl2; д)Br2. со всеми.
134. Назовите реагенты А, В, С в следущей схеме правращений: CaCl→2Ca→Ca(NO3)→2CaC2O4: электролиз, HNO3(к), Na2C2O4;
135. Элементы II-А группы Ca, Sr, Ba взаимодействуют с рядом соединений при комнатной температуре: F2, O2, Hal2;
136. Оксид и гидроксид бериллия обладают свойствами: амфотерными.
137. Оксиды, гидроксиды Ва и Са проявляют характерные свойства: основные;
138. В ряду солей CaHPO4→Ca4H(PO4)3→Ca5(PO4)3OH растворимость: уменьшается;
139. Основные свойства гидроксидов в ряду Ве-Ва: усиливаются;
140. Выберите правильный ответ. Гидроксид алюминия: а) амфотерный, б) основный, в) не растворим в воде, г) в желудке образует гель, нейтрализующий Н+-ионы; д) растворим в воде, е)полимеризуется. а, в, г, е.
141. В ряду B→Al→Ga→In→Tl увеличивается: комплексообразующая способность;
142. Чем объясняется токсичность СО? СО – «мягкое» основание, прочно соединяется с Fe2+;
143. Окислителем или восстановителем является атом углерода в следующих реакциях: а)>C=O→>СНOH→-CH2-; б) -СООН→СО2; в) – СH2-→-CH3: а) C – окислитель; б) С – восстановитель; в) С – окислитель;
144. В ряду оксидов и гидроксидов As(III)- Sb(III)- Bi(III): кислотные свойства уменьшаются;
145. Сила кислот в ряду SiH4→PH3→H2S→HCl: увеличивается;
146. При горении силана образуются: SiO2 и H2O.
147. Выберете правильное утверждение: а) вследствие большой полярности молекулы аммиака в 1 объеме воды при 20 °С растворяется 700 объемов аммиака; б) в водном растворе аммиак в основном находится в виде гидрата; в) в сильнощелочной среде аммиак необратимо удаляется из раствора; г) в крови гидрат аммиака находится в виде ионов аммония. все;
148. Выберите соль, которая не подвергается гидролизу: Ca3(PO4)2;
149. Выберете правильное утверждение: а)все нитраты хорошо растворимы в воде; б) водные растворы нитратов не обладают окислительными свойствами; в) все безводные нитраты обладают сильными окислительными свойствами; г) нитраты натрия и калия встречаются в виде природных залежей. а, б, в, г.
150. Выберите неправильное утверждение: кислород хорошо растворяется в воде;
151. О кислороде, О2, нельзя сказать: высокая температура воздуха (35-400С) и большая влажность вызывают снижение парциального давления кислорода;
152. Атом серы: а)легко поляризуется; б) в степени окисления -2 окисляется легче, чем углерод органических соединений; в) придает высокую нуклеофильность тиолам; г) в биосубстратах имеет степень окисления -2. а, б, в, г;
153. Какие сульфиды не растворяются в воде и кислотах? (NH4)2S, MnS;
154. Для галогенов характерно: а) уменьшение окислительной способности от фтора к иоду; б) увеличение окислительной способности от фтора к иоду; в) более активный галоген всегда вытесняет менее активный из его соединений с металлами; г) анионы галогенов склонны к комплексообразованию в качестве лигандов. все;
155. Какой ион проявляет только окислительные свойства? СlO-4;
156. В ряду HClO-HClO2- HClO3- HClO4 :устойчивость уменьшается, кислотность усиливается;
157. В ряду HF-HCl-HBr-HI: сила кислоты увеличиваются;
158. Какой из металлов в ряду Cr-Fe-Co-Ni проявляют более сильные восстановительный свойства? Fe;
159. Соли двухвалентного железа в водных растворах: окислители;
160. Назовите реагенты А и В в следующей схеме превращений: Cu(OH)2 + A→CиSO4 + B→Cu(OH)2 :А – Н2SO4 , B – Na2O.
161. Назовите реагенты А и В в следущей схеме превращений: Zn(NO3)2 + А → Zn(OH)2+B→K2[Zn(OH)4];А -- Cu(OH)2 , B – KOH (нед.);
162. Гидроксид хрома (III) является: растворимым в воде.
163. Веществом А в схеме реакции FeCl3+A→Fe(OH)3 является: NaOH;
164. В ряду Cu→Ag→Au химическая активность: не меняется.
165. В ряду элементов Zn→Cd→Hg происходит ослабление: а) экранирования; б) металлических свойств; в) восстановительных свойств; г) окислительных свойств ионов б, в;
166. В ряду элементов Zn→Cd→Hg: энергия ионизации уменьшается;
167. В ряду оксидов CrO→Cr2O3→CrO3 возрастает: а)степень окисления; б) восстановительная способность; в) кислотные свойства; г) основные свойства а, б;
168. Какой из ионов Cr3+, Fe2+,Ni2+,Pb2+ проявляет более сильные окислительные свойства? Pb2+;
169. Какой из оксидов CrO3, MoO3 или WO3 проявляет более сильные кислотные и окислительные свойства? WO3;
170. Каким свойством должно обладать вещество, которое используется как противоядие перманганату? окислительным;
171. Все платиновые металлы проявляют: постоянную степень окисления в соединениях;
172. Платиновые металлы относятся к семейству: s-элементов;
173. Почему платиновые металлы химически инертны? имеют большой Rа и большое число электронов.
174. Закончите предложение: катионы тяжелых металлов относятся к: а) «мягким» кислотам Льюиса; б) «мягким» основаниям Льюиса; в) активным комплексообразователям с любыми лигандами; г) мягким комплексообразователям с тиоловыми группами. б, г;
175. В каких степенях окисления соединения Fe, Co, Ni наиболее устойчивы? +3;
176. Рассчитайте молекулярную массу Hb, исходя из того, что в молекуле сожержится 4 атома Fe и массовая доля составляет 0,335%. 16716.
177. Ионы Co (III): сильные окислители;
178. Дихроматометрия основана реакции: СrO42-+8H++6е→Cr0+4H2O;
179. Соединения Cr (VI) являются: обладают ОВ-двойственностью.
180. Выберите правильный ответ: хлорид железа (III) не гидролизуется;
181. Выберите правильную характеристику железа: а) Fe- металл, d- элемент; б)электронная формула атома: 1s22s2p63s23p63d64s2; в) ежедневное потребление железа 1-3 мг; г) 70% железа сосредоточено в гемоглобине; д) ионы Fe2+ обладают окислительными свойствами. а, г, д;
182. Какое яркое химическое свойство проявляют перманганаты? восстановители;
183. Как изменяются кислотно-основные свойства в ряду: MnO2→MnO3→Mn2O7? усиливаются основные свойства;
184. В ряду оксидов MnO-Mn2O3-MnO2-MnO3-Mn2O7 и соответствующих им гидроксидов: а)степень окисления Mn возрастает, б)кислотные свойства усиливаются; в) кислотные свойства ослабевают; г) окислительная способность усиливается. в, г;
185. Какой продукт восстановления образуется в результате реакции KMnO4+Na2SO4+H2SO4→: MnO2;
186. В кислой среде перманганат-ион восстанавливается до ___? Какова окраска раствора при этом? Mn2+, бесцветная;
187. Какова окраска раствора, содержащего ионы MnO4-? малиновая;
188. MnO2 – это: оксид, обладающий ОВ-двойственностью;
189. В какой среде хромат-ион переходит в дихромат? нейтральной;
190. Какой оксид хрома амфотерен? CrO;
191. C какими веществами взаимодействует Zn(OH)2: а)HCl; б) NaOH; в)S, г)NH3; д)Na. б, в, г;
192. С какими веществами Au взаимодействует при комнатной температуре?
1) Cl2,Br2(H2O);(нет ответа)
2) конц. HNO3, HCl;
3) со всеми галогенами;
4) с O2 воздуха.
193. При взаимодействии Ag с HNO3 (разб) образуются: AgNO3, NO, H2O;
194. Почему жиры портятся при хранении: а) жир подвергается гидролизу, в результате чего образуются жирные кислоты, в том числе с короткой углеродной цепью; б)за счет содержания высокомолекулярных жирных кислот; в) за счет присоединения кислорода по двойным связям ненасыщенных кислот; г) за счёт образования альдегидов и кетонов. а, в;
195. Почему в хлебе много «дырочек»? результат спиртового брожения глюкозы;
МОДУЛЬ «ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. ДИСПЕРСНЫЕ СИСТЕМЫ. ВМС И ИХ РАСТВОРЫ»
Поверхностные явления
6. Выберите верное утверждение:
1) атомы или молекулы на границе раздела фаз обладают большей энергией по сравнению с атомами или молекулами в глубине фазы;
7. Величина поверхностной энергии уменьшается при: а) увеличении поверхности; б) уменьшении поверхности; в) увеличении поверхностного натяжения; г) уменьшении поверхностного натяжения.
1) б, г;
10. Уменьшение поверхностной энергии Гиббса происходит за счет самопроизвольного:
1) уменьшения межфазной поверхности;
4. Выберите верное утверждение (для лиофильных коллоидов):
2) мицеллообразование — процесс самопроизвольный, сопровождается уменьшением поверхностной энергии;
5. Самопроизвольный процесс коагуляции сопровождается:
14. уменьшением поверхностной энергии;
1) Куб по сравнению с шаром того же объема имеет:
2) большую поверхностную энергию;
2) Выберите верное утверждение:
2) чем меньше энергия межмолекулярных взаимодействий, тем меньше величина поверхностного натяжения;
3) При увеличении температуры значение поверхностного натяжения:
3) уменьшается;
4) Единицы измерения поверхностного натяжения:
4) н/м;
5) Основываясь на сопоставлении энергии межмолекулярного взаимодействия, расположите вещества в порядке увеличения величины поверхн



 =K CaCb;
=K CaCb;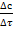 ;
; = γ;
= γ;


