4. Какие из перечисленных воздействий приведут к изменению значения константы равновесия химических реакций:
1) введение катализатора,
2) изменение концентраций реагирующих веществ,
Изменение температуры.
4) введение катализатора и повышение температуры.
5. Какие из перечисленных факторов влияют на константу равновесия реакции, если она протекает между веществами в газообразном состоянии: а)Р, б) Т, в) присутствие инертного газа, г) природа реагирующих, д) парциальные давления взятых для реакции веществ.
1) а, б, в, г.
Б, г.
3) а, в, д
4) б, г, д
6. Изменится ли и как значение константы равновесия реакции: А +2В↔АВ2, если общее давление в системе увеличить в 2 раза? Все вещества находятся в газообразном состоянии.
1) увеличится в 4 раза,
2) увеличится в 2 раза,
3) уменьшится в 4 раза,
Не изменится
7. Если система находится в состоянии равновесия, то какое из следующих утверждений является верным:
1) ∆G =0,
2) К=1
3) К›1
4) К‹1
8. При каком соотношении ∆Н и Т ∆S система находится в равновесии:
1) ∆Н = -T∆S;
2) ∆Н › -T∆S;
3) ∆Н ‹ -T∆S;
4) ∆Н = T∆S;
9. Для некоторой реакции ∆G›0. Какие из приведенных утверждений правильны: а) К›1, б) К‹1, в) в равновесной смеси преобладают продукты реакции, г) в равновесной смеси преобладают исходные вещества.
1) а, в
Б, г
3) а, г
4) а, б
10. Для некоторой реакции ∆G‹0.. Какие из приведенных утверждений правильны: а) К›1, б) К‹1, в) в равновесной смеси преобладают исходные вещества, г) в равновесной смеси преобладают продукты реакции.
А, г
2) а, в
3) б, в
4) б, г
11. Как изменится энтропия изолированной системы, в которой обратимо кристаллизуются вещества?
1) увеличится,
2) уменьшится,
3) не меняется,
4) достигает максимального значения.
12. Влияние различных факторов на химическое равновесие определяет:
Принцип Ле-Шателье,
2) константа химического равновесия,
3) закон действующих масс,
4) закон Вант-Гоффа.
13. Какие факторы влияют на смещение химического равновесия, если реакция протекает в жидкой фазе: а) концентрации реагирующих веществ, б) давление, в) температура, г) время, д) катализатор?
1) а, б, в,
А, в,
3) а, в, г, д;
4) а, б, в, д.
14. Какие воздействия на систему 2SO2(г)+O2(г)↔ 2SO3(г)уменьшают выход продукта реакции: а) увеличение концентрации O2, б) увеличение концентрации SO3, в) повышение давления, г) возрастание объема реакционного сосуда.
1) б, г;
2) а, в;
3) б, в, г;
4) а, в, г.
15. В каком направлении сместится равновесие в системе 4Fe + 3O2↔2Fe2O3 при увеличения давления?
1) в сторону прямой реакции;
2) не сместится;
3) в сторону обратной реакции;
4) в сторону увеличения давления.
16. В какую сторону будет смещаться равновесие при повышении температуры в системе: N2(г)+3H2(г)↔2NH3(г), ∆Н‹0?
1) влево;
2) вправо;
3) не сместится;
4) в сторону эндотермической реакции.
17. В каких из ниже приведенных реакций изменение давления не вызовет нарушения равновесия: а) H2(г)+I2(г)↔2HI(г); б) 2SO2(г)+O2(г)↔ 2SO3(г); в) 4HCl(г)+ O2(г)↔2H2O(г)+ 2Cl2(г)?
1) в, б;
2) а, г;
3) а, б;
4) б, г.
18. Если объем закрытого реакционного сосуда, в котором установилось равновесие 2SO2(г)+O2(г)↔ 2SO3(г), уменьшить в 2 раза, то..э
1) равновесие не сместится,
2) равновесие сместится влево;
3) равновесие сместится вправо;
4) недостаточно данных для ответа.
19. Вследствие каких реакций повышение температуры и давления приведет к смещению равновесия вправо: а) 3О2(г)↔2О3(г), ∆Н298= 184,6кДж; б) N2(г)+ O2(г)=2NO, ∆Н=180,7 кДж; в) COCl2(г)↔CO(г)+Cl2(г), ∆H= 112,5 кДж; г) 2CO(г)↔ CO2(г)+С(г), ∆H=-172,5 кДж; д) CO2(г)+ 2H2(г)↔СH3OH(г), ∆H=193,3кДж.
1) а, д;
2) а, б, в, д;
3) а, д;
4) а, г, д.
20. В каком направлении сместиться равновесие в системе Hb+O2↔ Hb O2, при увеличении парциального давления кислорода?
1) в сторону прямой реакции;
2) равновесие не сместится;
3) в сторону обратной реакции;
4) в сторону увеличения давления.
21. Биохимическое равновесное состояние системы характеризуется: а) равенством скоростей прямой и обратной реакций; б) отсутствием изменений параметров и функций состояния систем; в) постоянством скорости поступления и удаления веществ и энергии; г) постоянством скорости изменения параметров и функций состояния систем.
1) в, г;
2) а, в;
3) б, г;
А, б.
22. стационарное состояние для живого организма характеризуется: а) равенством скоростей прямой и обратной реакций; б) отсутствием изменений параметров и функций состояния систем; в) постоянством скорости поступления и удаления веществ и энергии; г) постоянством скорости изменения параметров и функций состояния систем.
1) в, г;
2) а, в;
3) б, г;
4) а, б.
23. Условия химического равновесия:
1) ∆G=0; Ѵ→=Ѵ←;
2) ∆G=0; Ѵ→›Ѵ←;
3) ∆G=DGmin+; Ѵ→=Ѵ←;
4) ∆G=DGmin+; Ѵ→‹Ѵ←.
24. Для открытых систем стационарное состояние характеризуется приростом энтропии в единицу времени, которое:
1)  =0;
=0;
2)  ›0;
›0;
3)  ‹0;
‹0;
4)  →min;
→min;
25. Биологические системы в стационарном состоянии характеризуются тем, что:
1) далеки от равновесия;
2) близки к равновесию;
3) близки к равновесию;
4) далеки от равновесия.
26. В соответствии с принципом Пригожина для стационарного состояния рассеяние энергии Гиббса открытой системой:
1) равно нулю;
2) максимально;
3) минимально;
4) не происходит.
27. Несколько одновременно существующих равновесий можно рассматривать как изолированные, если: а) они независимы друг от друга; б) смещение равновесия в одном не влияет на положение равновесия в другом; в) имеется несколько тождественных по типу химической реакции частиц; г) изменение положения равновесия в одном из них влечет за собой изменение в других.
1) в, г;
2) а, б;
3) а, г;
4) а, в.
28. Несколько одновременно существующих равновесий можно рассматривать как совмещенные, если: а) они независимы друг от друга; б) смещение равновесия в одном не влияет на положение равновесия в другом; в) имеется несколько тождественных по типу химической реакции частиц; г) изменение положения равновесия в одном из них влечет за собой изменение в других.
1) в, г;
2) а, б;
3) а, г;
4) а, в.
29. В биологических системах протекают совмещенные равновесия, в которых преобладающим становится процесс, характеризующийся:
1) большим значением константы равновесия, т.е. меньшей убылью энергии Гиббса;
2) меньшим значением константы равновесия, т.е. меньшей убылью энергии Гиббса;
3) большим значением константы равновесия, т.е. большей убылью энергии Гиббса;
4) меньшим значением константы равновесия, т.е. большей убылью энергии Гиббса.
30. Гидроксид алюминия – антацидное вещество, снижение кислотности желудочного сока обусловлено реакцией: Al(OH)3+H+↔ Al(OH)+H2O. Растворение прекращается при pH=4. Укажите преобладающий конкурирующий процесс: а) при pH‹4 преобладает протолитическое равновесие; б) при pH›4 преобладает гетерогенное равновесие; в) при pH›4 преобладает протолитическое равновесие; г) при pH‹7 преобладает гетерогенное равновесие.
1) а, б;
2) в, г;
3) а, г;
4) б, в.
Химическая кинетика.
1. Что изучает кинетика?
1) возможность протекания химических процессов;
2) энергетические характеристики физических и химических процессов;
3) скорости протекания химических превращений и механизмы этих превращений;
4) тепловые эффекты биохимических процессов.
2. Что называют истинной скоростью химической реакции?
1) количество вещества, прореагировавшего в единицу времени в единице объема;
2) производная от концентрации реагирующего вещества по времени в постоянном объеме;
3) пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам в реакции;
4) изменение концентрации вещества за единицу времени в единице объема.
3. Что называют средней скоростью химической реакции?
1) количество вещества, прореагировавшего в единицу времени в единице объема;
2) производная от концентрации реагирующего вещества по времени в постоянном объеме;
3) пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам в реакции;
4) изменение концентрации вещества за единицу времени в единице объема.
4. Какое уравнение можно использовать для вычисления средней скорости гомогенной реакции по изменению концентрации (с) или количества вещества (п) продуктов реакции: а) υ=  ; б) υ= -
; б) υ= -  ; в) υ =
; в) υ = 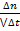 ; г) υ= -
; г) υ= - 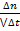
1) а, в;
2) а, г;
3) б, в;
4) б, г.
5. Какое уравнение можно использовать для вычисления средней скорости гетерогенной реакции по изменению количества вещества исходных веществ: а) υ= - 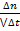 ; б) С
; б) С  в) υ= -
в) υ= -  ; г) υ=
; г) υ= 
1) а, б;
2) г;
3) в;
4) б.
6. какое уравнении можно использовать для вычисления средней скорости гомогенной реакции по изменению концентрации или количества вещества исходных веществ: а) υ=  ; б)) υ= -
; б)) υ= -  ; в) υ=
; в) υ= 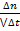 ; г) υ= -
; г) υ= - 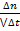 :
:
1) а;
2) б, в;
3) а, г;
4) б, г.
7. Как изменяются скорости прямой и обратной реакции во времени от начала реакции?
1) прямой – увеличивается, обратной – уменьшается;
2) прямой– уменьшается, обратной– увеличивается;
3) прямой и обратной – увеличивается;
4) прямой и обратной– уменьшается.
8. Скорость химической реакции зависит от:
1) температуры, времени, концентрации;
2) природы реагирующих веществ, температуры, концентрации;
3) времени, температуры, концентрации, природы реагирующих веществ;
4) времени, температуры, концентрации.
9. Какие из следующих факторов влияют на скорость химической реакции: а) природа реагирующих веществ, б) концентрация реагирующих веществ, в) катализатор, г) растворитель, д) температура:
1) а, в, д;
2) а, б, в, д;
3) все факторы;
4) б, в, д.
10. скорость измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности раздела фаз для реакций:
1) гомогенных;
2) гетерогенных;
3) протекающих в газовой фазе;
4) протекающих в твердой фазе.
11. скорость измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени в единице объема для реакции:
1) гомогенной;
2) гетерогенной;
3) на границе твердое тело – жидкость;
4) на границе газ – жидкость.
12. Единицы измерения скорости химической реакции: а) мольл-1с-1, б) лмоль-1, в) смоль-1, г) мольл-1мин-1.
1) а, г;
2) а;
3) б, в, г;
4) а, в.
13. Сформулируйте основной закон химической кинетики:
1) скорость сложной реакции, состоящей из ряда последовательных стадий, определяется скоростью самой медленной стадии;
2) скорость реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам в уравнении реакции;
3) скорость реакции определяется изменением числа реагирующих молекул в единицу времени в единице объема;
4) скорость реакции увеличивается при увеличении температуры.
14. Закон действующих масс устанавливает зависимость между скоростью химической реакции и:
1) температурой;
2) концентрацией реагирующих веществ;
3) массой реагирующих веществ;
4) количеством реагирующих веществ.
15. От каких факторов зависит величина константы скорости химической реакции?
1) от времени реакции, температуры, катализатора;
2) от природы реакции, температуры, концентрации;
3) от природы реакции, температуры, катализатора;
4) от природы реакции и температуры.
16. Когда численное значение константы скорости и скорости совпадают?
1) если концентрации реагирующих веществ постоянны и равны единице;
2) если концентрации реагирующих веществ постоянны;
3) если реагирующие вещества и продукты реакции находятся в одной фазе;
4) никогда не совпадают.
17. Какие из перечисленных воздействий приведут к изменению константы скорости реакции: а) изменение температуры, б) изменение объема реакционного сосуда, в) введение в систему катализатора, г) изменение концентрации реагтрующих веществ.
1) а, в;
2) б, г;
3) а, б, г;
4) а, в, г.
18. В каких случаях скорость реакции определяется изменением концентрации реагирующих веществ в единицу времени?
1) если давление в системе постоянное;
2) если объем системы постоянен;
3) если температура системы постоянна;
4) если энергия системы постоянна.
19. Для какой реакции при изменении количества вещества А скорость не изменится: а) А(г)+В(г)→; б) 2А(г)+В2(г)→; в) 2А(Т)+2В(г)→; г) 3А(г)+ В2(г)→.
1) а;
2) в;
3) б, г;
4) а, г.
20. Сумму показателей степеней при концентрациях, входящих в кинетическое уравнение называют?
1) общим кинетическим порядком реакции;
2) молекулярностью реакции;
3) порядком реакции по веществу;
4) стехиометрическими коэффициентами.
21. Что называют порядком реакции по веществу?



 =0;
=0; →min;
→min; ; б) υ= -
; б) υ= - 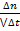 ; г) υ= -
; г) υ= -  в) υ= -
в) υ= -  ; г) υ=
; г) υ= 


