

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...
Топ:
Выпускная квалификационная работа: Основная часть ВКР, как правило, состоит из двух-трех глав, каждая из которых, в свою очередь...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Интересное:
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Хлорноватистая кислота HCl+1O
H–O–Cl
Физические свойства
Существует только в виде разбавленных водных растворов.
Получение
Cl2 + H2O «HCl + HClO
Химические свойства
HClO - слабая кислота и сильный окислитель:
1) Разлагается, выделяя атомарный кислород
HClO –на свету®HCl + O
2) Со щелочами дает соли - гипохлориты
HClO + KOH ® KClO + H2O
3)
2HI + HClO ® I2¯ + HCl + H2O
Хлористая кислота HCl+3O2
H–O–Cl=O
Физические свойства
Существует только в водных растворах.
Получение
Образуется при взаимодействии пероксида водорода с оксидом хлора (IV), который получают из бертоллетовой соли и щавелевой кислоты в среде H2SO4:
2KClO3 + H2C2O4 + H2SO4 ® K2SO4 + 2CO2 + 2СlO2 + 2H2O
2ClO2 + H2O2 ® 2HClO2 + O2
Химические свойства
HClO2 - слабая кислота и сильный окислитель; соли хлористой кислоты - хлориты:
1)
HClO2 + KOH ® KClO2 + H2O
2) Неустойчива, при хранении разлагается
4HClO2 ® HCl + HClO3 + 2ClO2 + H2O
Хлорноватая кислота HCl+5O3

|
Физические свойства
Устойчива только в водных растворах.
Получение
Ba (ClO3)2 + H2SO4 ® 2HClO3 + BaSO4¯
Химические свойства
HClO3 - Сильная кислота и сильный окислитель; соли хлорноватой кислоты - хлораты:
6P + 5HClO3 ® 3P2O5 + 5HCl
HClO3 + KOH ® KClO3 + H2O
KClO3 - Бертоллетова соль; ее получают при пропускании хлора через подогретый (40°C) раствор KOH:
3Cl2 + 6KOH ® 5KCl + KClO3 + 3H2O
Бертоллетову соль используют в качестве окислителя; при нагревании она разлагается:
4KClO3 –без кат®KCl + 3KClO4
2KClO3 –MnO2 кат®2KCl + 3O2
Хлорная кислота HCl+7O4

|
Физические свойства
Бесцветная жидкость, t°кип. = 25°C, t°пл.= -101°C.
|
|
Получение
KClO4 + H2SO4 ® KHSO4 + HClO4
Химические свойства
HClO4 - очень сильная кислота и очень сильный окислитель; соли хлорной кислоты - перхлораты.
1)
HClO4 + KOH ® KClO4 + H2O
2) При нагревании хлорная кислота и ее соли разлагаются:
4HClO4 –t°® 4ClO2 + 3O2 + 2H2O
KClO4 –t° KCl + 2O2
БРОМ И ЕГО СОЕДИНЕНИЯ
Бром Br2 - открыт Ж. Баларом в 1826 г.
Физические свойства
Бурая жидкость с тяжелыми ядовитыми парами; имеет неприятный запах; r= 3,14 г/см3; t°пл. = -8°C; t°кип. = 58°C.
Получение
Окисление ионов Br - сильными окислителями:
MnO2 + 4HBr ® MnBr2 + Br2 + 2H2O
Cl2 + 2KBr ® 2KCl + Br2
Химические свойства
В свободном состоянии бром - сильный окислитель; а его водный раствор - "бромная вода" (содержащий 3,58% брома) обычно используется в качестве слабого окислителя.
1) Реагирует с металлами:
2Al + 3Br2 ® 2AlBr3
2) Реагирует с неметаллами:
H2 + Br2 «2HBr
2P + 5Br2 ® 2PBr5
3) Реагирует с водой и щелочами:
Br2 + H2O «HBr + HBrO
Br2 + 2KOH ® KBr + KBrO + H2O
4) Реагирует с сильными восстановителями:
Br2 + 2HI ® I2 + 2HBr
Br2 + H2S ® S + 2HBr
Бромистый водород HBr
Физические свойства
Бесцветный газ, хорошо растворим в воде; t°кип. = -67°С; t°пл. = -87°С.
Получение
1)
2NaBr + H3PO4 –t° Na2HPO4 + 2HBr
2)
PBr3 + 3H2O ® H3PO3 + 3HBr
Химические свойства
Водный раствор бромистого водорода - бромистоводородная кислота еще более сильная, чем соляная. Она вступает в те же реакции, что и HCl:
1) Диссоциация:
HBr «H+ + Br -
2) С металлами, стоящими в ряду напряжения до водорода:
Mg + 2HBr ® MgBr2 + H2
3) с оксидами металлов:
CaO + 2HBr ® CaBr2 + H2O
4) с основаниями и аммиаком:
NaOH + HBr ® NaBr + H2O
Fe(OH)3 + 3HBr ® FeBr3 + 3H2O
NH3 + HBr ® NH4Br
5) с солями:
MgCO3 + 2HBr ® MgBr2 + H2O + CO2
AgNO3 + HBr ® AgBr¯ + HNO3
Соли бромистоводородной кислоты называются бромидами. Последняя реакция - образование желтого, нерастворимого в кислотах осадка бромида серебра служит для обнаружения аниона Br - в растворе.
|
|
6) HBr - сильный восстановитель:
2HBr + H2SO4(конц.) ® Br2 + SO2 + 2H2O
2HBr + Cl2 ® 2HCl + Br2
Из кислородных кислот брома известны слабая бромноватистая HBr+1O и сильная бромноватая HBr+5O3.
ИОД И ЕГО СОЕДИНЕНИЯ
Йод I2 - открыт Б. Куртуа в 1811 г.
Физические свойства
Кристаллическое вещество темно-фиолетового цвета с металлическим блеском.
r= 4,9 г/см3; t°пл.= 114°C; t°кип.= 185°C. Хорошо растворим в органических растворителях (спирте, CCl4).
Получение
Окисление ионов I- сильными окислителями:
Cl2 + 2KI ® 2KCl + I2
2KI + MnO2 + 2H2SO4 ® I2 + K2SO4 + MnSO4 + 2H2O
Химические свойства
1) c металлами:
2Al + 3I2 ® 2AlI3
2) c водородом:
H2 + I2 «2HI
3) с сильными восстановителями:
I2 + SO2 + 2H2O ® H2SO4 + 2HI
I2 + H2S ® S + 2HI
4) со щелочами:
3I2 + 6NaOH ® 5NaI + NaIO3 + 3H2O
Иодистый водород
Физические свойства
Бесцветный газ с резким запахом, хорошо растворим в воде, t°кип. = -35°С; t°пл. = -51°С.
Получение
1)
I2 + H2S ® S + 2HI
2)
2P + 3I2 + 6H2O ® 2H3PO3 + 6HI
Химические свойства
1) Раствор HI в воде - сильная йодистоводородная кислота:
HI «H+ + I-
2HI + Ba(OH)2 ® BaI2 + 2H2O
Соли йодистоводородной кислоты - йодиды (др. реакции HI см. св-ва HCl и HBr)
2) HI - очень сильный восстановитель:
2HI + Cl2 ® 2HCl + I2
8HI + H2SO4(конц.) ® 4I2 + H2S + 4H2O
5HI + 6KMnO4 + 9H2SO4 ® 5HIO3 + 6MnSO4 + 3K2SO4 + 9H2O
3) Идентификация анионов I- в растворе:
NaI + AgNO3 ® AgI¯ + NaNO3
HI + AgNO3 ® AgI¯ + HNO3
Образуется темно-желтый осадок йодида серебра, нерастворимый в кислотах.
Кислородные кислоты йода
Йодноватая кислота HI+5O3
Бесцветное кристаллическое вещество, t°пл.= 110°С, хорошо растворимое в воде.
Получают:
3I2 + 10HNO3 ® 6HIO3 + 10NO + 2H2O
HIO3 - сильная кислота (соли - йодаты) и сильный окислитель.
Йодная кислота H5I+7O6
Кристаллическое гигроскопичное вещество, хорошо растворимое в воде, t°пл.= 130°С.
Слабая кислота (соли - перйодаты); сильный окислитель.
ПОДГРУППА КИСЛОРОДА
Общая характеристика
Кислород
Сера и ее соединения
ОБЩАЯ ХАРАКТЕРИСТИКА
Общая характеристика
элементов главной подгруппы VI группы (подгруппы кислорода)
Таблица. Электронное строение и физические свойства.
| Поряд- ковый № | Элемент | Относитель- ная атомная масса | Электронная конфигурация | Атомный радиус, нм | ПИ эВ | Э.О | Степени окисления | t°пл °С | t°кип °С | r г/см3 |
| Кислород (O) | 15,9994 | [He] 2s22p4 | 0,066 | 14,5 | 3,5 | -2, -1, +1, +2 | -218,4 | -182,9 | 1,2 (-183°C) | |
| Сера (S) | 32,06 | [Ne] 3s23p4 | 0,105 | 10,5 | 2,6 | -2, +2, +3, +4, +5, +6 | 112,8 | 444,67 | 2,07 | |
| Селен (Se) | 78,96 | [Ar] 3d104s24p4 | 0,116 | 9,8 | 2,01 | -2, +4, +6 | 4,8 | |||
| Теллур (Te) | 127,60 | [Kr] 4d105s25p4 | 0,143 | 8,6 | 1,9 | -3, +3, +4, +5 | 6,68 | |||
| Полоний (Po) | 208,98 | [Xe] 4f145d106s26p4 | 0,176 | 7,8 | 1,76 | +2, +4 | 9,32 |
|
|
КИСЛОРОД
Кислород O2
(К.В. Шееле 1772 г., Дж. Пристли 1774 г.)
Самый распространенный элемент на Земле; в воздухе - 21% по объему; в земной коре - 49% по массе; в гидросфере - 89% по массе; в составе живых организмов-- до 65% по массе.
Строение атома

| P11 = 8; n01 = 8; ē = 8 |
| 1s22s22p4 | 
|
Физические свойства
Газ - без цвета, вкуса и запаха; в 100V H2O растворяется 3V O2 (н.у.); t°кип= -183°С; t°пл = -219°C; d по воздуху = 1,1.
Способы получения
1. Промышленный способ (перегонка жидкого воздуха).
2. Лабораторный способ (разложение некоторых кислородосодержащих веществ)
2KMnO4 –t°® K2MnO4 + MnO2 + O2
2KClO3 –t°;MnO2®2KCl + 3O2
2H2O2 –MnO2®2H2O + O2
Способы собирания

| 
| 
|
| Вытеснением воды | Вытеснением воздуха |
Химические свойства
Взаимодействие веществ с кислородом называется окислением.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород - окислитель.
С неметаллами
C + O2 ® CO2
S + O2 ® SO2
2H2 + O2 ® 2H2O
С металлами
2Mg + O2 ® 2MgO
2Cu + O2 –t°®2CuO
Со сложными веществами
4FeS2 + 11O2 ® 2Fe2O3 + 8SO2
2H2S + 3O2 ® 2SO2 + 2H2O
CH4 + 2O2 ® CO2 + 2H2O
Горение в кислороде

|
Озон O3
Озон -аллотропная модификация кислорода.
Физические свойства
Газ, запах свежей хвои, бесцветный, растворим в воде; t°кип= -112°С; t°пл= -193°C.
Получение
3O2 ® 2O3
1. Во время грозы (в природе), (в лаборатории) в озонаторе

|
2. Действием серной кислоты на пероксид бария
3BaO2 + 3H2SO4 ® 3BaSO4 + 3H2O + O3
Химические свойства
1. Неустойчив:
O3 ® O2 + O
2. Сильный окислитель:
2KI + O3 + H2O ® 2KOH + I2 + O2
Обесцвечивает красящие вещества, отражает УФ - лучи, уничтожает микроорганизмы.
|
|

|
АЗОТ И ЕГО СОЕДИНЕНИЯ
Азот Аммиак Соли аммония Оксиды азота Азотистая кислота Азотная кислота
Разложение нитратов
АЗОТ
N
:NºN:
Открыт Д.Резерфордом в 1772 г. Основной компонент воздуха (78% по объему, 75,6% по массе).
В молекуле имеются одна - и две - связи.
Физические свойства
Газ, без цвета, запаха и вкуса; плохо растворим в воде (в 100V H2O растворяется 1,54V N2 при t°=20°С и p = 1 атм); t°кип.=-196°C; t°пл.=-210°C.
Получение
1. Промышленный способ. Перегонка жидкого воздуха.
2. Лабораторный способ. Разложение нитрита аммония:
NH4NO2 –t°® N2 + 2H2O
Химические свойства
Молекула азота (:NºN:)
Очень устойчива (три ковалентные связи), поэтому обладает низкой реакционной способностью.
Восстановитель N20 ® 2N+2
Высокая температура (электрическая дуга, 3000°С)
N20 + O2 «2N+2O
(в природе - во время грозы)
Окислитель N20 ® 2N-3
1. c водородом (500°С, kat, p)
N20 + 3H2 «2N-3HЗ
2. с активными металлами (с щелочными и щел.зем. металлами)
6Li + N20 ® 2LiЗN-3
3Mg + N20 –t°® MgЗN2-3
АММИАК
NH3
Строение
Молекула полярная, имеет форму треугольной пирамиды с атомом азота в вершине, ÐHNH = 107,3°. Атом азота находится в sp3- гибридном состоянии; из четырех гибридных орбиталей азота три участвуют в образовании одинарных связей N–H, а четвертая связь занята неподеленной электронной парой.

Физические свойства
NH3 - бесцветный газ, запах резкий, удушливый, ядовит, легче воздуха.
по воздуху = MNH3 / M ср.воздуха = 17 / 29 = 0,5862
t° кип.= -33,4°C; t°пл.= -78°C.
Молекулы аммиака связаны слабыми водородными связями

Благодаря водородным связям, аммиак имеет сравнительно высокие t°кип. и t°пл., а также высокую теплоту испарения, он легко сжимается.
Хорошо растворим в воде: в 1V Н2O растворяется 750V NH3 (при t°=20°C и p=1 атм).
В хорошей растворимости аммиака можно убедиться на следующем опыте. Сухую колбу наполняют аммиаком и закрывают пробкой, в которую вставлена трубка с оттянутым концом. Конец трубки опускают в воду и колбу немного подогревают. Объем газа увеличивается, и немного аммиака выйдет из трубки. Затем нагревание прекращают и, вследствие сжатия газа некоторое количество воды войдет через трубку в колбу. В первых же каплях воды аммиак растворится, в колбе создастся вакуум и вода, под влиянием атмосферного давления будет подниматься в колбу, - начнет "бить фонтан".

Получение
1. Промышленный способ
N2 + 3H2 ® 2NH3
(p=1000 атм; t°= 500°C; kat = Fe + алюмосиликаты; принцип циркуляции).
2. Лабораторный способ. Нагревание солей аммония со щелочами.
|
|
2NH4Cl + Ca(OH)2 –t°® CaCl2 + 2NH3 + 2Н2O
(NH4)2SO4 + 2KOH –t°® K2SO4 + 2NH3 + 2Н2O
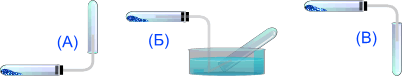
Аммиак можно собирать только по методу (А), т.к. он легче воздуха и очень хорошо растворим в воде.
Химические свойства
Образование ковалентной связи по донорно-акцепторному механизму.

1. Аммиак - основание Льюиса. Его раствор в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус – синий; фенолфталеин – малиновый) из-за образования гидроксида аммония.
NH3 + Н2O «NH4OH «NH4+ + OH-
2. Аммиак реагирует с кислотами с образованием солей аммония.
NH3 + HCl ® NH4Cl
2NH3 + H2SO4 ® (NH4)2SO4
NH3 + H2O + CO2 ® NH4HCO3
Аммиак - восстановитель (окисляется до N2+1O или N+2O)
1. Разложение при нагревании
2N-3H3 t°® N20 + 3H2
2. Горение в кислороде
a) без катализатора
4N-3H3 + 3O2 ® 2N20 + 6Н2O
b) каталитическое окисление (kat = Pt)
4N-3H3 + 5O2 ® 4N+2O + 6Н2O
3. Восстановление оксидов некоторых металлов
3Cu+2O + 2N-3H3 ® 3Cu0 + N20 + 3Н2O
СОЛИ АММОНИЯ
Соли аммония – сложные вещества, в состав которых входят катионы аммония NH4+, связанные с кислотным остатком.
Физические свойства
Кристаллические вещества, хорошо растворимые в воде.
Получение
Аммиак (или гидроксид аммония) + кислота.
NH3 + HNO3 ® NH4NO3(нитрат аммония)
2NH4OH + H2SO4 ® (NH4)2SO4(cульфат аммония) + 2Н2O
Химические свойства
1. Сильные электролиты (диссоциируют в водных растворах)
NH4Cl «NH4+ + Cl-
2. Разложение при нагревании.
a) если кислота летучая
NH4Cl t°® NH3 + HCl
NH4HCO3 ® NH3 + Н2O + CO2
b) если анион проявляет окислительные свойства
NH4NO3 –t°® N2O + 2Н2O
(NH4)2Cr2O7 –t°® N2 + Cr2O3 + 4Н2O
3. С кислотами и солями (реакция обмена)
a)
(NH4)2CO3 + 2НCl ® 2NH4Cl + Н2O + CO2
2NH4+ + CO32- + 2H+ + 2Cl- ® 2NH4+ + 2Cl- + Н2O + CO2
CO32- + 2H+ ® Н2O + CO2
b)
(NH4)2SO4 + Ba(NO3)2 ® BaSO4¯ + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- ® BaSO4¯ + 2NH4+ + 2NO3-
Ba2+ + SO42- ® BaSO4¯
4. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O «NH4OH + HCl
NH4+ + Н2O «NH4OH + H+
5. При нагревании со щелочами выделяют аммиак (качественная реакция на NH4+)
NH4Cl + NaOH –t°® NaCl + NH3 + Н2O
ОКСИДЫ АЗОТА
N2+1O
ОКСИД АЗОТА (I)
ЗАКИСЬ АЗОТА, "ВЕСЕЛЯЩИЙ ГАЗ"
N+2O
ОКСИД АЗОТА (II)
ОКИСЬ АЗОТА
N2+3O3
ОКСИД АЗОТА (III)
АЗОТИСТЫЙ АНГИДРИД
N+4O2
ОКСИД АЗОТА (IV)
ДВУОКИСЬ АЗОТА, ДИОКСИД АЗОТА
N2+5O5
ОКСИД АЗОТА (V)
АЗОТНЫЙ АНГИДРИД
Оксид азота (I)
N2+1O закись азота, "веселящий газ"
Физические свойства
Газ, бесцветный, запах сладковатый, растворим в воде, t°пл.= -91°C, t°кип.= -88,5°С. Анестезирующее средство.
Получение
NH4NO3 –t°® N2O + 2Н2O
Химические свойства
1. Разлагается при 700°C с выделением кислорода:
2N2+1O –t°® 2N20 + O20
поэтому он поддерживает горение и является окислителем
2. С водородом:
N2+1O + H2 ® N20 + Н2O
3. Несолеобразующий
Оксид азота (II)
N+2O окись азота
Газ, бесцветный, плохо растворим в воде, t°пл.= -164°C, t°кип.= -152°С
Получение
1. Каталитическое окисление аммиака (промышленный способ)
4NH3 +5O2 ® 4NO + 6H2O
2.
3Cu + 8HNO3(разб.) ® 3Cu(NO3)2 + 2NO + 4H2O
3.
N2 + O2 ®2NO (в природе, во время грозы)
Химические свойства
1. Легко окисляется кислородом и галогенами
2NO + O2 ® 2NO2
2NO + Cl2 ® 2NOCl(хлористый нитрозил)
2. Окислитель
2N+2O + 2S+4O2 ® 2S+6O3 + N20
3. Несолеобразующий
Оксид азота (III)
N2+3O3 азотный ангидрид
Физические свойства
Темно-синяя жидкость (при низких температурах), t°пл.= -102°C, t°кип.= 3,5°С; Выше t°кип. разлагается на NO и NO2. N2O3 соответствует азотистой кислоте (HNO2), которая существует только в разбавленных водных растворах.
Получение
NO2 + NO «N2O3
Химические свойства
Все свойства кислотных оксидов.
N2O3 + 2NaOH ®2NaNO2(нитрит натрия) + H2O
Оксид азота (IV)
N+4O2 двуокись азота, диоксид азота
Физические свойства
Бурый газ, запах резкий, удушливый, ядовит, t°пл.= -11,2°C, t°кип.= 21°С.
Получение
1.
2NO + O2 ® 2NO2
2.
Cu + 4HNO3(конц.) ® Cu(NO3)2 + 2NO2 + 2H2O
Химические свойства
1. Кислотный оксид
с водой
2NO2 + H2O ® HNO3 + HNO2
4NO2 + 2H2O + O2 ® 4HNO3
со щелочами
2NO2 + 2NaOH ® NaNO2 + NaNO3 + H2O
2. Окислитель
N+4O2 + S+4O2 ® S+6O3 + N+2O
3. Димеризация
2NO2(бурый газ)«N2O4(бесцветная жидкость)
Оксид азота (V)
N2+5O5 азотный ангидрид
Физические свойства
Кристаллическое вещество, летучее, неустойчивое.
Получение
1.
2NO2 + O3 ® N2O5 + O2
2.
2HNO3 +P2O5 ® 2HPO3 + N2O5
Химические свойства
1. Кислотный оксид
N2O5 + H2O ® 2HNO3
2. Сильный окислитель
3. Легко разлагается (при нагревании - со взрывом):
2N2O5 ® 4NO2 + O2
АЗОТИСТАЯ КИСЛОТА
HNO2 Азотистая кислота
H–O–N=O
Физические свойства
Существует только в разбавленных водных растворах.
Получение
AgNO2 + HCl ® HNO2 + AgCl¯
Химические свойства
1. Слабая кислота; ее соли (нитриты) – устойчивы:
HNO2 + NaOH ® NaNO2 + H2O
2. Разлагается при нагревании:
3HNO2 ® HNO3 + 2NO + H2O
3. Слабый окислитель (окислительные свойства проявляет только в реакциях с сильными восстановителями)
2KNO2 + 2KI + 2H2SO4 ® 2K2SO4 + I2 + 2NO + 2H2O
| 2I- - 2ē ® I20 | |
| NO2- + 2H+ + 1ē ® NO + H2O |
2I- + 2NO2- + 4H+ ® I20 + 2NO + 2H2O
4. Сильный восстановитель:
HNO2 + Cl2 + H2O ® HNO3 + 2HCl
АЗОТНАЯ КИСЛОТА
HNO3 Азотная кислота

Физические свойства
Бесцветная жидкость, неограниченно растворимая в воде; t°пл.= -41°C; t°кип.= 82,6°С, r = 1,52 г/см3
Получение
1. Лабораторный способ
KNO3 + H2SO4(конц) –t°® KHSO4 + HNO3
2. Промышленный способ. Осуществляется в три этапа:
a) Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 –500°,Pt® 4NO + 6H2O
b) Окисление кислородом воздуха NO до NO2
2NO + O2 ® 2NO2
c) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O «4HNO3
Химические свойства
Очень сильная кислота. Диссоциирует в водном растворе практически нацело:
HNO3 «H+ + NO3-
Реагирует:
с основными оксидами
CuO + 2HNO3 ® Cu(NO3)2 + H2O
CuO + 2H+ + 2NO3- ® Cu2+ + 2NO3- + H2O
или CuO + 2H+ ® Cu2+ + H2O
с основаниями
HNO3 + NaOH ® NaNO3 + H2O
H+ + NO3- + Na+ + OH- ® Na+ + NO3- + H2O
или H+ + OH- ® H2O
вытесняет слабые кислоты из их солей
2HNO3 + Na2CO3 ® 2NaNO3 + H2O + CO2
2H+ + 2NO3- + 2Na+ + СO32- ® 2Na+ + 2NO3- + H2O + CO2
2H+ + СO32- ® H2O + CO2
|
|
|

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!