Кислотные оксиды взаимодействуют с гидроксидами (основаниями)
2NaOH +CO2 → Na2CO3 + H2O
Взаимодействие с солями
Малолетучие оксиды вытесняют более летучие из их солей
SiO2 + Na2CO3→ CO2 + Na2SiO3
Окислительно – восстановительные реакции
Кислотные оксиды с высшими степенями окисления чаще всего являются сильными окислителями.
2Cl2O7 →2Cl2 + 7O2
Химические свойства оснований
1. Взаимодействие с оксидами
Основания взаимодействуют с кислотными и амфотерными оксидами с образованием солей
2. Взаимодействие с кислотами
Основания взаимодействуют с кислотами с образованием солей.
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
3. Взаимодействие с солями
Растворимые основания взаимодействуют с солями других металлов с образованием нового основания и новой соли (реакция протекает при условии, что образуется нерастворимое основания или соль)
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
4. Взаимодействие с основаниями
Основные основания реагируют с амфотерными с образованием комплексной соли
Al(OH)3 + NaOH → Na[Al(OH)4}
Взаимодействие с металлами
Некоторые металлы, образующие амфотерные оксиды (Al, Zn, Pb, Ga, Be, Sc) взаимодействую с щелочами с образованием комплексных солей
2Al + 2NaOH +6H2O → 2Na[Al(OH)4] + 3H2
Химические свойства кислот
Взаимодействие с оксидами
Кислоты взаимодействуют с амфотерными и основными оксидами с образованием солей.
2. Взаимодействие с основаниями
Кислоты взаимодействуют с основаниями с образованием солей.
Взаимодействие с солями
Кислоты взаимодействую с солями при условии выделения газа или образования осадка
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
BaCl2 + H2SO4 → BaSO4 + 2HCl
4. Взаимодействие с металлами
Кислоты взаимодействуют с металлами с образованием солей (или комплексных солей).
Химические свойства солей
Взаимодействие солей и металлов
Взаимодействие с металлами идет согласно электрохимическому ряду напряжений металлов – более активные металлы вытесняют менее активные из их солей (щелочные и щелочноземельные металлы взаимодействую с растворителем-водой, и поэтому не могут вытеснять менее активные металлы).
2. Взаимодействие с кислотами (см. выше).
3. Взаимодействие с щелочами (см. выше).
Взаимодействие солей с солями
Растворы солей взаимодействуют с раствором другой соли с образованием двух новых солей при условии образования осадка.
AgNO3 + NaCl → AgCl↓ + NaNO3
Взаимодействие с водой
Взаимодействие соли с водой называется гидролиз.
Гидролиз –обменная реакция между солью и водой. В больщинстве случаев реакция гидролиза обратима, но в процессе гидролиза pH (водородный показатель, характеризующий среду – кислая или щелочная) раствора изменяется, что свидетельствует о протекании химических реакций.
Существуют 4 варианта гидролиза солей:
1. Гидролиз соли образованной сильным основанием и слабой кислотой (гидролиз по аниону)
Na+ + CO32- + H2O ↔ Na+ + OH- + HCO3- (среда щелочная pH раствора больше 7).
Сильные основания – образованы катионами щелочных и щелочноземельных металлов, слабые основания – все остальные основания.
Слабые и сильные кислоты – см. выше
2. Гидролиз соли образованной слабым основанием и сильной кислотой (гидролиз по катиону).
NH4+ + Cl- + H2O ↔ NH4OH+ H+ + Cl- (среда кислая pH раствора меньше 7).
Если соль образованна слабым основанием многовалентного металла и сильной кислотой, то ее гидролиз будет протекать ступенчато.
Al3+ + 3Cl- + H2O ↔ Al(OH)2+ + H+ + 3Cl- (среда кислая pH раствора меньше 7 – 1-я ступень).
Al(OH)2+ + H2O ↔ Al(OH)2+ + H+ (2-я ступень)
Al(OH)2+ + H2O ↔ Al(OH)3+ H+ (3-я ступень)
3. Гидролиз соли образованной слабой кислотой и слабым основанием (гидролиз по катиону и аниону) – может протекать необратимо.
Сu2+ + 2CH3COO- + 2H2O↔ Cu(OH)2 + CH3COOH (pH среды зависит от степени диссоциации образующихся веществ).
2Al3+ + 3S2- + 3H2O → 2Al(OH)3 + 3H2S
4. Гидролиз соли, образованной сильной кислотой и сильным основанием, не происходит; характер среды не изменяется
Количественной характеристикой гидролиза является степень гидролиза и константа гидролиза.
Степень гидролиза
— это соотношение количества подвергающейся гидролизу соли nгидр и общего количества растворенной соли nобщ. Обычно, ее обозначают через hгидр (или α):
hгидр = (nгидр/nобщ)•100 %
Величина hгидр увеличивается с уменьшением силы образующих соль кислоты или основания.
Константа гидролиза
Представим в общем виде процесс гидролиза соли, в котором в роли соли выступает – МА, а НА и МОН — соответственно, кислота и основание, которые образуют данную соль:
MA + H2O ↔ HA + MOH
Применив закон действующих масс, запишем константу, соответствующую этому равновесию:
K = [HA]* [MOH]/[MA]*[H2O]
Известно, что концентрация воды в разбавленных растворах, имеет практически постоянное значение, поэтому ее можно включить в константу
K*[H2O]= Kг,
тогда для константы гидролиза соли Kг будет иметь такой вид:
Kг = [HA]*[MOH]/[MA]
По величине константы гидролиза можно судить о полноте гидролиза: чем больше ее значение, тем в большей мере протекает гидролиз.
Константа и степень гидролиза связаны соотношением:
Kг = С*h2/(1- h), моль/л
Где С – концентрация соли в растворе, h- степень гидролиза
Это выражение можно упростить, т.к. обычно h˂˂1, тогда
Kг = С*h2
Зная константу гидролиза можно вычислять pH среды.
Для многовалентных оснований гидролиз всегда будет протекать в большей степени по первой ступени, чем по второй и тем более по третей.
Номенклатура
Названия простых веществ
Простые вещества называют, как правило, так же, как и соответствующие элементы. Свои собственные названия имеют только аллотропные модификации углерода (алмаз, графит, карбин, фуллерены) и вторая модификация кислорода (озон). При названиях аллотропных модификаций остальных элементов обычно указывают ее краткую физическую характеристику (белый, красный, черный фосфор, кристаллическая и пластическая сера, серое и белое олово и т. д.).
Бинарные соединения
В формулах двухэлементных соединений, состоящих из металла и неметалла, символ металла записывают на первом месте, то есть слева, а символ неметалла – справа. В соединениях из двух металлов или неметаллов первым записывают символ элемента имеющего меньшее значение электроотрицательности. Кислород записывают на первом месте только в соединениях со фтором. Примеры: MnI2, FeO, CuAl2, FeNi3, XeO4, CH4, AsH3, H2S, BrF3, ClO2, OF2. Названия бинарных соединений составляют из двух слов. В русском языке первым словом обозначают более электроотрицательный элемент (реальный или условный анион), составляя его из латинского корня названия элемента с окончанием -ид, вторым словом является русское название менее электроотрицательного эле-мента (реального или условного катиона) в родительном падеже:
NaCl -хлорид натрия;
B2O3-оксид бора;
Al2S3-сульфид алюминия;
Mg3N2-нитрид магния.
В случае, если менее электроотрицательный элемент имеет несколько положительных степеней окисления, в названии следует указать либо его степень окисления, либо число атомов аниона, используя числовые приставки:
| приставка
| Кол-во атомов
| приставка
| Кол-во атомов
| приставка
| Кол-во атомов
|
| Ди-
|
| Тетра-
|
| Гекса-
|
|
| Три-
|
| Пента
|
| Гепта-
|
|
FeCl3 –хлорид железа(III);
FeCl2 - дихлорид железа;
SF6 - гексафторид серы;
SF4 - фторид серы(IV);
PbO2 - диоксид свинца;
PbO- оксид свинца(II);
Pb3O4 - оксид свинца (II, IV);
N2O4 - тетраоксид азота.
В последнем примере однозначность написания формулы по названию обусловлена отсутствием у азота степени окисления (VIII).
Если соединение содержит катионы нескольких металлов или анионы нескольких неметаллов, то при написании формулы придерживаются того же порядка, как и в случае соответствующих бинарных соединений, а называют вещество справа налево, используя дефис:
SnBrCl3 -трихлорид-бромид олова;
KNaCl2 - хлорид натрия-калия;
Cu2Cl2O - оксид-хлорид меди(II);
CaTiO3 - оксид титана(IV)-кальция;
Кислородсодержащие кислоты
Названия этого класса соединений строятся из группового слова «кислота» и прилагательного, которое составляется из русского корня названия элемента, окончания -ая- и суффиксов, указывающих, насколько степень окисления кислотообразующего элемента отличается от максимальной.
Для высшей или единственной степени окисления применяют суффиксы -н-, -ов-, -ев-:
H3BO3 - борная кислота; H2CO3 - угольная кислота;
H2SiO3 - кремниевая кислота; H2CrO4 - хромовая кислота;
HNO3 - азотная кислота; HPO3 - метафосфорная кислота;
HReO4 - рениевая кислота; H3PO4 - ортофосфорная кислота.
Приставки орто- и мета- применяют, чтобы различать названия кислот, молекулы которых отличаются только «содержанием воды».
Если возможны две степени окисления, то для низшей используют суффиксы -ист-, -овист-:
H2SeO3 - селенистая кислота; H2TeO3 - теллуристая кислота;
HAsO2 - метамышьяковистая кислота;
H3AsO3 - ортомышьяковистая кислота.
В случае трех возможных степеней окисления кислотообразующего элемента, помимо упомянутых суффиксов, для самой низкой (обычно +1) применяется составной суффикс -новатист-:
H3PO2 - фосфорноватистая кислота;
H2N2O2 - азотноватистая кислота.
В названиях кислот с четырьмя различными степенями окисления последовательно используют суффиксы -н-, -новат-, -ист- и -новатист-:
HClO4 - хлорная кислота; HClO3 - хлорноватая кислота;
HClO2 - хлористая кислота; HClO3 - хлорноватистая кислота.
Для того, чтобы различить кислоты, содержащие разное количество атомов кислотообразующего элемента в одной степени окисления, применяют числовые приставки:
H2Cr2O7 - дихромовая кислота; H2Cr3O10 - трихромовая кислота;
H2S2O5 - дисернистая кислота;
Оксокислоты, в которых атомы кислорода замещены на атомы серы (частично или полностью) или на пероксогруппы (-О-О-), по-лучают к своему названию приставку соответственно тио- или пероксо- (по необходимости, с числовой приставкой):
H2S2O3 (H2SO3S) - тиосерная кислота;
H2CS3 - тритиоугольная кислота;
HNO4 (HNO2(O2)) - пероксоазотная кислота;
H2S2O8 (H2S2O6(O2) - пероксодисерная кислота.
Название солей
Название солей неорганических соединений состоят из традиционных названий катионов и анионов. Если элемент в образуемых им оксоанионах проявляет одну степень окисления, то название аниона оканчивается на -ат:
(NH4)2CO3 - карбонат аммония; K4SiO4 - ортосиликат калия;
NaBiO3 - висмутат натрия; LiBO2 - метаборат лития.
В случае двух степеней окисления ещё используют окончание -ит:
BaSeO4 - селенат бария; FeAsO4 - ортоарсенат железа(III);
BaSeO3 - селенит бария; Fe(AsO2)2 - метаарсенит железа(II).
Если степеней окисления элемента в анионах может быть более двух, то для самой низкой (обычно +1) применяют приставку гипо- с окончанием -ит:
Na2N2O2 - гипонитрит натрия;
Названия анионов, образованных элементом в степени окисления +7, имеют приставку пер- и окончание -ат:
H3OClO4 - перхлорат оксония; KMnO4 - перманганат калия;
Ag5IO6 - ортопериодат серебра; SrIO4 - метапериодат стронция.
| Анион
| Традиционное название
| Техническое название
| Анион
| Традиционное название
| Техническое название
|
| CO32-
| Карбонат
| Углекислый
| PO32-
| Фосфит
| фосфористокислый
|
| NO3-
| Нитрат
| Азотнокислый
| PO42-
| Фосфат
| Фосфорнокислый
|
| NO2-
| Нитрит
| Азотистокислый
| ClO-
| гипохлорит
| хлорноватистокислый
|
| SO42-
| Сульфат
| Сернокислый
| ClO3-
| Хлорат
| хлорноватокислый
|
| SO32-
| сульфит
| Сернистокислый
| ClO4-
| Перхлорат
| Хлорнокислый
|
| SiO32
| Силикат
| Силикат
| MnO4-
| Перманганат
| Маргнцевокислый
|
(Большой энциклопедический словарь -http://www.vedu.ru/bigencdic/
Физический энциклопедический словарь. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983.
Белозерский Н.А. Карбонилы металлов — М.: Металлургподат, 1958. — 373 c.
Химическая энциклопедия / Под ред. И. Л. Кнунянца. — М: Большая Российская энциклопедия, 1992. — Т. 2. — С. 393—395.)
Лекция 5
Периодический закон и периодическая таблица химических элементов
Одной из важнейших проблем теоретической химии XIX века после разрешения проблемы атомных весов оставалась систематизация химических элементов, число которых постоянно росло. Со времён античности и средних веков были известны 14 элементов (хотя собственно элементами их стали считать лишь в конце XVIII века).
В XVIII веке к ним добавилось 20 новых элементов; к 1860 году число известных элементов возросло до шестидесяти. Проблема упорядочения элементов и отыскания закономерности в изменении их свойств становилась всё более актуальной. Создание периодической системы химических элементов стало результатом многолетней работы многих химиков.
Первую попытку систематизации элементов предпринял немецкий химик Иоганн Вольфганг Дёберейнер, сформулировавший в 1829 г. закон триад. Дёберейнер обратил внимание на то, что в рядах сходных по свойствам элементов наблюдается закономерное изменение атомной массы. В выделенных Дёберейнером триадах элементов атомный вес среднего элемента триады примерно равен полусумме атомных весов двух крайних элементов:
| Li
| Ca
| P
| S
| Cl
35.5
|
| Na
| Sr
| As
| Se
| Br
|
| K
| Ba
| Sb
| Te
| I
|
Хотя разбить все известные элементы на триады Дёберейнеру, естественно, не удалось, тем не менее, закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений.
В 1843 г. немецкий химик Леопольд Гмелин предложил таблицу химически сходных элементов – V-образное построение из триад, тетрад ипентад.

В 1850 г. Петтенкофер показал, что атомные веса некоторых химических элементов отличаются на величину, кратную восьми, предложил системаьтизацию элементов. К аналогичным выводам пришел в 1857 Ж. Дюма опубликовавший таблицу 32 элементов из 8 колонок.
В 1862 г. французский ученый Александр Эмиль Бетье де Шанкуртуа предложил систему элементов в виде графика. Он разместил все известные элементы в порядке увеличения массы атомов по винтовой линии, описанной вокруг цилиндра. Сходные элементы располагались друг под другом. Однако эта схема не получила конкретного анализа и развития, не указывала точное место элемента в системе.

Двумя годами позже, в 1864 г английский химик Джон Александер Рейна Ньюлендс расположил известные элементы в порядке возрастания атомных весов. Расположив элементы вертикальными столбцами по семь элементов в столбце, выяснилось, что сходные элементы, как правило, попадают в одни и те же горизонтальные ряды. Так, калий располагается вслед за очень похожим на него натрием, селен располагается в одном ряду с похожей на него серой, кальций - рядом с похожим на него магнием и т. д. Действительно, в соответствующем ряду можно было найти каждую из трех триад Дёберейнера. Ньюлендс назвал открытую им закономерность законом октав, так как каждый восьмой элемент обладал свойствами, сходными с первым, девятый - со вторым и т. д.
К сожалению, помимо рядов, содержащих сходные элементы, в таблице были ряды с совершенно непохожими элементами. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; также таблица не содержала свободных мест. Поэтому другие химики сочли такое совпадение случайным и отнеслись к открытию Ньюлендса как к не заслуживающему внимания факту.

В 1864 г английский химик Ульям Одлинг предложил таблицу, в которой в 17 вертикальных колонках были размещены 57 элементов.

В 1864-1870 Л. Мейер построив кривую атомных объемов и составил периодическую таблицу (таблица опубликована лишь в 1895 г.). Первый вариант таблицы вышел в 1864 г в книге «Новейшие теории химии и их значение для химической статики» и включал в себя 28 элементов размещенных в шести столбцах согласно валентности

Таблица Мейера 1864 г. (фрагмент)
Объединённая таблица, подготовленная им в 1868 г. для второго издания своей книги, была опубликована лишь в 1895 г.; в ней 52 элемента размещались в 15 столбцах. В 1870 г. Л. Майер опубликовал график зависимости атомного объёма элемента от атомного веса, имеющий характерный пилообразный вид. Таблица "Природа элементов как функция их атомного веса" состояла из девяти вертикальных столбцов, сходные элементы располагались в горизонтальных рядах; некоторые ячейки таблицы Мейер оставил незаполненными.

1 марта (17 февраля по старому стилю) 1869 г Д.И. Менделеев в статье «Соотношение свойств с атомным весом элементов» (в журнале Русского химического общества) публикует первую таблицу химических элементов – «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». В том же 1869 г. вышло и первое издание учебника "Основы химии", в котором была приведена периодическая таблица Менделеева.
При составлении таблицы Менделеев исправил атомные массы некоторых элементов, несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими, оставил незаполненные клетки для еще неоткрытых элементов.

В конце 1870 г. Менделеев доложил РХО статью "Естественная система элементов и применение её к указанию свойств неоткрытых элементов", в котором предсказал свойства неоткрытых ещё элементов – аналогов бора, алюминия и кремния (соответственно экабор - скандий, экаалюминий – галлий и экасилиций - германий).
В 1871 г. Менделеев в итоговой статье "Периодическая законность химических элементов" дал формулировку Периодического закона: "Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса. Тогда же Менделеев придал своей периодической таблице классический вид (т. н. короткая таблица).
В 1875 г., исследуя спектр цинковой руды, французский химик Поль Эмиль Лекок де Буабодран нашел новый элемент, который назвал галлием. При исследовании его свойств галлий соответствовал описанному Менделеевым экаалюминию (причем Менделеев указал Буабодрану на неверное определение плотности данного металла, позже правота Менделеева была подтверждена).
В 1879 г. шведский химик Ларе Фредерик Нильсон открыл новый элемент и назвал его скандием (в честь Скандинавии). Один из коллег Нильсона, шведский химик Пер Теодор Клеве, сразу же указал на сходство свойств скандия и описанного Менделеевым экабора.
Наконец, в 1886 г. немецкий химик Клеменс Александр Винклер открыл новый элемент, названный им германием (в честь Германии). Оказалось, что этот элемент идентичен экакремнию Менделеева.
Но существовали некоторые трудности, которые не могли быть решены в конце XIX века. Так, трудность нахождения места для тринадцати редкоземельных элементов, а также открытые У. Рамзаем (лауреат Нобелевской премии по химии в 1904 г.) и Дж. Рэлеем (лауреат Нобелевской премии по физики в 1904 г.) аргон и др. инертные газы.
В 1900-1902 гг. Д. И. Менделеев, Уильям Рамзай и Богуслав Браунер, известный своими работами по уточнению атомных масс химических элементов, произвели модернизацию периодической таблицы. Менделеев и Рамзай пришли к выводу о необходимости образования в таблице нулевой группы элементов, в которую вошли инертные газы. Нулевая группа прекрасно вписалась в периодическую таблицу; инертный газ явился элементом, переходным между галогенами и щелочными металлами. Браунер предложил решение проблемы размещения в таблице редкоземельных элементов. По его мнению, РЗЭ составляют особую группу периодической системы: "Подобно тому, как в Солнечной системе целая группа астероидов занимает полосу на месте пути, по которому должна бы двигаться одна планета, так точно целая группа элементов редких земель могла бы занять в системе одно место, на котором в другом случае стоит один элемент... Таким образом, все эти элементы, очень подобные один другому, стали бы на том месте в IV группе восьмого ряда, которое до сих пор занимал церий... Элементы редких земель создали бы особую интерпериодическую группу, аналогичную до некоторой степени восьмой группе, поместившись в середине остальных групп периодической системы..." Шестой период таблицы, таким образом, должен быть длиннее, чем четвёртый и пятый, которые в свою очередь длиннее, чем второй и третий периоды. В коротком варианте периодической таблицы Браунер предложил поместить все РЗЭ в одну клетку четвёртой группы.
В 1913 г. Н. Бор (лауреат Нобелевской премии по физики в 1922 г.) объяснил сущность периодичности на основе теории строения атома. В этом же году Г. Мозли установил зависимость между частотой спектральных линий характеристического рентгеновского излучения и атомным номером излучающего элемента. Зависимость была названа в честь первооткрывателя законом Мозли. Это фундаментальное открытие имело огромное значение для установления физического смысла периодической системы элементов и атомного номера и для подтверждения правильности концепции планетарного атома.
Современная формулировка периодического закона:
Периодическое изменение свойств элементов и их соединений зависит от периодически повторяющейся подобной структуры электронной оболочки их атомов.
Строение таблицы
Наглядным выражением периодического закона является периодическая система элементов.
В периодической системе каждый элемент имеет свой порядковый номер, смысл которого теперь совершенно ясен: этот номер равен заряду ядра атома и числу электронов в оболочке атома.
Современный вариант периодической системы утвержден Международным союзом по теоретической (чистой) и прикладной химии – ИЮПАК – в 1989 году.
Система элементов слагается из периодов (горизонтальные строки) и групп (вертикальные столбцы).
Периодов в системе семь: 1 – 3 –малые, остальные – большие. Номер периода указывает на число уровней в атоме данного элемента.
Групп в системе - 18, они обозначаются арабскими цифрами.

Вариант таблицы используемая в России –7 периодов (горизонтальные ряды) и 8 групп (вертикальные ряды). Группы делятся на главные (заполняются s- и p- электроны внешнего уровня) и побочные (заполняются d-электроны предвнешнего и f-электроны предпредвнешнего уровня).

Номер группы – количество электронов на внешнем уровне (для главной подгруппы) – максимальная положительная степень окисления элемента (кроме кислорода, фосфора и благородных газов).
Электроотрицательность атома, величина, характеризующая способность атома в молекуле притягивать электроны, участвующие в образовании химической связи. Известно несколько способов вычисления Э. Так, согласно Р. Малликену (1935), мерой Э. может служить сумма ионизационного потенциала атома и его сродства к электрону; Л. Полинг предложил (1932) другой, более сложный способ вычисления. Оказалось, однако, что все способы практически приводят к одинаковым результатам.
Степень окисления - численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Изменение свойств
|
Уменьшается радиус атома
Увеличивается энергия ионизации (энергия необходимая для отрыва 1 электрона)
Увеличивается электроотрицательность
Уменьшаются металлические свойства
|
| Увеличение радиуса атома
Уменьшается энергия ионизации
Увеличиваются металлические свойства
Уменьшение электроотрицательности
|

рис. Изменение радиусов по периоду и по группе. 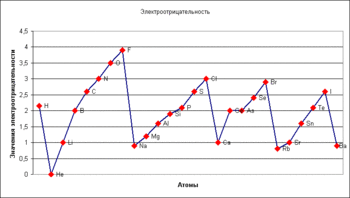
рис. Изменение электроотрицательности
Лекция 6
Химическая связь
Общие положения.
Молекулы химических веществ представляют собой сложную систему атомных ядер и электронов. Атомы в молекуле удерживаются преимущественно силами электростатического характера. В этом случае говорят, что они связаны химической связью. Химическая связь осуществляется s- и p-электронами внешнего и d-электронами предпоследнего слоя. Эта связь характеризуется следующими параметрами:
1. Длиной связи – межъядерным расстоянием между двумя химически связанными атомами.
2. Валентным углом – углом между воображаемыми линиями, проходящими через центры химически связанных атомов.
3. Энергией связи – количеством энергии, затрачиваемой на ее разрыв в газообразном состоянии.
4. Кратностью связи – числом электронных пар, посредством которых осуществляется химическая связь между атомами.
Атом в молекуле – понятие условное, т. к. его энергетическое и электронное состояние в корне отличается от изолированного атома. Если мы будем сближать два протона, то между ними возникнут силы отталкивания, и о получении устойчивой системы говорить не приходится.
В образовании химической связи участвуют s-, p- и d-электроны, имеющие различную геометрическую конфигурацию электронных облаков и различные знаки волновых функций в пространстве. В зависимости от симметрии электронных облаков, в результате перекрывания которых образуется химическая связь, суммарное электронное облако будет иметь различную симметрию, в соответствии с которой они распадаются на три вида: σ-, π- и δ- связи.
σ-связь осуществляется при перекрывании облаков вдоль линии, соединяющей центры атомов, при этом максимальная электронная плотность достигается в межъядерном пространстве и имеет цилиндрическую симметрию относительно линии, соединяющей центры атомов.
Как видно из рис. 2.4., в образовании σ-связи в силу своей шаровой симметрии всегда принимают участие s-электроны. Они образуют σ -связь в
результате перекрывания со следующими электронами другого атома: s-, рХ-, d(x2-y2)-электронами. Возможность образования σ-связи s-электронами не исчерпывается, она может образоваться в случае перекрывания и других электронных облаков, таких, как двух pX или pX и d(x2-y2).

Рис.2.4. Некоторые примеры образования σ-связей.

Рис. 2.5. Примеры π- и δ -связей.
π -связи возникают при перекрывании электронных облаков над и под линией, соединяющей центры атомов. Суммарные электронные облака также симметрично расположены относительно этой оси, но они не имеют цилиндрической симметрии, как в случае σ-связи. В силу своего пространственного расположения π-связь образуют электроны на таких парах орбиталей как pY – pY, pZ – pZ, pY – dXY.
δ -связь образуют только d-электроны за счет перекрывания всех четырех своих лепестков электронных облаков, расположенных в параллельных плоскостях. Такое возможно, когда в образовании связиучаствуют dXY – dXY, dXZ – dXZ, dYZ – dYZ-электроны.
Выше была рассмотрена классификация химических связей, исходя из симметрии электронных облаков. Существует и другой подход к классификации химической связи, основанный на характере распределения электронной плотности между атомами в молекуле, т. е. химическая связь рассматривается с точки зрения принадлежности электронной пары тому или иному атому. Возможны три случая:
1) Электронная пара связывает в молекуле два одинаковых атома. В этом случае она в равной мере принадлежит им обоим. В молекуле нет разделения центров тяжести положительного и отрицательного зарядов. Они совпадают, и такая связь называется ковалентной неполярной.
2) Если же электронная пара связывает два различных атома, то она смещается в сторону более электроотрицательного атома. Центры тяжестиположительного и отрицательного зарядов разделяются, связь становитсяполярной и носит название ковалентной полярной связи.
3) Третий случай связан с полной передачей электронной пары во владение одного из атомов. Это происходит при взаимодействии двух атомов, резко отличающихся по электроотрицательности, т. е. способности удерживать электронную пару в своем электрическом поле. При этом атом, отдавший электроны, становится положительно заряженным ионом, а атом, принявший их, – отрицательным. В этом случае связь носит название ионной.
Характер связи во многом определяет физико-химические свойства веществ.
Метод валентных связей
В методе валентных связей химическая связь рассматривается как двухэлектронная и двухцентровая, т. е. пара электронов, образующих связь, локализована в пространстве между двумя атомами и находится в их общем пользовании. Возможны два механизма образования общей электронной пары. Первый называется обменными заключается в спаривании двух электронов, принадлежащих разным атомам и имеющим противоположные спины. Его можно выразить следующей схемой:

Второй механизм, называемый донорно-акцепторным, приводит к образованию химической связи за счет предоставления одним атомом в общее пользование пары электронов, а другим – свободной орбитали.
Атом, предоставляющий электронную пару, называется донором, а атом,
имеющий свободную орбиталь, – акцептором. Схема образования связи в этом случае выглядит так:

Для элементов второго периода происходит распаривание s-электронов и переход их на p-подуровень c образованием новых уровней, на которых энергии электронов, находящихся уже на орбиталях другого типа, одинаковы. А раз это так, то по правилу Хунда, в атоме появляется максимальное число неспаренных электронов. Эта гипотеза получила название явления гибридизации, а орбитали, образующиеся в результате усреднения энергий подуровней, называются гибридными. Естественно, что при этом меняются и форма электронных облаков, и их расположение в пространстве. В зависимости от того, какие орбитали участвуют в образовании гибридныхорбиталей, рассматривают различные типы гибридизации и пространственные конфигурации образовавшихся гибридных орбиталей. Число получившихся гибридных орбиталей должно быть равно общему числу орбиталей, вступивших в гибридизацию. В зависимости от того, какие орбитали взаимодействуют между собой, рассматривают несколько типов гибридизации:
sp-гибридизация. В этом явлении принимают участие s- и одна p-орбитали, и в результате образуются две орбитали нового типа, которые называются sp-гибридными. Эти орбитали имеют форму, показанную на рисунке, оси их лежат на одной прямой, образуя угол 1800. В образовании связей в молекуле BeH2 принимают участие sp-гибридные орбитали атомабериллия и молекула имеет линейное строение;

Рис. Пространственное расположение электронных облаков для различных типов гибридизации.
sp2-гибридизация. Во взаимодействие вступают s- и две p-орбитали, в
результате чего образуются три орбитали нового типа, которые называются
sp2-гибридными. Оси этих орбиталей лежат в одной плоскости, и углы между ними равны 1200. Например, атом бора в молекуле BF3 находится в sp2 -гибридном состоянии, и эта молекула имеет форму правильного треугольника с атомом бора в центре.
sp3-гибридизация. В этом случае исходными являются s- и три p-орбитали. В результате гибридизации образуются четыре новые орбитали –sр3-гибридные. Оси этих орбиталей направлены от центра квершинам тетраэдра, углы между осями равны 109028′. CH4 – молекуламетана, где реализуется этот тип гибридизации, имеет тетраэдрическоерасположение атомов водорода.
В молекуле аммиака (NH3) атом азота тоженаходится в sp3-гибридном состоянии, три пары электронов являютсяобщими с атомами водорода и участвуют в образовании связей, а однаэлектронная пара (неподеленная электронная пара) принадлежит толькоатому азота.





















