ПАТОФИЗИОЛОГИЯ КЛЕТКИ
«Клетка – осязаемый субстрат патологической физиологии: она краеугольный камень в твердыне научной медицины» Р. Вирхов
Физиология клетки
Клетка – это высокоорганизованная, саморегулирующая структурно-функциональная единица живого организма
с труктурные компоненты клетки
К л е т к а
Плазмолемма
(внешняя клеточная мембрана)
Ядро
(кариолемма, кариоплазма, ядрышко)
Цитоплазма
| Гиалоплазма
| Органеллы
| Включения
а) трофические
б) секреторные
в) пигментные
|
| мембранные:
- митохондрии;
- эндоплазматическая сеть;
- комплекс Гольджи;
- лизосомы;
| немембранные:
- рибосомы, полисомы;
- центриоли (клеточный центр);
- микротрубочки;
- микрофиламенты;
|
Повреждение клетки
Повреждение (альтерация, от лат. alteratio - изменение) – это структурные изменения, сопровождающиеся нарушением жизнедеятельности.
Повреждение клетки – типовой патологический процесс, основу которого составляют нарушения внутриклеточного гомеостаза, приводящие к нарушению структурной целостности клетки и ее функциональных способностей.
Этиология. Действие патогенных факторов на клетку
Первичное (прямое) повреждение возникает в результате непосредственного воздействия на клетку патогенного фактора.
Первичные повреждающие клетку факторы вызывают специфические, присущие только им эффекты:
ü механические - вызывают нарушение целостности структуры ткани, клеток, межклеточных и субклеточных структур;
ü термические - связаны с денатурацией белков, белково-липидных комплексов и изменением вторичной структуры нуклеиновых кислот;
ü химические - угнетают активность ферментов, блокируют клеточные рецепторы, вызывают перестройку молекул за счет гидролиза, переаминирования и т.п.;
ü радиационные - приводят к разрушению молекул с образованием свободных радикалов.
Независимо от природы первичного повреждающего фактора, ответная реакция поврежденной клетки стандартна и называется неспецифической реакцией клетки на повреждение.
Причина стандартного ответа заключается в том, что при любом повреждении обязательно:
üнарушаются барьерные функции мембран клеточной и внутриклеточной;
üвыключаются ионные насосы;
üразвивается ацидоз;
üвыделяются медиаторы.
Вторичное (косвенное, опосредованное) повреждение возникает как следствие первичных нарушений постоянства внутренней среды клетки за счет цепи вторичных реакций.
Вторичные повреждение реализуются через:
ü систему медиаторов;
ü нарушения циркуляции оксигенированной крови;
ü нарушения нейрогуморальной регуляции;
ü изменения иммунного статуса;
ü изменения параметров гемостаза.
Медиаторы повреждения
Поврежденные клетки выделяют большое количество биологически активных веществ, оказывающих свое влияние на клетку и ее элементы, которые находятся вне зоны повреждения. Эти биологически активные вещества называют «медиаторы повреждения». Медиаторы способствуют развитию воспалительных и аллергических реакций.
Клеточные медиаторы повреждения
| Медиатор
| Механизм действия
|
| Гистамин
Серотонин
Ацетилхолин
Адреналин
Лизосомаль-ные ферменты
| Освобождается тучными клетками и базофилами.
Расширяет артериолы и суживает венулы, повышает давление в капиллярах, способствует проницаемости гистогематического барьера.
Вырабатывается базофильными лейкоцитами, тромбоцитами. Усиливает эффект гистамина.
Выделяется возбужденными холинергическими структурами. Расширяет сосуды, стимулирует развитие артериальной гиперемии.
Вырабатывается возбужденными адренергическими структурами. Вызывает первоначальный спазм сосудов, способствует снижению их проницаемости.
Вырабатываются моноцитами и гранулоцитами. Расщепляют белки (протеиназы), липиды (липазы), углеводы (амилазы), продолжают деструктивные процессы в тканях.
|
Виды повреждения клетки
1. В зависимости от скорости повреждения:
а) острое повреждение, развивается быстро, как правило, в результате однократного, но интенсивного повреждающего воздействия;
б) хроническое повреждение, развивается медленно, является следствием многократных, но менее интенсивных патогенных влияний.
2. В зависимости от периода жизненного цикла соматических клеток:
а) митотическое повреждение, когда патогенный фактор действует на клетку в момент деления;
б) интерфазное повреждение, когда патогенный фактор действует на клетку в период между делениями.
3. В зависимости от степени нарушения внутриклеточного гомеостаза:
а) обратимое (сублетальное);
б) необратимое (летальное).
Повреждение клетки носит обратимый характер, когда нарушения внутриклеточного гомеостаза устраняются при мобилизации внеклеточных и внутриклеточных защитных механизмов.
Необратимые повреждения клеток развиваются, когда нарушения внутриклеточного гомеостаза не устраняются при вовлечении внеклеточных и внутриклеточных защитно-компенсаторных механизмов.
4. В зависимости от характера основных проявлений:
а) специфическое повреждение, т.е. характерное только для какого-то конкретного болезнетворного агента,
б) неспецифическое повреждение, т.е. характерное для действия разнообразных повреждающих агентов.
Повреждение ядра
Типовые последствия повреждения ядра
Повреждение клеточного ядра вызывает несколько типовых защитных реакций (рис. 8):
ü активация репаразной системы (синтеза различных видов РНК, белков) и апоптоза поврежденной клетки;
ü активация репликации ДНК (метилирования и АДФ-рибозилирования) и стимуляция митотической активности;
ü экспрессия аварийных генетических программ;
ü мутации.
Однако каждый из этих механизмов сочетает как защитные так и вторичные повреждающие эффекты.
Аварийные генетические программы клетки
В поврежденных клеточных ядрах происходит включение целого ряда аварийных генетических программ, считывание которых в нормальных условиях отсутствует или минимально.
К ним относят:
ü гены белков теплового шока (БТШ);
ü немедленные гены предранней реакции (НГПР);
ü антионкогены;
ü гены-индукторы запрограммированной клеточной гибели;
ü антиген стареющих и поврежденных клеток (АСК).
А) Белки теплового шока
БТШ – фактор неспецифической клеточной реактивности, индуцируется при повреждении клетки и взаимодействуя с микротрубочками и микрофиламентами стабилизируют цитоскелет, повышая устойчивость клеток к механическому повреждению, денатурации и коагуляции цитоплазматических белков, гипоксии, предохраняют клетку от апоптоза, некроза и аутолиза.
С возрастом способность клеток генерировать БТШ снижается (один из возможных механизмов клеточного старения).
Б) Немедленные гены предранней реакции (нгпр)
НГПР – активаторы клеточной пролиферации: подготавливают клетку к репаративным процессам при повреждении, регулируют рост клеток и их апоптоз в эмбриогенезе, участвуют в процессах опухолевого роста.
В) Антионкогены (гены – опухолевые супрессоры)
Антионкогены останавливают митотический цикл в мутировавших клетках, что запускает рапаразные механизмы или апоптоз клеток с поврежденной ДНК.
Г) Антиген стареющих и поврежденных клеток
АСК является частью механизма запрограммированного устранения клеток, которые исчерпали свой генетический ресурс вследствие изнашивания или повреждения.
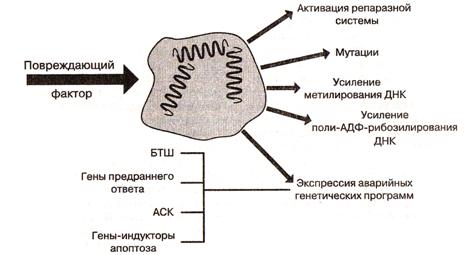
Рис. 8 – типовые последствия повреждения клеточного ядра
Мутации
Мутации - стойкое изменение структуры ДНК, не запрограммированное в геноме.
Агенты, вызывающие образование мутаций, называются мутагенами:
ü физические (ИО, УФЛ);
ü химические (веществава с большой внутренней энергией связи, модификаторы и аналоги основной ДНК);
ü биологические (бактерии, токсины, вирусы).
Существуют агенты, модифицирующие эффекты мутагенов:
ü комутагены – факторы, потенцирующие действие мутагенов;
ü десмутагены – химические соединения, уменьшающие активность мутагенов;
ü антимутагены – вещества, ослабляющие действие мутагенов.
Классификация мутаций
(по степени структурных изменений генома)
1. Геномные мутации – изменение числа хромосом без их структурных изменений:
а) полиплоидия – кратное повышение числа хромосом;
б) анеуплоидия – кратное уменьшение числа хромосом;
2. Хромосомные мутации (аномалии) – структурные перестройки хромосом (выявляются при световой микроскопии):
а) делеция – потеря участка хромосомы;
б) дубликация – удвоение участка хромосомы;
в) инверсия – поворот участка хромосомы на 180°;
г) транслокация – перемещение участка хромосомы;
3. Генные (точечные) мутации – минимальные, касающиеся отдельных нуклеотидов, изменения в молекуле ДНК, не выявляемые при свето-вой микроскопии:
а) транзиции - замена пурина на пурин (А-Г);
б) трансверсии – замена пурина на пиримидин (А, Г на Т, Ц) или пиримидина на пурин (Т, Ц на А, Г).
В зависимости от локализации различают мутации соматических и половых клеток.
Следствием мутации соматических клеток могут явиться:
ü активация механизмов канцерогенеза;
ü стимуляция процессов клеточного старения;
ü изменение антигенной структуры клеток;
ü прекращение синтеза или синтез измененного белка;
ü гибель клетки.
Мутация половых половых клеток приводит к развитию наследственных патологий.
Повреждение митохондрий
Реакции митохондрий на повреждение (рис. 10)
1) Набухание митохондрий (изменение объема):
ü анизотоническое, связанное с изменением осмотического давления окружающей среды (обратимое);
ü набухание, связанное с изменением клеточного дыхания (необратимое).
2) Гигантизм митохондрий (срастание нескольких митохондрий в одну);
3) Расщепление и фрагментация митохондрий;
4) Изменение структуры кристалликов митохондрий (размеров, формы, числа);
5) Увеличение числа и размеров митохондрий;
6) Вакуолизация, просветление или уплотнение матрикса.
Последствия повреждения митохондрий
ü Разобщение процессов окислительного фосфорилирования и синтеза АТФ;
ü Нарушается пространственная сопряженность ферментов системы цитохромов;
ü Снижается активность ферментов цикла Кребса;
ü Подавляются все энергозависимые реакции клетки: синтез белка, трансмембранный перенос ионов, мышечное сокращение;
ü Активизируется гликолиз, накапливаются пировиноградная и моло-чная кислоты, возникает внутриклеточный ацидоз, дестабилизация мембраны.

Рис.10 -. Виды повреждений митохондрий
A – нормальная митохондрия; Б – дегрануляция митохондриального матрикса; В – сжатие и уплотнение митохондриального матрикса; Г – увеличение объема, фрагментация крист и разрыв наружной мембраны; Д – конденсация разрушенного материала; Е – образование трубочек; Ж и З – накопление пластинчатых крист, контактирующих с внутренней мембраной; И – кальцификация митохондрий; К – начало деления митохондрий: разделение перегородкой на две части; Л – полное деление митохондрий; М – паракристаллические включения; Н – мегамитохондрия (двойной стрелкой показаны обратимые изменения).
Повреждение лизосом
Патологическая активность лизосом зависит в основном от двух факторов: состояния (стабилизации) мембран лизосом и активности их ферментов.
А) Дестабилизация (лабилизация) мембран лизосом – повышение проницаемости, появление трещин и разрывов.
Причины: ▪ ионизирующая радиация;
▪ шок;
▪ гиповитаминозы;
▪ бактериальные эндотоксины.
Патогенез: выход гидролаз в цитоплазму ведет к аутолизу и некрозу клетки.
Б) Стабилизация мембран лизосом – уменьшение проницаемости.
Причины: противовоспалительные и антибактериальные препараты; антиоксиданты.
Патогенез: повышение резистентности клеток к патогену (анормальные и растянутые лизосомы).
В) Недостаток лизосомальных ферментов (лизосомные болезни, болезни накопления) – замедление или остановка разрушения метаболитов при их нормальном синтезе: гликогенозы, липидозы, гепатозы.
Общая черта лизосомных болезней: нарушение психомоторного развития и иммунитета.
Повреждение пероксисом
Увеличение их числа в гепатоцитах описано при применении медикаментов, снижающих уровень липидов в крови, вирусном гепатите, лептоспирозе, в кардиомиоцитах при длительном воздействии этанола. Уменьшение числа пероксисом и снижение синтеза их ферментов наблюдается в печени при воспалении, а также при опухолевом росте. Разрушение пероксисом отмечается при гиперлипидемии и гиперхолестеринемии
Последствия повреждения пероксисом
1. Наследственный дефект, связанный с отсутствием пероксисом, абсолютно смертелен и приводит к гибели молодняка через несколько месяцев при явлениях иммунодефицита и гипоксии.
2. Альтерация пероксисом способствует образованию свободных радикалов => нарушение утилизации жирных кислот (формирование детергентов) => омыление клетки и разрушение мембран (эндогенный детергентный эффект).
Набор заданий для проверки достижения конкретных целей обучения:
Тестовые задания:
- Укажите последствия увеличенного содержания внутриклеточного кальция при ишемическом повреждении клетки:
a) активация фосфолипаз, интенсификация перекисного окисления липидов, нарушение энергетической функции митохондрий;
b) повышение резистентности клетки к патогену, замедление разрушения метаболитов
- Денатурация белков и белково-липидных комплексов клетки специфична для повреждения …
a) термическим фактором;
b) химическим фактором;
c) механическим фактором;
d) лучевым фактором.
- Блокирование клеточных рецепторов и угнетение активности клеточных ферментов специфично для повреждения…
a) термическим фактором;
b) химическим фактором;
c) механическим фактором;
d) лучевым фактором.
- Укажите последствия выраженного ацидоза при ишемическом повреждении кардиомиоцитов:
a) угнетение Ca++-транспортирующей функции саркоплазматического ретикулума, активация перекисного окисления липидов, снижение сократительной функции миофибрилл;
b) активация Na+/K+-АТФ-азы и ферментов креатинкиназной системы, инактивация лизосомальных протеаз и фосфолипаз.
- Механизмы повреждения клетки:
a) повышение сопряженности окислительного фосфорилирования и активности ферментов системы репарации ДНК;
b) усиление свободнорадикального окисления липидов, выход лизосомальных ферментов в гиалоплазму, экспрессия онкогена
- Прямыми последствиями снижения pH в поврежденной клетке являются:
a) активация лизосомальных фосфолипаз и протеаз, снижение синтеза ДНК, повышение проницаемости и лизосомальных мембран, изменение конформационных свойств мембранных белков;
b) повышение сопряженности окислительного фосфорилирования и активности ферментов системы репарации ДНК.
- Назовите главные механизмы повреждения клетки при чрезмерном действии УФ-лучей:
a) активация фосфолипаз, интенсификация перекисного окисления липидов, нарушение генетического аппарата клетки;
b) гиперполяризация цитоплазматической мембраны, образование ковалентных сшивок между липидными и белковыми молекулами
- Какое действие на мембраны клеток оказывают амфифильные соединения в высоких концентрациях:
a) повышают проницаемость мембраны клетки, агрегируют в мицеллы и внедряются в мембрану, вытесняют ионы кальция из мембраны, разрушают липидный бислой мембраны клетки;
b) понижают проницаемость клеточной мембраны и внутриклеточный рН, стабилизизуют мембрану органоидов клетки.
- Назовите основные причины активации фосфолипаз при повреждении клетки:
a) повышение внутриклеточного содержания ионов кальция, снижение внутриклеточного pH, интенсификация перекисного окисления липидов;
b) активация Na+/K+-АТФ-азы и ферментов креатинкиназной системы, инактивация лизосомальных протеаз и фосфолипаз.
- Укажите органеллы, защищающие клетку от чрезмерного накопления в ней ионизированного кальция:
a) митохондрии, саркоплазматический ретикулум;
b) рибосомы, лизосомы;
c) центриоли и вакуоли.
- Какими ионами, главным образом, активируются в поврежденной клетке мембраносвязанные фосфолипазы:
a) Ca++;
b) H+;
c) Na+
12. Какими ионами, главным образом, активируются в поврежденной клетке фосфолипазы и протеазы лизосом
a) Ca++;
b) H+;
c) Na+
- Какие из перечисленных веществ ослабляют повреждающее действие свободных радикалов на клетку:
a) глютатионпероксидаза, супероксиддисмутаза, препараты селена, витамин Е;
b) ионол, убихиноны, радикалы липидов, нитроксиды.
- Какие из перечисленных ниже веществ обладают свойствами антиоксидантов:
a) токоферолы, каталаза, глютатионпероксидаза, препараты селена;
b) нитроксиды, убихиноны, фосфолипиды, агликозидазы.
- Чем сопровождается увеличение содержания свободного ионизированного кальция в клетке:
a) активацией фосфолипазы А2, активацией перекисного окисления липидов, увеличением выхода K+ из клетки, гипергидратацией клетки;
b) снижением проницаемости клеточной мембраны и внутриклеточного рН, стабилизизацией мембраны органоидов клетки.
- Назовите последствия активации перекисного окисления липидов (ПОЛ) клеточных мембран:
a) уменьшение гидрофобности липидов, изменение конформации рецепторных белков, увеличение внутриклеточного содержания ионов кальция, нарушение структурной целостности цитоплазматической мембраны,
b) повышение сопряженности окислительного фосфорилирования и активности ферментов системы репарации ДНК.
- Укажите «неспецифические» проявления повреждения клетки:
a) денатурация молекул белка, усиление перекисного окисления липидов, инактивация мембраносвязанных ферментов;
b) лабилизация мембран лизосом, ацидоз, выделение медиаторов, нарушение барьерной функции мембраны клетки.
- Способствует ли усиление процессов перекисного окисления липидов в поврежденной клетке улучшению ее энергообеспечения:
a) нет;
b) да.
- Могут ли ионы кальция влиять на процессы перекисного окисления липидов:
a) нет;
b) да.
Ситуационные задачи:
Задача 1.
С целью моделирования гемолитической анемии мышам ввели фенилгидразин, который избыточно активирует в клетках свободнорадикальные реакции. Через полчаса после введения фенилгидразина в крови животных обнаружено снижение количества эритроцитов, присутствие свободных форм Hb и метгемоглобина.
Вопрос. Каковы возможные механизмы повреждения мембран эритроцитов?
Ответ. Фенилгидразин активирует генерацию избытка активных форм кислорода (супероксидного радикала и его производных) с последующим образованием липидных радикалов и гидроперекисей. Возникающие при этом повреждения бимолекулярного фосфолипидного слоя мембран характеризуются образованием в них брешей (кластеров повышенной проницаемости) и снижением эффективности работы мембранных ионных насосов. Это ведёт к накоплению избытка Nа+ в эритроцитах с увеличением внутриклеточного осмотического давления. В результате происходит гипергидратация и гемолиз эритроцитов.
Задача 2.
В лаборатории исследовали клеточные эффекты вещества, входящего в состав отходов одного из химических производств. Вещество вносили в монокультуру нормальных эпителиальных клеток в токсической концентрации. Наличие признаков повреждения клеток оценивали каждые 30 мин на протяжении 3 ч. Через 3 ч инкубации выявили гибель 85% клеток.
Вопросы и задание:
1. Какие морфологические и биохимические критерии Вы можете предложить для оценки обратимого («А») и необратимого («Б») повреждения эпителиальных клеток в данном эксперименте?
2. Назовите последовательность патологических изменений в клетке и их механизмы (основываясь на предложенных Вами критериях оценки повреждения клеток.
Ответы
1.А. Признаками обратимого повреждения клетки (и методами их выявления) являются:
· умеренное увеличение объёма клеток (определяется морфологически),
· накопление лактата во внеклеточной среде (выявляется биохимическими методами),
· увеличение концентрации К+ во внеклеточной среде (выявляется пламенной фотометрией),
· снижение мембранного потенциала (определяется электрофизиологическими методами),
· распад полисом (выявляется морфологически),
· снижение активности митохондриальных ферментов (определяется био- и гистохимически).
1.Б. К признакам необратимого повреждения клеток тносят:
· нарушение целостности плазматических мембран,
· распад ядер,
· деструкцию митохондрий,
· повышение рН клетки с развитием внутриклеточного алкалоза,
· увеличение сорбционных свойств клеток (определяется радиоактивным методом — обычно используется радиоактивный технеций 99),
· накопление в клетках белков внеклеточного происхождения (выявляется гистофлюоресцентным методом),
· наличие в инкубационной среде ферментов цитозольного (лактатдегидрогеназа) и митохондриального (креатинфосфокиназа) происхождения.
2. Нарушение энергетического обмена в клетках сопровождается накоплением избытка К+ и лактата в инкубационной среде. Это обусловлено снижением эффективности работы ионных насосов, активацией гликолиза, уменьшением ингибирующего действия АТФ на ключевые ферменты гликолиза.
Снижение содержания гликогена свидетельствует о стимуляции гликогенолиза. Одновременно с этими процессами происходит набухание клеток вследствие их гипергидратации, вызванной аккумуляцией в клетках Na+, фосфата и лактата. Уменьшение мембранного потенциала связано с накоплением в клетках Na+ и Са2+.
Активность митохондриальных ферментов подавлена вследствие их прямого повреждения или альтерации мембран токсичным агентом. Эти процессы обратимы и могут прекращаться после отмывки токсичного препарата.
В дальнейшем могут происходить необратимые изменения, которые характеризуются деструкцией плазматических мембран. Это приводит к выходу из клеток ферментов и накоплению в них экстраклеточных белков.
О необратимом повреждении клеток могут свидетельствовать также накопление в них технеция, распад митохондрий и ядер, повышение внутриклеточного рН вследствие накопления избытка азотистых оснований.
ПАТОФИЗИОЛОГИЯ КЛЕТКИ
«Клетка – осязаемый субстрат патологической физиологии: она краеугольный камень в твердыне научной медицины» Р. Вирхов
Физиология клетки
Клетка – это высокоорганизованная, саморегулирующая структурно-функциональная единица живого организма
с труктурные компоненты клетки
К л е т к а
Плазмолемма
(внешняя клеточная мембрана)
Ядро
(кариолемма, кариоплазма, ядрышко)
Цитоплазма
| Гиалоплазма
| Органеллы
| Включения
а) трофические
б) секреторные
в) пигментные
|
| мембранные:
- митохондрии;
- эндоплазматическая сеть;
- комплекс Гольджи;
- лизосомы;
| немембранные:
- рибосомы, полисомы;
- центриоли (клеточный центр);
- микротрубочки;
- микрофиламенты;
|
Повреждение клетки
Повреждение (альтерация, от лат. alteratio - изменение) – это структурные изменения, сопровождающиеся нарушением жизнедеятельности.
Повреждение клетки – типовой патологический процесс, основу которого составляют нарушения внутриклеточного гомеостаза, приводящие к нарушению структурной целостности клетки и ее функциональных способностей.
Этиология. Действие патогенных факторов на клетку
Первичное (прямое) повреждение возникает в результате непосредственного воздействия на клетку патогенного фактора.
Первичные повреждающие клетку факторы вызывают специфические, присущие только им эффекты:
ü механические - вызывают нарушение целостности структуры ткани, клеток, межклеточных и субклеточных структур;
ü термические - связаны с денатурацией белков, белково-липидных комплексов и изменением вторичной структуры нуклеиновых кислот;
ü химические - угнетают активность ферментов, блокируют клеточные рецепторы, вызывают перестройку молекул за счет гидролиза, переаминирования и т.п.;
ü радиационные - приводят к разрушению молекул с образованием свободных радикалов.
Независимо от природы первичного повреждающего фактора, ответная реакция поврежденной клетки стандартна и называется неспецифической реакцией клетки на повреждение.
Причина стандартного ответа заключается в том, что при любом повреждении обязательно:
üнарушаются барьерные функции мембран клеточной и внутриклеточной;
üвыключаются ионные насосы;
üразвивается ацидоз;
üвыделяются медиаторы.
Вторичное (косвенное, опосредованное) повреждение возникает как следствие первичных нарушений постоянства внутренней среды клетки за счет цепи вторичных реакций.
Вторичные повреждение реализуются через:
ü систему медиаторов;
ü нарушения циркуляции оксигенированной крови;
ü нарушения нейрогуморальной регуляции;
ü изменения иммунного статуса;
ü изменения параметров гемостаза.
Медиаторы повреждения
Поврежденные клетки выделяют большое количество биологически активных веществ, оказывающих свое влияние на клетку и ее элементы, которые находятся вне зоны повреждения. Эти биологически активные вещества называют «медиаторы повреждения». Медиаторы способствуют развитию воспалительных и аллергических реакций.
Клеточные медиаторы повреждения
| Медиатор
| Механизм действия
|
| Гистамин
Серотонин
Ацетилхолин
Адреналин
Лизосомаль-ные ферменты
| Освобождается тучными клетками и базофилами.
Расширяет артериолы и суживает венулы, повышает давление в капиллярах, способствует проницаемости гистогематического барьера.
Вырабатывается базофильными лейкоцитами, тромбоцитами. Усиливает эффект гистамина.
Выделяется возбужденными холинергическими структурами. Расширяет сосуды, стимулирует развитие артериальной гиперемии.
Вырабатывается возбужденными адренергическими структурами. Вызывает первоначальный спазм сосудов, способствует снижению их проницаемости.
Вырабатываются моноцитами и гранулоцитами. Расщепляют белки (протеиназы), липиды (липазы), углеводы (амилазы), продолжают деструктивные процессы в тканях.
|
Виды повреждения клетки
1. В зависимости от скорости повреждения:
а) острое повреждение, развивается быстро, как правило, в результате однократного, но интенсивного повреждающего воздействия;
б) хроническое повреждение, развивается медленно, является следствием многократных, но менее интенсивных патогенных влияний.
2. В зависимости от периода жизненного цикла соматических клеток:
а) митотическое повреждение, когда патогенный фактор действует на клетку в момент деления;
б) интерфазное повреждение, когда патогенный фактор действует на клетку в период между делениями.
3. В зависимости от степени нарушения внутриклеточного гомеостаза:
а) обратимое (сублетальное);
б) необратимое (летальное).
Повреждение клетки носит обратимый характер, когда нарушения внутриклеточного гомеостаза устраняются при мобилизации внеклеточных и внутриклеточных защитных механизмов.
Необратимые повреждения клеток развиваются, когда нарушения внутриклеточного гомеостаза не устраняются при вовлечении внеклеточных и внутриклеточных защитно-компенсаторных механизмов.
4. В зависимости от характера основных проявлений:
а) специфическое повреждение, т.е. характерное только для какого-то конкретного болезнетворного агента,
б) неспецифическое повреждение, т.е. характерное для действия разнообразных повреждающих агентов.







