Наиболее широко распространенным в природе и хорошо изученным кислородным соединением кремния является кремнезем, или диоксид кремния.
По приблизительным подсчетам общее содержание кремнезема
в поверхностных, слоях земной коры составляет около 58,2%. Он является наиболее устойчивым соединением кремния. Энергиясвязи равна 464 кДж/моль. Кремнезем, который состоит из ато-мов кремния и кислорода и с атомами каких-либо других элементов не связан, встречается в природе как в кристаллическом, таки в аморфном видах.
К кристаллическим разновидностям кремнезема относятся кварц, тридим'ит, криетобалит и халцедон. В зависимости от температурных условий эти разновидности, кроме халцедона, способ-ны к полиморфным превращениям и могут существовать в виде
нескольких кристаллических модификаций. Наиболее устойчивой из них при обычных температурах является минерал кварц, образующий в природе оплошные или зернистые, бесцветные, полупрозрачные или окрашенные в молочно-белый или в другие цвета и оттенки массы и отдельные включения в различные горные породы. В чистом виде кристаллический кварц представляет собой правильные шестигранные призмы, закапчивающиеся шестигранными пирамидами. Бесцветная прозрачная, хорошо развитая кристаллическая разновидность кварца называется горным хрусталем. Горный хрусталь, окрашенный растворенными в нем примесями марганца в лиловый цвет, называется аметистом, окрашенный в буровато-темный цвет — дымчатым топазом, в черный цвет — морионом, а в золотисто-желтый или в лимонно-желтый — цитрином. Кроме прозрачных разновидностей кварца встречаются отдельные кристаллы его, окрашенные в тот или иной цвет различными включениями посторонних минералов. К этой группе относится авантюрин — желтовато- или буровато-красный кварц с мерцающим отливом, обусловленным мельчайшими включениями слюд и железной слюдки (Fe2O3), а также празем — кварц с включениями зеленых иголочек минерала актинолита. При обычных температурах кварц существует в виде β-кварца. С повышением температуры до 573° С β-кварц превращается в α-кварц, который свыше 870° С переходит в α-тридимит, а затем при 1470° С в α-кристобалит. Он плавится при 1728° С, образуя вязкую стекломассу, которая, остывая, превращается в кварцевое стекло (аморфную разновидность кремнезема). Блеск кварца — стеклянный, оптические константы его Ng= 1,553 и Nm = = 1,544, спайность несовершенная, излом раковистый, твердость 7, пл. 2,65 г/см3. Кристаллический кварц и кварцевое стекло прозрачны для ультрафиолетовых лучей; при нагревании или охлаждении на поверхности кварца появляются электрические заряды, меняющие свой знак с изменением температуры (нагревания или охлаждения). Кварц обладает свойством пьезоэлектри-зации.
Особенно распространенную в природе микроволокнистую, скрытокристаллическую разновидность кварца представляет собой минерал халцедон, содержащий в своем составе в растворенном виде некоторое количество воды, удаляющейся при нагревании до 650—800° С. Халцедон окрашен в молочно-серый, синевато-черный, желтый, красный, оранжевый (сердолик), коричневый, бурый (сардер), яблочно-зеленый (хризопраз), зеленый с красными пятнышками (гелиотроп) и в другие различные цвета. Плотность халцедона колеблется впределах от 2,55 до 2,61 г/см3, твердость 6—7.
Разновидности халцедона — агат, яшма и кремень. Агат и яшма состоят из окрашенных в различные цвета, подчас тончайших, плоско-параллельных или концентрически расположенных слоев халцедона. Это придает им своеобразно красивый вид. Кремень при прокаливании подобно халцедону, В-кварцу, претерпевая полиморфные превращения, в конечном итоге превращается в
а-кристобалит.
Тридимит в природе встречается в виде шестиугольных пластинок, достигающих иногда 3—4 мм, среди кислых эффузивных горных пород. Искусственным путем он получается в виде копьевидных двойников в кислых огнеупорах (динасе) и в ряде керамических масс, подвергающихся продолжительному прокаливанию при высоких температурах. При остывании он претерпевает полиморфные превращения. Устойчивой модификацией тридимита при обычных температурах вплоть до 117° С является γ-тридимит. Свыше этой температуры до 163° С тридимит существует в промежуточной модификации в виде β-тридимита. При более высоких температурах вплоть до 1470° С устойчивюй модификацией считается α-тридимит, который при дальнейшем повышении температуры превращается в α-кристобалит. Кристобалит встречается довольно редко в естественном виде, чаще он получается в α-модификации при прокаливании кремнезема при высоких температурах. Устойчивой модификацией кристобалита при обычных температурах является β-кристобалит. При полиморфных превращениях кремнезема из одной модификации в другую изменяется объем его, но масса остается постоянной. В связи с этим кремнеземсодержащие изделия, изготовленные из кварцевого сырья, в модификации β-кварца во время термической обработки свыше 1000° С, превращаясь в α-тридимит, увеличиваются в объеме примерно на 16%, что вызывает соответтвующие деформации и приводит к нарушению сплошности в виде трещин.
Кислородные соединения кремния состоят из атомов кремния и кислорода. Четыре атома, кислорода с одной ненасыщенной связью каждый присоединяются к одному атому кремния и образуют прочно связанную группу атомов SiO4-4. В результате ненасыщенности SiO4-4 кремнекислородные соединения могут образовывать структуры из многократно повторяющихся групп атомов, состоящих из одного атома кремния и двух атомов кислорода, что соответствует формуле SiO2:
— 

 О — Si ― О — Si―О — Si - O
О — Si ― О — Si―О — Si - O
 |
| 

 О О О
О О О



— О — Si — О — Si - О ― Si — О —
Из схемы видно, что атомы кремния непосредственно между собой не связаны, а соединение их осуществляется только с помощью атомов кислорода по так называемой силоксановой связи:



 — О —Si — О— Si— О —Si — О — Si — О —
— О —Si — О— Si— О —Si — О — Si — О —
Основная особенность такого, сочетания атомов кремния и кислорода заключается в том, что в основе этого сочетания лежит структурная группа, состоящая из одного атома кремния и четырех атомов кислорода, отстоящих от атома кремния на одинаковом расстоянии, равном 0,16нм. В то же время атомы кислорода друг от друга располагаются тоже на одинаковом расстоянии, равном 0,264 нм. Таким образом, вся группа SiO4-4 представляет собой
правильный тетраэдр, в центре которого находится атом кремния, а в каждой вершине по одному атому кислорода. Атом кремния с каждым из окружающих его атомов кислорода связан только одной полной ковалентной связью. Благодаря этому у каждого атома кислорода остается еще по одной полной свободной связи, за счет которых группа [SiO4]4- может присоединять подобные группы атомов или отдельные атомы различных элементов или сама присоединяться к ним. Группу атомов SiO4 можно рассматривать как четырехзарядный отрицательный ион [SiO4]4-, каким он и является в виде основной структурной единицы в кремнекислородных соединениях (рис. 1).

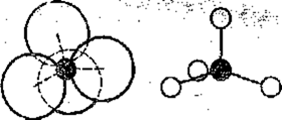
Рис. 1. Условное обозначение иона [SiO4]4-
Кремнекислородные тетраэдры, соединяясь друг с другом по всем направлениям через общие атомы кислорода, создают пространственные решетки, которые обусловливают кристаллическое строение полиморфных разновидностей кремнезема.
Кроме перечисленных кристаллических разновидностей кремнезема в настоящее время известны еще коэсит, китит, стишовит и волокнистая модификация, называемая кремнеземом W. Коэсит представляет.собой более плотную, чем кварц (пл. 2,93г/см3), прозрачную, переходящую в кристобалит при 17000 С кристаллическую модификацию кремнезема. В плавиковой кислоте он нерастворим. Коэсит образуется при давлении 3,5 тыс. МПа*. Этим объясняется, что в природе он был обнаружен в больших метеоритных кратерах.
Китит образуется при давлении около 100 МПа и 380—580° С. При нагревании до 300° С он сокращается в объеме, свыше 300° С расширяется и при 1620° С переходит в кристобалит; в холодной плавиковой кислоте китит растворим..
Стишовит образуется при очень высоких давлениях порядка 10—18 тыс. МПа и температуре от 600 до 1400° С. Он обладает наибольшей плотностью, равной 4,3 г/см3 (пл. β-кварца 2,6 г/см3). Твердость стишовита колеблется от 8 до 8,5. Основу кристаллической структуры его составляют октаэдры SiO6. Стишовит в природе был впервые обнаружен вместе с коэснтом в аризонском метеоритном кратере США
Кремнезем W волокнистого строения, кристаллы его достигают до 9 мм. Получают его из смеси, состоящей из эквимолекулярных количеств SiO2 и Si. Смесь нагревают до 14009С в атмосфере кислорода. Газообразные продукты реакции охлаждают в холодильнике. Процесс протекает в две стадий: сначала образуется оксид кремния в газообразном состоянии; который затем, конден-сируясь, окисляется и превращается в кремнезем:
Si02+-Si = 2SiO
2SiO + O2 =2SiO2
Кристаллическая решетка кремнезема W состоит из деформированных тетраэдров, связанных между собой двумя атомами кислорода в силоксановые цепи:
Некристаллические разновидности кремнезема.
К разновидностям аморфного кремнезема, не обладающего четко выраженной кристаллической структурой, относятся кварцевое стекло и порошкообразный кремнезем. B природе кварцевое стекло встречается в виде минерала лешательерита в незначительном количестве. Обычно eго получают искусственным путем, расплавляя жильный кварц или чистые кварцевые пески в электропечах при температуре свыше 1728°С (т. пл. α-кристобалита). При этом образуется густой вязкий расплав, содержащий большое количество мелких газовоздушных пузырьков. Чтобы сделать его подвижнее и удалить из него эти пузырьки, температуру расплава повышают свыше 2000° С. При охлаждении он превращается в прозрачное квар-цевое стекло.
Плотность кварцевого стекла 2,204 г/см3, после облучения его
потоком 2.1020 нейтрон/см2 она увеличивается до 2,26 г/см3. Кварцевое стекло обладает весьма малым коэффициентом термического расширения, который примерно в 60 раз меньше, чем у кристаллического кремнезема, поэтому оно обладает высокой термостойкостью вплоть до 1000°. Кварцевое стекло прозрачно не только для волн видимого спектра, но и для ультрафиолетовых и инфракрасных лучей. Оно является великолепным электроизоляци-
онным материалом. Характерной особенностью кварцевого стекла
является высокая проницаемость его для многих газов даже при
невысоких температурах. Так, при разности давлений в 0,1 МПа
азот диффундирует через кварцевое стекло, начиная с 430° С, а во-
дород при 330° С. С повышением температуры скорость диффузии
возрастает. Вода и минеральные кислоты, за исключением плави-
ковой и ортофосфорной, на кварцевое стекло не действуют. Пос-
ледняя практически разлагает его при температурах выше 260° С
и тем интенсивнее, чем выше температура. Карбонаты щелочных
металлов и едкие щелочи хорошо разлагают кварцевое стекло
с образованием силикатов щелочных металлов. Процессы химиче-
скою взаимодействия кварцевого стекла с соответствующими реа-
гентами протекают, в таком виде:
SiO2 + 4HF = SiF4+2H2O
SiO2 + 2NaOH =Na2SiO3+H2O
SiO2 + Na2CO3 = Na2SiO3 +CO2
Ценные свойства кварцевого стекла используются в приборо-и аппаратостроении, в лабораторной практике, в технике и в медицине. Из кварцевого стекла изготовляют химически стойкую лабораторную посуду, огнеупорные трубки, ртутно-кварцевые лампы, крутильные нити для измерительных приборов и многие другие весьма ценные изделия.
Порошкообразный тонкодисперсный аморфный кремнезем получают путем обезвоживания гелей кремниевых кислот прокаливанием при температурах порядка 1000° С. Порошкообразный кремнезем является тонкодисперсным материалом, обладает большой поверхностью, поэтому широко используется как хороший адсорбент**(Адсорбентами называют вещества, способные поглощать своей поверхностью отдельные молекулы других веществ.) В отличие от кристаллического аморфный кремнезем химически активен.




 |
| 
 О О О
О О О





