Комплементарность азотистых оснований в молекуле ДНК составляет главную сущность молекулярных основ наследственности и позволяет понять, как при делении клетки синтезируются тождественные молекулы ДНК.
Перед каждым удвоением хромосом и делением клетки происходит репликация (удвоение) ДНК. Репликацией называют процесс самокопирование молекулы ДНК с соблюдением порядка чередования нуклеотидов, присущего материнским комплементарным нитям.
Спиралевидная двухцепочная ДНК сначала расплетается (раскручивается) вдоль оси, водородные связи между азотистыми основаниями рвутся и цепи расходятся. Затем, к каждой цепи пристраиваются комплементарные азотистые основания и образуются две новые дочерние молекулы ДНК. Такой способ удвоения молекул, при котором каждая дочерняя молекула содержит одну материнскую и одну вновь синтезированную цепь, называют полуконсервативным.
Процесс реплдикации осуществляется с помощью ферментов, которые получили название ДНК-полимераз. Участок молекулы ДНК, в котором начали расплетаться комплементные нити, называется вилкой репликации. Она образуется у прокариот в определенной генетически детерминированной точке. В молекуле ДНК у эукариот таких точек инициации репликации («стартовых точек») бывает несколько. У эукариот процесс репликации ДНК идет неодинаково. Объясняется это тем, что полинуклеотидные цепи в молекуле ДНК антипараллельны, т. е. 5'-конец одной цепи соединяется с 3'-концом другой, и наоборот. Материнская цепь, на которой синтез идет от точки старта 5'->3' в виде сплошной линии, называется лидирующей, а вторая цепь, на которой синтез идет от 3'->5' (в противоположном направлении) отдельными фрагментами получила название запаздывающей. Синтез этой цепи сложнее синтеза лидирующей цепи. Он протекает с участием фермента лигазы отдельными фрагментами. Эти фрагменты (участки кодовой нити ДНК) содержат у эукариот 100-200, а у прокариот 1000-2000 нуклеотидов. Они получили название фрагментов Оказаки, по имени открывшего их японского ученого.
Фрагмент ДНК от одной точки начала репликации до другой точки образует единицу репликации - репликон. Репликация начинается с определенной точки (локус ori) и продолжается до тех пор, пока весь репликон не будет дуплеципрован. Молекулы ДНК прокариотических клеток содержат большое число репликонов, поэтому удваение ДНК начинается в нескольких точках. В разных репликонах удвоение может идти в разное время или одновременно.
Репликация молекул ДНК у прокариот протекает несколько иначе, чем у эукариот. У прокариот одна из нитей ДНК разрывается и один конец ее прикрепляется к клеточной мембране, а на противоположном конце происходит синтез дочерних нитей. Такой синтез дочерних нитей ДНК получил название «катящегося обруча». Репликация ДНК протекает быстро. Так, у бактерии скорость репликации составляет 30 мкм в минуту. За минуту к нитке-матрице присоединяется около 500 нуклеотидов, у вирусов за это время - около 900 нуклеотидов. У эукариот процесс репликации протекает медленно. У них дочерняя нить удлиняется на 1,5-2,5 мкм в минуту.
ДНК всех живых существ устроен одинаково. ДНК разных видов различаются коэффициентом видоспецифичности, который представляет собой отношение молекулярной суммы А + Т к молекулярной суме Г + Ц. Видоспецифичность ДНК выражается процентом или долей в ней ГЦ-пар. Коэффициент видовой специфичности разный у разных видов, но в общем наблюдается изменение ГЦ-пар от прокариот к эукариотам, а в пределах последних - от низших к более высокоорганизованным формам.
Углеводно-фосфатный остов по всей длине во всех молекулах ДНК имеет однотипную структуру и не несет генетической информации. Наследственная информация зашифрована различной последовательностью оснований. А если последовательность оснований определяет характер белков собаки, коровы, бактерии, вируса и т. д., то соответственная наследственность может передаваться из поколения в поколение.
Таким образом, в структорной организации молекулы ДНК можно выделить первичную структуру - полинуклеотидную цепь, вторичную структуру - две комплементарные друг другу полинуклеотидные цепи, соединенные водородными связями, и третичную структуру - трехмерную спираль с определенными пространственными характеристиками.
Заключение
Суть репликации ДНК заключается в том, что специальный фермент разрывает слабые водородные связи, которые соединяют между собой нуклеотиды двух цепей. В результате цепи ДНК разъединяются, и из каждой цепи «торчат» свободные азотистые основания.
Нужно отметить, что существует ряд объектов, репликация которых проходит по несколько иному механизму, чем было описано выше. Так, например, кольцевая ДНК митохондрий и хлоропластов реплицируется с образованием D-петель (сначала начинает реплицироваться одна цепь, в результате чего образуется структура в форме D, а после репликации более половины первой нити, начинает синтезироваться вторая); ряд плазмид и ДНК некоторых вирусов реплицируется по типу катящегося кольца и т.п. Однако принципиальная схема репликации для всех биологических объектов остаётся одной и той же.
34. Репликационная вилка (репликативная вилка) — cтруктура, которая образуется во время репликации ДНК.
В подавляющем большинстве случаев (кроме некоторых вирусов и искусственно созданных молекул, содержащих одноцепочечную ДНК) макромолекула ДНК состоит из двух комплементарных цепей, имеющих противоположную направленность. Комплементарность цепей означает, что информационное содержание обеих цепей ДНК идентично. Разные концы цепочки ДНК называются 3’-конец и 5’- конец. Фермент ДНК-полимераза, осуществляющий удвоения цепочки нуклеотидов, может добавлять свободные нуклеотиды только к 3’-концу собираемой цепочки. Поэтому, для осуществления репликации обе цепи родительской ДНК должны быть отделены друг от друга (хотя бы на время).
Четко ограниченная область, перемещающаяся вдоль родительской спирали ДНК, характеризующаяся местным расхождением двух ее цепей из-за своей Y-образной формы названа репликационной вилкой.


Схема репликационной вилки.
a: мРНК, b: лидирующая цепь, c: отстающая цепь, d: репликационная вилка, e: РНК праймер, f: фрагмент Оказаки
35. Полимера́зная цепна́я реа́кция (ПЦР) — экспериментальный метод молекулярной биологии, позволяющий добиться значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК) в биологическом материале (пробе).
Помимо амплификации ДНК, ПЦР позволяет производить множество других манипуляций с нуклеиновыми кислотами (введение мутаций, сращивание фрагментов ДНК) и широко используется в биологической и медицинской практике, например, для диагностики заболеваний (наследственных, инфекционных), для установления отцовства, для клонирования генов, выделения новых генов.
Проведение ПЦР
Метод основан на многократном избирательном копировании определённого участка ДНК при помощи ферментов в искусственных условиях (in vitro). При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце. В отличие от амплификации ДНК в живых организмах, (репликации), с помощью ПЦР амплифицируются относительно короткие участки ДНК. В обычном ПЦР-процессе длина копируемых ДНК-участков составляет не более 3000 пар оснований (3 kbp[8]). С помощью смеси различных полимераз, с использованием добавок и при определённых условиях длина ПЦР-фрагмента может достигать 20—40 тысяч пар нуклеотидов. Это всё равно значительно меньше длины хромосомной ДНК эукариотической клетки. Например, геном человека состоит примерно из 3 млрд пар оснований[9].
Компоненты реакции
Для проведения ПЦР в простейшем случае требуются следующие компоненты:
- ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать.
- Два праймера, комплементарные противоположным концам разных цепей требуемого фрагмента ДНК.
- Термостабильная ДНК-полимераза — фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов — Thermus aquaticus (Taq-полимераза), Pyrococcus furiosus (Pfu-полимераза), Pyrococcus woesei (Pwo-полимераза) и другие.
- Дезоксирибонуклеозидтрифосфаты (dATP, dGTP, dCTP, dTTP).
- Ионы Mg2+, необходимые для работы полимеразы.
- Буферный раствор, обеспечивающий необходимые условия реакции — рН, ионную силу раствора. Содержит соли, бычий сывороточный альбумин.
Чтобы избежать испарения реакционной смеси, в пробирку добавляют высококипящее масло, например, вазелиновое. Если используется амплификатор с подогревающейся крышкой, этого делать не требуется.
Добавление пирофосфатазы может увеличить выход ПЦР-реакции. Этот фермент катализирует гидролиз пирофосфата, побочного продукта присоединения нуклеотидтрифосфатов к растущей цепи ДНК, до ортофосфата. Пирофосфат может ингибировать ПЦР-реакцию[10].
Праймеры
Специфичность ПЦР основана на образовании комплементарных комплексов между матрицей и праймерами, короткими синтетическими олигонуклеотидами длиной 18—30 оснований. Каждый из праймеров комплементарен одной из цепей двуцепочечной матрицы и ограничивает начало и конец амплифицируемого участка.
После гибридизации матрицы с праймером (отжиг[11]), последний служит затравкой для ДНК-полимеразы при синтезе комплементарной цепи матрицы (см. ниже).
Важнейшая характеристика праймеров — температура плавления (Tm) комплекса праймер-матрица.
Tm — температура, при которой половина ДНК-матриц образует комплекс с олигонуклеотидным праймером. Усредненная формула подсчета Tm для короткого олигонуклеотида (и для длинных ДНК фрагментов), с учетом концентрации ионов K+ и DMSO:
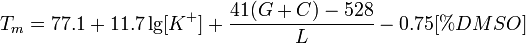 , [12]
, [12]
где L — количество нуклеотидов в праймере, K+ молярная концентрация ионов калия, G+C - сумма всех гуанинов и цитозинов..
В случае неверного выбора длины и нуклеотидного состава праймера или температуры отжига возможно образование частично комплементарных комплексов с другими участками матричной ДНК, что может привести к появлению неспецифических продуктов. Верхний предел температуры плавления ограничен оптимумом температуры действия полимеразы, активность которой падает при температурах выше 80 °C.
При выборе праймеров желательно придерживаться следующих критериев:
- GC-состав ~ 40—60 %;
- близкие Tm праймеров (отличия не более, чем на 5 °C);
- отсутствие неспецифических вторичных структур — шпилек[13] и димеров[14];
- желательно, чтобы на 3’-конце был гуанин или цитозин, поскольку они образуют три водородные связи с молекулой матрицы, делая гибридизацию более стабильной.
Амплификатор


Рис. 1: Амплификатор для проведения ПЦР
ПЦР проводят в амплификаторе — приборе, обеспечивающем периодическое охлаждение и нагревание пробирок, обычно с точностью не менее 0,1 °C. Современные амплификаторы позволяют задавать сложные программы, в том числе с возможностью «горячего старта», Touchdown ПЦР (см. ниже) и последующего хранения амплифицированных молекул при 4 °C. Для ПЦР в реальном времени выпускают приборы, оборудованные флуоресцентным детектором. Существуют также приборы с автоматической крышкой и отделением для микропланшет, что позволяет встраивать их в автоматизированные системы.
Ход реакции


Фотография геля, содержащего маркерную ДНК (первый и последний слоты) и продукты ПЦР
Обычно при проведении ПЦР выполняется 20—35 циклов, каждый из которых состоит из трёх стадий (рис. 2).
Денатурация
Двухцепочечную ДНК-матрицу нагревают до 94—96 °C (или до 98 °C, если используется особенно термостабильная полимераза) на 0,5—2 мин, чтобы цепи ДНК разошлись. Эта стадия называется денатурацией, так как разрушаются водородные связи между двумя цепями ДНК. Иногда перед первым циклом (до добавления полимеразы) проводят предварительный прогрев реакционной смеси в течение 2—3 мин для полной денатурации матрицы и праймеров. Такой приём называется горячим стартом, он позволяет снизить количество неспецифичных продуктов реакции.
Отжиг
Когда цепи разошлись, температуру понижают, чтобы праймеры могли связаться с одноцепочечной матрицей. Эта стадия называется отжигом. Температура отжига зависит от состава праймеров и обычно выбирается равной температуре плавления праймеров. Неправильный выбор температуры отжига приводит либо к плохому связыванию праймеров с матрицей (при завышенной температуре), либо к связыванию в неверном месте и появлению неспецифических продуктов (при заниженной температуре). Время стадии отжига — 30 cек, одновременно, за это время полимераза уже успевает синтезировать несколько сотен нуклеотидов. Поэтому рекомендуется подбирать праймеры с температурой плавления выше 60 °C и проводить отжиг и элонгацию одновременно, при 60-72 °C.
Элонгация
ДНК-полимераза реплицирует матричную цепь, используя праймер в качестве затравки. Это — стадия элонгации. Полимераза начинает синтез второй цепи от 3'-конца праймера, который связался с матрицей, и движется вдоль матрицы, синтезируя новую цепь в направлении от 5' к 3' концу. Температура элонгации зависит от полимеразы. Часто используемые полимеразы Taq и Pfu наиболее активны при 72 °C. Время элонгации зависит как от типа ДНК-полимеразы, так и от длины амплифицируемого фрагмента. Обычно время элонгации принимают равным одной минуте на каждую тысячу пар оснований. После окончания всех циклов часто проводят дополнительную стадию финальной элонгации, чтобы достроить все одноцепочечные фрагменты. Эта стадия длится 7—10 мин.


Рис. 2: Схематическое изображение первого цикла ПЦР. (1) Денатурация при 94—96 °C. (2) Отжиг при 68 °C (например). (3) Элонгация при 72 °C (P=полимераза). (4) Закончен первый цикл. Две получившиеся ДНК-цепи служат матрицей для следующего цикла, поэтому количество матричной ДНК в ходе каждого цикла удваивается
Количество специфического продукта реакции (ограниченного праймерами) теоретически возрастает пропорционально 2n — 2n, где n — число циклов реакции[15]. На самом деле эффективность каждого цикла может быть меньше 100 %, поэтому в действительности P ~ (1+E)n, где P — количество продукта, Е — средняя эффективность цикла.
Число «длинных» копий ДНК тоже растет, но линейно, поэтому в продуктах реакции доминирует специфический фрагмент.
Рост требуемого продукта в геометрической прогрессии ограничен количеством реагентов, присутствием ингибиторов, образованием побочных продуктов. На последних циклах реакции рост замедляется, это называют «эффектом плато».
Разновидности ПЦР
- Вложенная ПЦР (Nested PCR (англ.)) — применяется для уменьшения числа побочных продуктов реакции. Используют две пары праймеров и проводят две последовательные реакции. Вторая пара праймеров амплифицирует участок ДНК внутри продукта первой реакции.
- Инвертированная ПЦР (Inverse PCR (англ.)) — используется в том случае, если известен лишь небольшой участок внутри нужной последовательности. Этот метод особенно полезен, когда нужно определить соседние последовательности после вставки ДНК в геном. Для осуществления инвертированной ПЦР проводят ряд разрезаний ДНК рестриктазами с последующим соединением фрагментов (лигирование). В результате известные фрагменты оказываются на обоих концах неизвестного участка, после чего можно проводить ПЦР как обычно.
- ПЦР с обратной транскрипцией (Reverse Transcription PCR, RT-PCR (англ.)) — используется для амплификации, выделения или идентификации известной последовательности из библиотеки РНК. Перед обычной ПЦР проводят на матрице мРНК синтез одноцепочечной молекулы ДНК с помощью ревертазы и получают одноцепочечную кДНК, которая используется в качестве матрицы для ПЦР. Этим методом часто определяют, где и когда экспрессируются данные гены.
- Асимметричная ПЦР (англ. Asymmetric PCR) — проводится тогда, когда нужно амплифицировать преимущественно одну из цепей исходной ДНК. Используется в некоторых методиках секвенирования и гибридизационного анализа. ПЦР проводится как обычно, за исключением того, что один из праймеров берется в большом избытке. Модификаций этого метода является англ. L inear- A fter- T he- E xponential-PCR (LATE-PCR), в котором используются праймеры с разной концентрацией, и праймер с низкой концентрацией подбирается с высокой (температурой плавления), чем праймер с высокой концентрацией. ПЦР проводят при высокой температуре отжига, тем самым удаётся поддержать эффективности реакции на протяжении всех циклов[16].
- Количественная ПЦР (Quantitative PCR, Q-PCR (англ.)) или ПЦР в реальном времени — используется для непосредственного наблюдения за измерением количества конкретного ПЦР продукта в каждом цикле реакции. В этом методе используют флуоресцентно-меченые праймеры или пробы для точного измерения количества продукта реакции по мере его накопления; или используется флуоресцентный интеркалирующий краситель Sybr Green I, который связывается с двухцепочечной ДНК. Sybr Green I обеспечивает простой и экономичный вариант для детекции и количественного определения ПЦР-продуктов в ходе ПЦР в режиме реального времени без необходимости использования специфичных флуоресцентных зондов или праймеров. В ходе амплификации краситель SYBR Green I встраивается в малую бороздку ДНК ПЦР продуктов и испускает более сильный по сравнению с несвязанным красителем флуоресцентный сигнал при облучении синим лазером. SYBR Green I совместим со всеми известными на сегодняшний день приборами для проведения ПЦР в режиме реального времени. Максимум поглощения для SYBR Green I при длине волны 494 нм. Кроме главного, в спектре красителя имеются два небольших дополнительных максимума поглощения — при 290 нм и 380 нм. Максимум испускания для SYBR Green I при длине волны 521 нм (зелёный) Fluorescence SpectraViewer.
- Ступенчатая ПЦР (Touchdown PCR (англ.)) — с помощью этого подхода уменьшают влияние неспецифического связывания праймеров. Первые циклы проводят при температуре выше оптимальной температуры отжига, затем каждые несколько циклов температуру отжига постепенно снижают до оптимальной. Это делается для того, чтобы праймер гибридизовался с комплементарной цепью всей своей длиной; тогда как при оптимальной температуре отжига, праймер частично гибридизуется с комплементарной цепью. Частичная гибридизация праймера на геномной ДНК приводит к неспецифической амплификации, если участков связывания для праймера достаточно много. В большинстве случаев, первые десять ПЦР циклов, можно проводить при температуре отжига в 72-75°С, а затем сразу снизить до оптимальной, например до 60-65°С.
- Метод молекулярных колоний (ПЦР в геле, англ. Colony - PCR Colony) — акриламидный гель полимеризуют со всеми компонентами ПЦР на поверхности и проводят ПЦР. В точках, содержащих анализируемую ДНК, происходит амплификация с образованием молекулярных колоний.
- ПЦР с быстрой амплификацией концов кДНК (англ. Rapid amplification of cDNA ends, RACE-PCR).
- ПЦР длинных фрагментов (англ. Long-range PCR) — модификация ПЦР для амплификации протяженных участков ДНК (10 тысяч и более оснований). Используют смесь двух полимераз, одна из которых — Taq-полимераза с высокой процессивностью (то есть, способная за один проход синтезировать длинную цепь ДНК), а вторая — ДНК полимераза с 3'-5' экзонуклеазной активностью, обычно это Pfu полимераза. Вторая полимераза необходима для того, чтобы корректировать ошибки, внесённые первой, так как Taq-полимераза останавливает синтез ДНК если был добавлен не комплементарный нуклеотид. Этот не комплементарный нуклеотид удаляет Pfu полимераза. Смесь полимераз берется в отношении 50:1 или даже меньше 100:1, где Taq-полимераза берётся в 25-100 раз больше по отношению к Pfu полимеразе.
- RAPD (англ. Random Amplification of Polymorphic DNA), ПЦР со случайной амплификацией полиморфной ДНК — используется тогда, когда нужно различить близкие по генетической последовательности организмы, например, разные сорта культурных растений, породы собак или близкородственные микроорганизмы. В этом методе обычно используют один праймер небольшого размера (около 10 п.н.). Этот праймер будет частично комплементарен случайным участкам ДНК исследуемых организмов. Подбирая условия (длину праймера, его состав, температуру и пр.), удаётся добиться удовлетворительного отличия картины ПЦР для двух организмов.
- Групп-специфическая ПЦР (англ. group-specific PCR) — ПЦР для родственных последовательностях внутри одного или между разными видами, используя консервативные праймеры к этим последовательностям. Например, подбор универсальных праймеров к рибосомальным 18S и 26S генам для амплификации видоспецифического межгенного спейсера: последовательность генов 18S и 26S консервативна между видами, поэтому ПЦР между этими генами будет проходить для всех исследуемых видов. Противоположный этому методу является — уникальная ПЦР (англ. unique PCR), в котором задача состоит в подборе праймеров для амплификации только конкретной последовательности среди родственных последовательностей.
- ПЦР с использованием горячего старта (англ. Hot-start PCR) — модификация ПЦР с использованием ДНК-полимеразы, в которой полимеразная активность блокируется при комнатной температуре антителами или имитирующие антитела небольшими молекулами типа Affibody, то есть в момент постановки реакции до первой денатурации в ПЦР. Обычно первая денатурация проводится при 95 °C в течение 10 минут, в этом случае.
- Виртуальная ПЦР (англ. in silico PCR, цифровая ПЦР, электронная ПЦР, е-ПЦР) — математический метод компьютерного анализа теоретической полимеразной цепной реакции, используя список последовательностей праймеров (или проб) для предсказания потенциальной амплификации ДНК исследуемого генома, хромосомы, кольцевой ДНК или любого другого участка ДНК.
Если нуклеотидная последовательность матрицы известна частично или неизвестна вовсе, можно использовать вырожденные праймеры, последовательность которых содержит вырожденные позиции, в которых могут располагаться любые основания. Например, последовательность праймера может быть такой: …ATH…, где Н — А, Т или С.
Применение ПЦР
ПЦР используется во многих областях для проведения анализов и в научных экспериментах.
Криминалистика
ПЦР используют для сравнения так называемых «генетических отпечатков пальцев». Необходим образец генетического материала с места преступления — кровь, слюна, сперма, волосы и т. п. Его сравнивают с генетическим материалом подозреваемого. Достаточно совсем малого количества ДНК, теоретически — одной копии. ДНК расщепляют на фрагменты, затем амплифицируют с помощью ПЦР. Фрагменты разделяют с помощью электрофореза ДНК. Полученную картину расположения полос ДНК и называют генетическим отпечатком пальцев (англ. genetic fingerprint).
Мутационная изменчивость
Это изменения ДНК клетки (изменение строения и количества хромосом). Возникают под действием ультрафиолета, радиации (рентгеновских лучей) и т.п. Передаются по наследству, служат материалом для естественного отбора (мутационный процесс – одна из движущих сил эволюции).
Виды мутаций, причины, примеры
Мутации – это изменения в ДНК клетки. Возникают под действием ультрафиолета, радиации (рентгеновских лучей) и т.п. Передаются по наследству, служат материалом для естественного отбора. отличия от модификаций
Генные мутации – изменение строения одного гена. Это изменение в последовательности нуклеотидов: выпадение, вставка, замена и т.п. Например, замена А на Т. Причины – нарушения при удвоении (репликации) ДНК. Примеры: серповидноклеточная анемия, фенилкетонурия.
Хромосомные мутации – изменение строения хромосом: выпадение участка, удвоение участка, поворот участка на 180 градусов, перенос участка на другую (негомологичную) хромосому и т.п. Причины – нарушения при кроссинговере. Пример: синдром кошачьего крика.
Геномные мутации – изменение количества хромосом. Причины – нарушения при расхождении хромосом.
· Полиплоидия – кратные изменения (в несколько раз, например, 12 → 24). У животных не встречается, у растений приводит к увеличению размера.
· Анеуплоидия – изменения на одну-две хромосомы. Например, одна лишняя двадцать первая хромосома приводит к синдрому Дауна (при этом общее количество хромосом – 47).
Цитоплазматические мутации – изменения в ДНК митохондрий и пластид. Передаются только по женской линии, т.к. митохондрии и пластиды из сперматозоидов в зиготу не попадают. Пример у растений – пестролистность.
Соматические – мутации в соматических клетках (клетках тела; могут быть четырех вышеназванных видов). При половом размножении по наследству не передаются. Передаются при вегетативном размножении у растений, при почковании и фрагментации у кишечнополостных (у гидры).
37. На генном уровне изменения первичной структуры ДНК генов под действием мутаций менее значительны, чем при хромосомных мутациях, однако генные мутации встречаются более часто. В результате генных мутаций происходят замены, делеции и вставки одного или нескольких нуклеотидов, транслокации, дупликации и инверсии различных частей гена. В том случае, когда под действием мутации изменяется лишь один нуклеотид, говорят о точечных мутациях. Поскольку в состав ДНК входят азотистые основания только двух типов — пурины и пиримидины, все точковые мутации с заменой оснований разделяют на два класса: транзиции (замена пурина на пурин или пиримидина на пиримидин) и трансверсии (замена пурина на пиримидин или наоборот). Возможны четыре генетических последствия точковых мутаций: 1) сохранение смысла кодона из-за вырожденности генетического кода (синонимическая замена нуклеотида), 2) изменение смысла кодона, приводящее к замене аминокислоты в соответствующем месте полипептидной цепи (миссенс-мутация), 3) образование бессмысленного кодона с преждевременной терминацией (нонсенс-мутация). В генетическом коде имеются три бессмысленных кодона: амбер — UAG, охр — UAA и опал — UGA (в соответствии с этим получают название и мутации, приводящие к образованию бессмысленных триплетов — например амбер-мутация), 4) обратная замена (стоп-кодона на смысловой кодон).





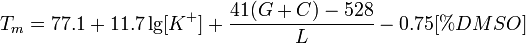 , [12]
, [12]





