

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности...
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Интересное:
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Дисциплины:
|
из
5.00
|
Заказать работу |
Кислотно-основное равновесие – относительное постоянство реакции внутренней среды организма, количественно характеризующееся или концентрацией водородных ионов (протонов), выраженной в молях на 1 л, или водородным показателем – отрицательным десятичным логарифмом этой концентрации – рН (powerhydrogen – сила водорода).
106)Протолитическая теория Бренстеда и Лоури
Теории кислот и оснований — совокупность фундаментальных физико-химических представлений, описывающих природу и свойства кислот и оснований. Все они вводят определения кислот и оснований — двух классов веществ, реагирующих между собой. Задача теории — предсказание продуктов реакции между кислотой и основанием и возможности её протекания, для чего используются количественные характеристики силы кислоты и основания. Различия между теориями лежат в определениях кислот и оснований, характеристики их силы и, как следствие — в правилах предсказания продуктов реакции между ними. Все они имеют свою область применимости, каковые области частично пересекаются.Кислотно-основные взаимодействия чрезвычайно распространены в природе и находят широкое применение в научной и производственной практике. Теоретические представления о кислотах и основаниях имеют важное значение в формировании всех концептуальных систем химии и оказывают разностороннее влияние на развитие многих теоретических концепций во всех основных химических дисциплинах.
Кислотыи основания по определению Бренстеда — Лаури. В теории Бренстеда — Лаури кислотой является любое вещество, высвобождающее в растворе протоны, а основанием-любое вещество, удаляющее из раствора протоны путем соединения с ними. H I представляет собой сильную кислоту, потому что легко высвобождает протоны. Ион СГ-слабое основание, потому что он обладает небольшой склонностью соединяться с Н. НС1 и СК могут рассматриваться как сопряженная пара кислота - основание.
108)Ионизация и диссоциация. Константы кислотности и основности.
Ионизация-эндотермический процесс образования ионов из нейтральных атомов или молекул.Положительно заряженный ион образуется, если электрон в молекуле получает достаточную энергию для преодоления потенциального барьера, равную ионизационному потенциалу. Отрицательно заряженный ион, наоборот, образуется при захвате дополнительного электрона атомом с высвобождением энергии.
Диссоциация -распад сложных химических соединений на составляющие компоненты и/или элементы.
Константа протолитического равновесия, определяющая полноту протекания протолиза слабой кислоты при данной температуре, называется константой кислотности.
Аналогично для протолиза слабого основания
NH3·HOH  NH4+ + OH–
NH4+ + OH–
существует константа основности, определяющая полноту протекания протолиза слабого основания при данной температуре
Кo = [NH4+][OH–] [NH3 · HOH]
Константы кислотности и основности зависят от природы электролита, растворителя, от температуры, но не зависят от концентрации раствора. Они характеризуют способность данной кислоты или данного основания распадаться на ионы: чем выше значение константы, тем легче электролит диссоциирует
БИОХИМИЯ
1.Основные положения теории строения органических соединений А.М.Бутлерова. Изомерия как специфическое явление органической химии. атомы в молекулах соединены друг с другом согласно их валентности, порядок распределения связей в молекуле называется химическим строением;
изменение этой последовательности приводит к образованию нового вещества с новыми свойствами;
свойства веществ зависят не только от их состава, но и от «химического строения», то есть от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой;
атомы в молекулах оказывают влияние друг на друга, и это влияние приводит к химическим изменениям поведения атома;
определить состав и строение химического вещества можно по продуктам химических превращений.
2. Классификационные признаки органических соединений6строение углеродного скелета и природа функциональной группы. Функциональная группа. Структурная формула. Структурные изомеры.
Органические соединения отличаются своей многочисленностью и разнообразием. Органические соединения классифицируют, учитывая два основных признака:
-строение углеродного скелета
-наличие и строение функцианальных групп.
Углеродные скелеты разделяют на ациклические (не содержащие циклов), циклические и гетероциклические.

В гетероциклическом скелете в углеродный цикл включается одни или несколько атомов, отличных от углерода. Исторически сложилась традиция не рассматривать такие гетероатомы как функциональные группы, а считатьих частью углеродного скелета.
В самих углеродных скелетах нужно классифицировать отдельные атомы углерода по числу химически связанных с ними атомов углерода. Если данный атом углерода связан с одним атомом углерода, то его называют первичным, с двумя — вторичным, тремя — третичным и четырьмя — четвертичным.
Поскольку атомы углерода могут образовывать между собой не только одинарные, но и кратные (двойные и тройные) связи, то соединения, содержащие только одинарные связи углерод—углерод, называют насыщенными, соединения с кратными углерод ¾ углеродными связями называют ненасыщенными. Соединения, в которых атомы углерода связаны только с атомами водорода, называют углеводородами.
1. Природа функциональной группы Функциональные группы, содержащие атом кислорода:
· гидроксильная–ОН,
· карбонильная>С=O
· карбоксильная –COOH
· алкоксильная –OR (типа –ОСН3) и др.
2Функциональные группы, содержащие атом азота:
· аминогруппа –NH2
· нитрогруппа –NO2
· нитрозогруппа –NO
· нитрильная группаили цианогруппа –CN
· гидразинная –NHNH2
· амидная –CONH2 и др.
3Функциональные группы, содержащие атом серы
· тиольная (сульфгидрильная, меркапто-) –SH
· сульфидная >S
· дисульфидная –S–S–
· сульфоксидная >S=O,
· сульфонная >SO2и др.
4Функциональные группы, содержащие ненасыщенные углерод-углеродные связи:
· двойныеи тройные связи (в том числе сопряжённые диеновыесистемы) –С=С–, –С≡С–
· ароматические фрагменты –С6H5и др.
5Функциональные группы, содержащие прочие атомы:
· атомы металлов –Li
· атомы галогенов –Cl, и др.
Функциональная группа- атом или группа атомов, определяющие принадлежность соединения к определенному классу и ответственные за его химические свойства.
Структурная формула — изображение химических связей между атомами в молекуле с учетом их валентности.
Структурные изомеры - соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е химическим строением.
3. Основные правила составления названий по номенклатуре ИЮПАК для органических соединений, заместительная и радикало-функциональная номенклатура.
н оменклатура IUPAC — международная единая химическая номенклатура. Систематическая номенклатура основывается на современной теории строения и классификации органических соединений и пытается решить главную проблему номенклатуры: название каждого органического соединения должно содержать правильные названия функций (заместителей) и основного скелета углеводорода и должно быть таким, чтобы по названию можно было написать единственно правильную структурную формулу.
Родоначальная структура –главная углеродная цепь или циклическая структура в карбо- и гетероциклах.
Углеводородный радикал –остаток формульного обозначения углеводорода со свободными валентностями (см. таблицу 2).
Характеристическая группа –функциональная группа, связанная с родоначальной структурой или входящая в ее состав (см. таблицу 3).
Основные принципы номенклатуры IUPACследующие:
1. За основу названия берется самая длинная углеводородная цепь, включающая обычно старшую функциональную группу, с добавлением в суффиксе родового окончания, соответствующего последней.
2. Атомы углерода в цепи нумеруются последовательно с того конца, к которому ближе расположена старшая функциональная группа, но предпочтение при прочих равных условиях отдается двойной, затем тройной связи.
3. К основу названия добавляются, начиная с простейшего, названия заместителей, при необходимости – с указанием их количества при помощи приставок умножения ди-, тетра-, пента- и т.д. При этом для каждого заместителя указывают его место в цепи, т.е. номер атома, к которому присоединен заместитель в сквозной нумерации. Положение и название заместителей и, при необходимости, функциональных групп указывают в префексе перед названием цепи, отделяя цифры дефисом. Для функциональных групп цифры ставят перед их названием или после названия, отделяя их в суффиксе также дефисом.
4. Названия заместителей (радикалов) могут быть системные и тривиальные. Алкильные радикалы называют, изменяя окончание – ан на –ил в названии соответствующего алкана. Обычно в названии радикала отражается тип атома углерода, имеющего свободную валентность. Атом углерода, связанный с одним углеродным атомом, называется первичным (-СН3), с двумя – вторичным (СН3СН2СН3), с тремя – третичным (СН(СН3)3), с четырьмя – четвертичным (С(СН3)4).
5. Если в названии необходимо указать несколько заместителей, то они даются в порядке возрастания старшинства или по алфавиту. При перечислении суффиксов в первую очередь указывают двойную, затем тройную связи.
4.Родоначальная структура, заместители, характеристические группы. Покажите на конкретных примерах
.Родоначальная структура - химическая структура, составляющая основу называемого соединения. В ациклических соединениях в качестве родоначальной структуры рассматривается главная цепь атомов углерода, в карбоциклических и гетероциклических соединениях - цикл.
Характеристическая группа - функциональная группа, связанная с родоначальной структурой или частично входящая в ее состав.
Заместитель - любой атом или группа атомов, замещающие в ор-ганическом соединении атом водорода.

5. Основные классы биологически важных органических соединений: спиртов, фенолов, тиолов, аминов, простых эфиров, сульфидов, альдегидов, кетонов, карбоновых кислот. Органические радикалы.
Спирты — органические соединения, содержащие одну или более гидроксильных групп (−OH), непосредственно связанных с насыщенным (находящимся в состоянии sp ³-гибридизации) атомом углерода. Бывают одноатомные и многоатомные. Это зависит от количества гидроксильных групп. Взаимодействуют с оксидом железа (качественная реакция), с щелочными металлами, с галогенводородом, взаимодейсвуют с карбоновыми кислотами, спирты горят.
Фено́лы — органические соединения ароматического ряда, в молекулах которых гидроксильные группы OH− связаны с атомами углерода ароматического кольца.Участвуют в реакциях поликонденсации, взаимодействуют с щелочами,с металлами, в реакиях нитрования,галогенирования, гидрирования.
Амины- производные аммиака, в котором атомы водорода замещены органическими радикалами NH2. Взаимодействуют с водой. с кислотами.также амины горят.
Тиолы-сернистые аналоги спиртов с радикалом-SH. Тиолы вступают в реакцию оисления и присоединения. Они мало растворимы в воде.
Простые эфиры-это органические вещества,молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода R-O-R. Взаимодействуют с йодоводородом, с концентрированной серной кислотой и участвуют в реакциях окисления.
Сульфиды- органические соединения с общей формулой R-S-R
Кетоны- это органические соединения, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами. Радикал: С=О. Участвуют в реакциях гидрирования, могут взаимодействовать с аммиаком.
Альдегиды-это органические соединения, содержащие альдегидную группу –СОН.
Участвуют в реакциях окисления, восстановления,гидрирования и горения.
Карбоновые кислоты-это класс органических соединений, молекулы которых содержат одну или более функциональных групп –СООН. Могут реагировать с солями, галогенами,вступают в реакцию этерификации,взаимодействуют с некоторыми меиаллами.
6. Что такое изомерия и какие виды ее вам известны?
Изомерия -это способность веществ существовать с одинаковым молекулярным составом, но с разным строением.
1)Пространственная:
Геометрическая изомерия характерна для соединений, содержащих двойную связь или замкнутый цикл. Например, цис и транс изомеры. 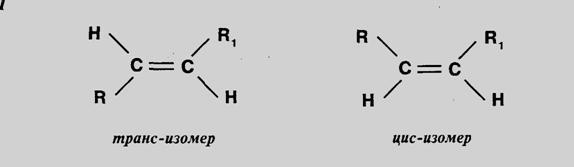
Оптическая изомерия изомеры зеркально отображенные

2) Структурная изомерия:
Межклассовая:

изомерия углеродного скелета

изомерия положения – тоже делится на:
изомерию положения кратной связи  ,
,
функциональной группы 
и радикалов- заместителей 
4) Конформационная изомерия-такая изомерия, где молекулы переходят друг в друга за счет свободного вращения атомов вокруг связей. Например «ванны» и «кресла».
Конфигурационная изомерия- молекулы имеют различное расположение атомов в пространстве. Конформационная и конфигурационная изомерии являются разновидностями стереоизомерии, при этом конфигурационная делится на энантиомерию и диастереомерию.
7. Какие электронные эффекты заместителей вы знаете?
К электронным эффектам относятся: индуктивный эффект, мезомерный эффект. Индуктивным эффектом называется смещение электронной плотности σ-связей вдоль линии связи, вызванное различием в значениях электроотрицательности атомов. Индуктивный эффект может быть положительным и отрицательным.
Мезомерный эффект- это передача электронного влияния заместителей по сопряженной системе. Этот эффект проявляют заместители, которыесвязаны с sp2- или sp- гибридизованным атомом. Мезомерный эффект передается без затухания. Он так же может быть положительным и отрицательным.
Положительным эффектом обладают заместители, которые повышают электронную плотность в сопряженной системе.К ним относят группы, которые содержат атомы с неподеленной парой электронов, которые могут передать эту пару электронов в общую систему сопряжения. Эффект характерен для групп ОН и NH2.
Отрицательный эффект проявляют заместители с электроотрицательными атомами и смещающие электронную плотность на себя. Заместитель только оттягивает электроны из общей системы сопряжения за счет своей более высокой электроотрицательности. 
8. Основные приемы номенклатуры ИЮПАК соединений.
Номенклатура представляет собой систему правил, которые позволяют дать название каждому органическому соединению.В настояшее время принята систематическая номенклатура ИЮПАК, но все равно применяются и другие обыденные названия. Ибычно они применяются в названии аминокислот, углеводов, стероидов, например, лактоза(молочный сахар). Для использования номенклатуры ИЮПАК необходимо знать содержание терминов, таких как:
заместитель(любой атом, который замещает атом водорода в соединении),,характеристическая группа(группа, связанная с родоначальной структурой), локант(буква, которая указывает на полодение заместителя или кратной связи), родоночальная структура(структура, которая составляет основу соединения)
9. Атомные орбитали и их гибридизация.
Атомная орбиталь – это функция, которая описывает плотность электронного облака в каждой точке пространства вокруг ядра атома. При определении геометрической формы химической частицы следует учитывать, что пары внешних электронов центрального атома, в том числе и не образующие химическую связь, располагаются в пространстве как можно дальше друг от друга.
Иногда используют понятие о гибридизации орбиталей центрального атома - выравнивание их энергии и формы. Гибридизация применяется для квантово-химического описания перестройки орбиталей в химических частицах по сравнению со свободными атомами. Сущность гибридизации атомных орбиталей состоит в том, что электрон вблизи ядра связанного атома характеризуется не отдельной атомной орбиталью, а комбинацией атомных орбиталей с одинаковым главным квантовым числом. Такая комбинация называется гибридной орбиталью. Как правило, гибридизация затрагивает лишь высшие и близкие по энергии атомные орбитали, занятые электронами.
В результате гибридизации появляются новые гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы расположенные на них электронные пары (или неспаренные электроны) оказались максимально удаленными друг от друга, что соответствует минимуму энергии межэлектронного отталкивания. В гибридизации участвуют не только связывающие электроны, но и неподеленные электронные пары. Например, молекула воды содержит две ковалентные химические связи между атомом кислорода и двумя атомами водорода.
sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей. Образуются две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра центрального атома.
sp2-гибридизация
Происходит при смешивании одной s- и двух p-орбиталей. Образуются три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов.
sp3-гибридизация
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
10. Структурная и пространственная изомерии.
Пространственная изомерия - это существование изомеров, имеющих одинаковый состав и порядок соединения атомов, но отличающихся характером расположения атомов или групп атомов в пространстве относительно друг друга.Бывает:
Геометрической – она характерна для соединений, содержащих двойную связь или замкнутый цикл. Например, цис и транс изомеры.

Оптической – в которой изомеры имеют одинаковые физические и химические свойства, но имеют зеркальное отображение.

Структурные изомеры – это изомеры, имеющие одинаковый качественный и количественный состав, но отличающиеся химическим строением. Различают:
Межклассовую изомерию

Изомерию углеродного скелета

Изомерия положения – тоже делится на:
изомерию положения кратной связи 
Функциональной группы 
и радикалов-заместителей 
11. Конфигурация и конформация
Пространственные изомеры делятся на два вида: конформационные и конфигурационные.
Конфигурации – это порядок расположения атомов в пространстве без учета различий, которые возникают в результате вращения вокруг одинарных связей. Эти изомеры существуют в виде различных конформаций.
Конформации – очень неустойчивые динамические формы одной и той же молекулы, которые возникают в резцльтате вращения атомов или групп атомов вокруг одинарных связей, в результате чего атомы занимают различное пространственное положение. Каждая конформация молекулы характеризуется определённой конфигурацией.
Различают: заслоненную и заторможенную конформации.
Заслонённая конформация возникает в том случае, если одинаковые заместители расположены на минимальном расстоянии друг от друга и между ними возникают силы взаимного отталкивания, и молекула должна обладать большим запасом энергии, чтобы сохранить эту конформацию. Эта конформация энергетически невыгодна.
Заторможенная конформация – возникает в том случае, если одинаковые заместители максимально удалены друг от друга и молекула обладает минимальным запасом энергии. Эта конформация энергетически выгодна.
12) ПОНЯТИЕ АРОМОТИЧНОСТИ.СОПРЯЖЕНИЕ И ЭЛЕКТРОННЫЕ ЭФФЕКТЫ
Ароматичность — особое свойство некоторых химических соединений, благодаря которому сопряженное кольцо ненасыщенных связей проявляет аномально высокую стабильность; большую чем та, которую можно было характеризующим совокупность структурных и энергетических свойств некоторых циклических молекул, содержащих систему сопряженныхдвойных связей. ЭЛЕКТРОННЫЕ ЭФФЕКТЫЗамещение атомов водорода в молекулах алканов на любой гетероатом (галоген, азот, серу, кислород и т.д) или группу вызывает перераспределение электронной плотности. Природа этого явления различна. Она зависит от свойств гетероатома (его электроотрицательности) и от типа связей, по которым это влияние распространяется.Если влияние заместителя передается при участии s-связей, то происходит постепенное изменение электронного состояния связей. Такая поляризация называется индуктивным эффектом (I), изображается стрелкой в направлении смещения электронной плотности. Индуктивный эффект обусловлен стремлением атома или группы атомов подавать или оттягивать на себя электронную плотность, в связи с чем он может быть положительным или отрицательным. Отрицательный индуктивный эффект проявляют элементы, более электроотрицательные, чем углерод, т.е. галогены, кислород, азот и другие, а также группы с положительным зарядом на элементе, связанном с углеродом. Отрицательный индуктивный эффект уменьшается справа налево в периоде и сверху вниз в группе периодической системы:F > O > NF > Cl > Br > JВ случае заместителей с полным зарядом отрицательный индуктивный эффект увеличивается с возрастанием электроотрицательности атома, связанного с углеродом:>O+- >>N+<В случае сложных заместителей отрицательный индуктивный эффект определяется природой атомов, составляющих заместитель. Кроме этого индуктивный эффект зависит от характера гибридизации атомов. Так, электроотрицательность атомов углерода зависит от гибридизации электронных орбиталей:sp3 < sp2 <spПоложительный индуктивный эффект проявляют: элементы, менее электроотрицательные, чем углерод, группы с полным отрицательным зарядом, алкильные группы. +I – эффект уменьшается в ряду:(СН3)3С- > (CH3)2CH- > CH3-CH2- > CH3- > H- Сопряжение связей один из важнейших видов внутримолекулярного взаимноговлияния атомов и связей в органических соединениях; обусловлено взаимодействием электронных систематомов (прежде всего валентных электронов
13)СТЕРЕОИЗОМЕРЫ. Оптическая изомерия молекул. ЭЛЕМЕНТЫ СИММЕТРИИ МОЛЕКУЛ Стереоизомеры (пространственные изомеры) — химические соединения, имеющие одинаковое строение, но отличающиеся пространственным расположением атомов. Стереоизомеры имеют одинаковую конституцию, но различные конфигурацию и/или конформацию.
Многие органические соединения представляют собой смесь двух так называемых оптических изомеров - веществ, имеющих совершенно одинаковые химические свойства, но различающихся так называемой оптической активностью. Они по-разному отклоняют луч поляризованного света, проходящий через их кристаллы или растворы, и в соответствии с направлением этого отклонения называются право- или левовращающими; свойством этим обладают лишь чистые изомеры, смеси же их оптически неактивны. Явление это связывают с наличием в молекуле таких веществ так называемого асимметричного атома углерода, к четырем валентностям которого могут в разном порядке присоединяться четыре соответствующих радикала симметрия СИММЕТРИЯ МОЛЕКУЛ хар-ка молекулы, определяемая совокупностью возможных операций точечной симметрии для еёравновесной конфигурации.
| 14) АССИМЕТРИЧЕСКИЙ АТОМ УГЛЕРОДА Атом углерода, связанный с четырьмя различными группами, называется асимметрическим атомом углерода.Многие, но не все, молекулы, содержащие асимметрический атом углерода, диссимметричны. Многие, но не все, диссимметричные молекулы содержат асимметрический атом углерода. Существуют молекулы, в которых имеются асимметрические атомы углерода и которые все же не являются диссим-метричными). В то же время существуют диссимметричные молекулы, не содержащие асимметрического атома углерода.Таким образом, наличие или отсутствие асимметрического атома углерода не является критерием диссимметрки. | |||||||
| 15) ОПТИЧЕСКАЯ АКТИВНОСТЬ.ЭНАНТИОМЕРЫ.ДИАСТЕРЕОМЕРИЯ.. ОПТИЧЕСКАЯ АКТИВНОСТЬ, способность в-ва- твердого, жидкого или газа-вращать плоскость поляризациипроходящего через него света. Такие в-ва наз. оптически активными. Поворот происходит либо вправо (по часовой стрелке), либо влево (против часовой стрелки), если смотреть навстречу ходу лучей света. Оптической активностью обладают энантиомеры Энантиомеры — пара стереоизомеров, представляющих собой зеркальные отражения друг друга, не совмещаемые в пространстве. ДИАСТЕРЕОМЕРИЯДИАСТЕРЕОМЕРИЯ - вид пространственной изомерии химических соединений, не являющихся оптическими изомерами | |||||||
| 16) РАЦЕМАТЫ. РАСЩЕПЛЕНИЕ РАЦЕМАТОВ. РАЦЕМАТЫ, состоят из эквимол. кол-в энантиомеров и не обладают оптич. активностью" Существуют в виде мол.соединений (истинные рацематы) и рацемич. смесей кристаллич. энантиомеров (конгломерата, т. е. простой смесикристаллов право- и левовращающего антиподов) или смешанных кристаллов, образованных обоимиэнантиомерами. Рацемизация. Рацематы образуются также в результате рацемизации оптически активных соед., представляющей собой обратимое взаимное превращение энантиомеров. В отсутствие асимметризующих факторов этот процесс заканчивается установлением динамич. равновесия между ними при строго эквимолярном содержанииэнантиомеров в смеси. Обратный рацемизации процесс - выделение энантиомеров из их рацемич. смеси-наз.расщеплением рацематов. Впервые расщепление рацематов было осуществлено (Л. Пастер, 1848) прикристаллизации натрий-аммониевой соли виноградной к-ты; выделенный осадок представлял собой энан-тиоморфную смесь кристаллов, а индивидуальные кристаллы-либо лево-, либо правовращающие формы винной к-ты. Известно лишь неск. десятков примеров расщепления рацематов при спонтанной кристаллизацииэнантиомеров. Более общий метод заключается в том, что в пересыщ. р-р рацематов вводят затравку кристалловодного из энантиомеров, что приводит к кристаллизации именно этого оптич. изомера. Затем в оставшийся р-р добавляют затравку кристаллов второго энантиомера и тем самым вызывают его кристаллизацию, поскольку именно этим оптич. изомером пересыщен оставшийся р-р, и т.д. Расщепление рацематов путем затравочнойкристаллизации реализовано в пром-сти (напр., для D,L-глутаминовой к-ты), однако этот способ также не универсален.Др. способ расщепления рацематов-биохимический-основан на том, что микроорганизмы при своем развитии используют только один из двух оптич. изомеров, присутствующих в рацематах. Остающийся энантиомер м. б. выделен. Этот путь позволяет получать только один из энантиомеров, второй необратимо теряется. Избирательность действия микроорганизмов по отношению к энантиомерам связана с высокой энантиоселективностью содержащихся в микроорганизмах ферментов. Поэтому для разделения энантиомеров нет необходимости применять сами микроорганизмы, достаточно использовать в этих целях выделенные из биол. объектов ферментные препараты. Наиб.широко для расщепления рацематов применяют гидролазы - ферменты, катализирующие гидролиз сложноэфирных или амидных связей. При этом гидролизу подвергается только один из двух энантиомеров субстрата, а разделение конечной смеси, напр., своб. к-ты и ее сложного эфира м. б. легко осуществлено обычными методами. Так, при действии фермента ацилазы на рацемич. N-ациламинокислотугидролизу (а следовательно, и отделению) подвергается лишь L-форма. | |||||||
| 17) Связь пространственного строения соединений с ихбиологической активностью. В организме реакции протекают с участием биокатализаторов — ферментов. Ферменты построены изхиральных молекул а-аминокислот. Поэтому они могут играть роль хиральных реагентов, чувствительных к хиральности взаимодействующих с ними субстратов. Таким образом,пространственное строение молекул связано со стереоспецнфичностью биохимических процессов. Стереоспецифичность процессов, протекающих в организме, состоит в том, что в реакцию вовлекаются определенные стереоизомеры и результатом реакции являются такжестереохимически определенные продукты. |
18) КАК ДЕЛЯТСЯ КИСЛОТЫ В ЗАВИСИМОСТИ ОТ ПРИРОДЫ ЭЛЕМЕНТВ, СВЯЗАННОЙ С ПРОТОНОМ?
В зависимости от природы элемента, с которым связан протон, кислоты делятся на ОН-кислоты (карбоновые кислоты, фенолы, спирты), SH-кислоты (тиолы), NH-кислоты (амины, амиды, имиды), СН-кислоты (углеводороды и их производные). Элемент и связанный с ним атом водорода называют кислотным центром
19. Сравните кислотность этиленгликоля и этанола.
Кислотность этиленгликоля выше, чем у этанола.Благодаря более выраженным кислотным свойствам многоатомные спирты реагируют с Сu(OH)2, образуя растворимые комплексные соединения – хелаты.


Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!