Обратимый процесс (то есть равновесный) — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений.
Термодинамически необратимыми называютпроцессы, при проведении которых в прямом и обратном направлениях система не возвращается в исходное состояние без каких- либо изменений в окружающей среде. Иными словами, при возвращении системы в исходное состояние в окружающей среде остаются «следы» протекания этих процессов. Термодинамическинеобратимые процессы – реальные процессы. Все процессы, протекающие в природе, являются термодинамически необратимыми.
Второй закон термодинамики.
Второй закон термодинамики устанавливает критерии самопроизвольного протекания процессов и равновесного состояния термодинамических систем. Согласно второму закон термодинамики критериями самопроизвольности процессов и равновесного состояния термодинамических систем является изменение энтропии. Формулировка закона: Любой самопроизвольный процесс в изолированной системе приводит к возрастанию энтропии этой системы (dS>0).Самопроизвольный процесс приводит систему к состоянию равновесия, при котором энтропия достигает своего максимального значения (dS=0). Другими словами, энтропия изолированной системы не может убывать.
Третий закон термодинамики
Формулировка: При температуре абсолютного нуля (T = 0K) все идеальные кристаллические вещества имеют одинаковую энтропию, равную нулю. Третий закон термодинамики находится в согласии с формулой Больцмана (S = k·lnW), так как для идеального кристалла при абсолютном нуле W = 1, следовательно S= k·lnW= k·ln1 = 0; S = 0. Третий закон термодинамики используется для вычисления абсолютных энтропий веществ при любой температуре T.
Энтропия. Статистическое и термодинамическое толкование энтропии. Стандартная энтропия.
Термодинамическая энтропия 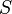 , часто именуемая просто энтропией, —физическая величина, используемая для описания термодинамической системы, одна из основных термодинамических величин. Энтропия это количественная мера беспорядка системы.Энтропия является функцией состояния и широко используется в термодинамике, в том числе технической(анализ работы тепловых машин и холодильных установок) и химической(расчёт равновесий химических реакций)
, часто именуемая просто энтропией, —физическая величина, используемая для описания термодинамической системы, одна из основных термодинамических величин. Энтропия это количественная мера беспорядка системы.Энтропия является функцией состояния и широко используется в термодинамике, в том числе технической(анализ работы тепловых машин и холодильных установок) и химической(расчёт равновесий химических реакций)
Статистическая энтропия.
В 1877 году Людвиг Больцман установил связь энтропии с вероятностью данного состояния. Позднее эту связь представил в виде формулы Макс Планк:
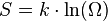
где константа  1,38·10−23 Дж/К названаПланком постоянной Больцмана, а
1,38·10−23 Дж/К названаПланком постоянной Больцмана, а 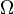 —статистический вес состояния, является числом возможных микросостояний (способов), с помощью которых можно составить данное макроскопическое состояние. Этот постулат, названный Альбертом Эйнштейном принципом Больцмана, положил начало статистической механике, которая описывает термодинамические системы, используя статистическое поведение составляющих их компонентов. Принцип Больцмана связывает микроскопические свойства системы (
—статистический вес состояния, является числом возможных микросостояний (способов), с помощью которых можно составить данное макроскопическое состояние. Этот постулат, названный Альбертом Эйнштейном принципом Больцмана, положил начало статистической механике, которая описывает термодинамические системы, используя статистическое поведение составляющих их компонентов. Принцип Больцмана связывает микроскопические свойства системы (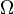 ) с одним из её термодинамических свойств (
) с одним из её термодинамических свойств (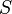 ).
).
Стандартная энтропия. Энтропия вещества в нормальных условиях (при температуре 25°С (298,15 К) и давлению 101 325 Па). Имеются таблицы стандартной энтропии разных веществ.Значениями энтропии веществ пользуются для установления изменения энтропии системы в результате соответствующих процессов (по закону Гесса).
103. Свободная энергия Гиббса(изобарно-изотермический потенциал). Энтальпийный и энтропийный факторы. Экзо- и эдноэрганические процессыв организме
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
 , гдеU-внутр энергия, V- объемP-давление, S- энтропия
, гдеU-внутр энергия, V- объемP-давление, S- энтропия
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста её энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)



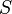 , часто именуемая просто энтропией, —физическая величина, используемая для описания термодинамической системы, одна из основных термодинамических величин. Энтропия это количественная мера беспорядка системы.Энтропия является функцией состояния и широко используется в термодинамике, в том числе технической(анализ работы тепловых машин и холодильных установок) и химической(расчёт равновесий химических реакций)
, часто именуемая просто энтропией, —физическая величина, используемая для описания термодинамической системы, одна из основных термодинамических величин. Энтропия это количественная мера беспорядка системы.Энтропия является функцией состояния и широко используется в термодинамике, в том числе технической(анализ работы тепловых машин и холодильных установок) и химической(расчёт равновесий химических реакций) 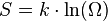
 1,38·10−23 Дж/К названаПланком постоянной Больцмана, а
1,38·10−23 Дж/К названаПланком постоянной Больцмана, а 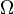 —статистический вес состояния, является числом возможных микросостояний (способов), с помощью которых можно составить данное макроскопическое состояние. Этот постулат, названный Альбертом Эйнштейном принципом Больцмана, положил начало статистической механике, которая описывает термодинамические системы, используя статистическое поведение составляющих их компонентов. Принцип Больцмана связывает микроскопические свойства системы (
—статистический вес состояния, является числом возможных микросостояний (способов), с помощью которых можно составить данное макроскопическое состояние. Этот постулат, названный Альбертом Эйнштейном принципом Больцмана, положил начало статистической механике, которая описывает термодинамические системы, используя статистическое поведение составляющих их компонентов. Принцип Больцмана связывает микроскопические свойства системы ( , гдеU-внутр энергия, V- объемP-давление, S- энтропия
, гдеU-внутр энергия, V- объемP-давление, S- энтропия


