Берём формулу  и подставляем в неё
и подставляем в неё  . Получаем:
. Получаем:
p = nkT.
Вспомним теперь, что  A, где ν — число молей газа:
A, где ν — число молей газа:
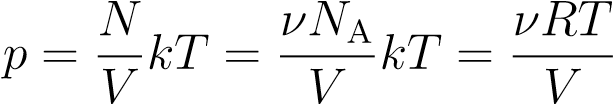 ,
,
откуда
pV = νRT. (3)
Соотношение (3) называется уравнением Менделеева — Клапейрона. Оно даёт взаимосвязь трёх важнейших макроскопических параметров, описывающих состояние идеального газа — давления, объёма и температуры. Поэтому уравнение Менделеева — Клапейрона называется ещё уравнением состояния идеального газа.
Учитывая, что 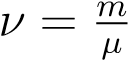 , где m — масса газа, получим другую форму уравнения Менделеева — Клапейрона:
, где m — масса газа, получим другую форму уравнения Менделеева — Клапейрона:
 (4)
(4)
Есть ещё один полезный вариант этого уравнения. Поделим обе части на V:

Но  — плотность газа. Отсюда
— плотность газа. Отсюда
 (5)
(5)
В задачах по физике активно используются все три формы записи (3)—(5).
Изопроцессы
На протяжении этого раздела мы будем придерживаться следующего предположения: масса и химический состав газа остаются неизменными. Иными словами, мы считаем, что:
• m = const, то есть нет утечки газа из сосуда или, наоборот, притока газа в сосуд;
• µ = const, то есть частицы газа не испытывают каких-либо изменений (скажем, отсутствует диссоциация — распад молекул на атомы).
Эти два условия выполняются в очень многих физически интересных ситуациях (например, в простых моделях тепловых двигателей) и потому вполне заслуживают отдельного рассмотрения.
Если масса газа и его молярная масса фиксированы, то состояние газа определяется тремя макроскопическими параметрами: давлением, объёмом и температурой. Эти параметры связаны друг с другом уравнением состояния (уравнением Менделеева — Клапейрона).
Термодинамический процесс
Термодинамический процесс (или просто процесс) — это изменение состояния газа с течением времени. В ходе термодинамического процесса меняются значения макроскопических параметров — давления, объёма и температуры.
Особый интерес представляют изопроцессы — термодинамические процессы, в которых значение одного из макроскопических параметров остаётся неизменным. Поочерёдно фиксируя каждый из трёх параметров, мы получим три вида изопроцессов.
1. Изотермический процесс идёт при постоянной температуре газа: T = const.
2. Изобарный процесс идёт при постоянном давлении газа: p = const.
3. Изохорный процесс идёт при постоянном объёме газа: V = const.
Изопроцессы описываются очень простыми законами Бойля — Мариотта, Гей-Люссака и Шарля. Давайте перейдём к их изучению.
Изотермический процесс
При изотермическом процессе температура газа постоянна. В ходе процесса меняются только давление газа и его объём.
Установим связь между давлением p и объёмом V газа в изотермическом процессе. Пусть температура газа равна T. Рассмотрим два произвольных состояния газа: в одном из них значения макроскопических параметров равны p 1 ,V 1 ,T, а во втором — p 2 ,V 2 ,T. Эти значения связаны уравнением Менделеева — Клапейрона:

Как мы сказали с самого начала, масса газа m и его молярная масса µ предполагаются неизменными. Поэтому правые части выписанных уравнений равны. Следовательно, равны и левые части: p 1 V 1 = p 2 V 2.
Поскольку два состояния газа были выбраны произвольно, мы можем заключить, что в ходе изотермического процесса произведение давления газа на его объём остаётся постоянным:
pV = const.
Данное утверждение называется законом Бойля — Мариотта. Записав закон Бойля — Мариотта в виде
const
p =,
V
можно дать и такую формулировку: в изотермическом процессе давление газа обратно пропорционально его объёму. Если, например, при изотермическом расширении газа его объём увеличивается в три раза, то давление газа при этом в три раза уменьшается.
Как объяснить обратную зависимость давления от объёма с физической точки зрения? При постоянной температуре остаётся неизменной средняя кинетическая энергия молекул газа, то есть, попросту говоря, не меняется сила ударов молекул о стенки сосуда. При увеличении объёма концентрация молекул уменьшается, и соответственно уменьшается число ударов молекул в единицу времени на единицу площади стенки — давление газа падает. Наоборот, при уменьшении объёма концентрация молекул возрастает, их удары сыпятся чаще и давление газа увеличивается.



 и подставляем в неё
и подставляем в неё  . Получаем:
. Получаем: A, где ν — число молей газа:
A, где ν — число молей газа: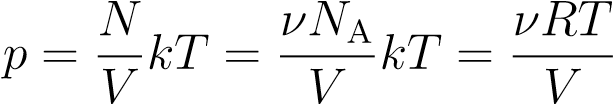 ,
,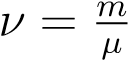 , где m — масса газа, получим другую форму уравнения Менделеева — Клапейрона:
, где m — масса газа, получим другую форму уравнения Менделеева — Клапейрона: (4)
(4)
 — плотность газа. Отсюда
— плотность газа. Отсюда (5)
(5)



