Известно, что рыхлые горные породы образуются в результате выветривания изверженных горных пород и представляют собой смесь продуктов химического и физического выветривания, т.е. смесь первичных и вторичных минералов. Первичные минералы обладают различной устойчивостью против разрушения, поэтому в составе рыхлых пород они могут встречаться в различных соотношениях.
Минерал – это однородное в химическом отношении тело, обладающее постоянством химического состава и определенными физическими свойствами. По физическому состоянию минералы бывают твердые, жидкие и газообразные. Многие минералы имеют определенную форму и являются кристаллическими. Большинство минералов аморфны. Количество первичных минералов, встречающихся в изверженных породах, достигает более 3000.
Примерно 92% общей массы изверженных пород состоит из четырех групп минералов: полевых шпатов, роговых обманок и пироксенов, кварца и слюды. Из них наибольшей механической прочностью обладает кварц, затем следуют полевые шпаты, роговые обманки и пироксены, слюды. В связи с этим при физическом выветривании они дробятся с различной скоростью. Более прочные будут разрушаться медленнее и сохраняться в виде более крупных частиц. Менее прочные минералы будут дробиться сильнее и быстрее переходить в более мелкие гранулометрические фракции.
Первичные минералы различаются между собой химическим составом и строением кристаллической решетки, что и предопределяет их неодинаковую устойчивость против выветривания.
Отношение радиуса катиона к радиусу аниона определяет форму кристаллической решетки и характер элементарной ячейки.
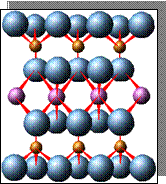
Элементарной ячейкой кремнекислородного соединения является тетраэдр, четыре вершины которого заняты крупными анионами О2+ (r = 1,32 А0), а в центре находится катион с небольшим радиусом Si4+ (r = 0,39 А0). Данный тетраэдр является основной структурной ячейкой всех существующих соединений кремния с кислородом. Ячейка SiO4 заряжена отрицательно (на 4 положительных заряда Si приходится 8 отрицательных зарядов кислорода). Отрицательный заряд ячейки может быть компенсирован путем присоединения катионов или соединением с другими кремнекислородными тетраэдрами.
Соединение тетраэдров между собой происходит через вершины, при этом определенные ионы кислорода одновременно связаны с двумя ионами кремния. Оставшиеся свободные валентности кислородных анионов нейтрализуются катионами. Кремнекислородные тетраэдры могут образовывать непрерывные структуры в виде одинарных цепочек, что характерно для пироксенов. В случае, когда кремнекислородные тетраэдры соединяются между собой таким образом, что каждый из четырех кислородных ионов принадлежит двум тетраэдрам, получается структура, не имеющая свободных ионов кислорода. Подобную структуру имеет кварц (SiO2)n, который отличается большой прочностью.
Такая же форма трехмерных каркасов характерна и для полевых шпатов, однако в некоторых из тетраэдров Si заменен Al3+. В результате такого замещения образуется алюмокислородный комплекс (AlO4)5ˉ. Он несет на единицу больший отрицательный заряд, чем SiO4, который компенсируется тем или иным катионом. Этим можно объяснить химический состав алюмосиликатов, к которым принадлежат полевые шпаты: альбит Na[Al,Si3O8], анортит Ca[Al2Si2O8] и др. В альбите из четырех ионов Si один замещен на Al3+, возникший отрицательный заряд компенсирован Na. В анортите из четырех ионов Si4+ два иона замещены на Al3+, два отрицательных заряда компенсируются Ca2+.
Минералы, в которых ион Si4+ замещается ионом Fe3+ , называются феррисиликатами. Изоморфные замещения происходят в кристаллической решетке в период ее образования, качество и количество замещающих ионов зависит от состава и концентрации окружающего раствора.
В результате химического выветривания первичные минералы изменяют свой состав и внутреннюю структуру. Выветривание в первую очередь затрагивает поверхность минералов, поэтому с их измельчением возрастает суммарная поверхность, и процессы разрушения ускоряются.
Важнейшим фактором химического выветривания является вода, а также присутствующие в почве кислород и углекислота. Основными типами реакций, происходящими в почве, являются: гидратация, гидролиз, растворение, окисление-восстановление.
Гидратация - это притяжение молекул воды к поверхности минералов. Реакции гидролиза приводят к замене катионов кристаллической решетки на Н+ - ионы воды. Присутствие в минералах Fe2+ также способствует выветриванию, так как окисление Fe2+ до Fe3+ приводит к изменению объемов, занимаемых ионами в кристаллической решетке, что вызывает в конечном итоге ее разрушение.
При полном разрушении силикатов образуются простые продукты выветривания: гидрата окислов Fe, Al, одно- и двухвалентных оснований, гидрат окиси кремния (кремниевая кислота) и некоторые другие кислоты. В коллоидном и растворенном состоянии кремниевая кислота может вступать в реакцию с полуторными окислами, образуя при этом сложные соединения. Освобождающиеся при выветривании основания, реагируя с кислотами, образуют простые соли, являющиеся вторичными минералами: карбонаты, сульфаты, нитраты, хлориды, фосфаты, силикаты. В разной степени растворяясь в воде, они могут накапливаться в условиях засушливого климата.
Помимо простых вторичных минералов, при выветривании могут образовываться вторичные алюмосиликаты и феррисиликаты. Эти минералы входят в состав различных глин и поэтому носят название глинистых (глинных). Являясь частью почв, они определяют очень важные для развития растений почвенные свойства (поглотительная и обменная способность, кислотность, буферность, водоудерживающая способность и др.). Из большого числа глинных минералов, для почв наибольшее значение имеют группы: каолинита, мантмориллонита и гидрослюд.
Минералы группы каолинита имеют двухслойную кристаллическую решетку, которая состоит из двух слоев: слоя кремнекислородных тетраэдров и слоя алюмо-кислородно-гидроксильных октаэдров.
В кремнекислородном слое вершины тетраэдров повернуты в одну сторону и являются “кислородными мостиками”, связывающими тетраэдрический и октаэдрический слои: О2¯ одновременно связан с атомами Si4+ и Al3+. В целом элементарная ячейка каолинита электронейтральна и соответствует формуле Al4Si4O10(OH)8 или Al2Si2O5(OH)4. При разламывании пакетов боковые поверхности кристаллов имеют ненасыщенные валентности, что может вызывать адсорбцию ионов из окружающего раствора. Расстояние между пакетами каолинита равна 7,2 А0 и не изменяется. Он не впитывает воду в межпакетные пространства и поэтому не набухает.
Монтмориллонит состоит из трехслойных пакетов: октаэдрический слой заключен между двумя тетраэдрическими. Межпакетные расстояния монтмориллонита изменяются от 9,4 до 21,4 А0 и варьируют в зависимости от количества поглощенной воды. Способность монтмориллонита к набуханию значительна. Структура монтмориллонита отвечает химической формуле Al4Si8O20(OH)4 · nН2О. В этой формуле nН2О - вода, разделяющая пакеты. Кристаллическая решетка электрически нейтральна и содержит по 44 положительных и отрицательных заряда. Минералам группы монтмориллонита характерны разнообразные изоморфные замещения: Si в тетраэдрических слоях может быть частично замещен на Al3+, а алюминий в октаэдрическом слое замещается Fe2+ и Fe3+, Mg2+ и другими металлами.
Из глинистых минералов в почвах большое место принадлежит группе гидрослюд, в которую входят гидромусковит (иллит), гидробиотит и другие гидратированные слюды. Кристаллическая решетка иллита построена так же, как и у монтмориллонита. Разница состоит в том, что в тетраэдрах часть Si4+ (до 1/4) замещена Al3+. При этом образовавшийся отрицательный электрический заряд компенсируется ионом К+, который прочно связывает пакеты между собой. Поэтому межпакетная вода в иллите отсутствует.
Кроме распространенных индивидуальных глинистых минералов, в природе существуют так называемые смешанно-слоистые минералы, пластинки которых состоят из чередующихся пакетов различных минералов, например, иллита, монтмориллонита и т.д.
Глинистые минералы в природе образуются двумя путями. Первый путь представляет собой постепенное изменение первичных минералов, что приводит к образованию новых форм кристаллических решеток. Вторичные минералы могут возникать также путем синтеза из простых продуктов распада первичных минералов: полевых шпатов, амфиболов, вулканических стекол и т.д. Образующиеся при распаде вещества вступают между собой в реакции взаимодействия, продукты которых выпадают в осадок.
Скорость разрушения первичных и механизм образования вторичных минералов зависят от ряда факторов: 1) особенности первичного минерала (кристаллическая структура, степень дисперсности, химический состав и т.д.), 2) сочетание первичных минералов, 3) температуры, 4) влажности, 5) реакции среды, 6) условий выноса продуктов выветривания, 7) жизнедеятельности организмов.
Основные породы разрушаются быстрее кислых и поэтому продукты их выветривания в большей мере обогащены каолинитом. Сухой и холодный климат замедляет разрушение минералов, а теплый и влажный - ускоряет. В условиях промывного режима происходит вымывание щелочей, щелочноземельных оснований, кремнезема, и, как следствие, из гидрослюд и монтмориллонита образовывается каолинит и галлузит.
Так как в различных гранулометрических фракциях преобладают различные минералы, поэтому рыхлые породы, подвергаясь сортировке по фракциям, сортируются также по минералогическому составу. Например, в песках содержатся в основном, первичные минералы (кварц, полевые шпаты), в глинах - вторичные, в суглинках - смесь первичных и вторичных. Минералогический состав илистой фракций (< 0,001мм) резко отличается от состава более крупных фракций. Из первичных минералов в этой фракции встречается главным образом кварц, который из-за химической устойчивости может сохраниться в виде очень мелких частиц, другие минералы этой группы присутствуют в очень малых количествах. В данной фракции сосредотачивается основная масса вторичных алюмосиликатов.
Химический состав почв тесно зависит от состава почвообразующих пород. Химические элементы, входящие в состав литосферы, содержатся в ней в неодинаковых количествах. При этом состав литосферы значительно отличается от состава почвы (табл.4)
Литосфера почти на половину состоит из кислорода – 47,2%, второе место занимает Si – 27,6%, потом Al – 8,8% и Fe – 5,1%. Калий, кальций, магний составляют по 2-3%, остальные химические элементы составляют менее 1%.
Почвы, по химическому составу, значительно отличаются от литосферы. В них более высокое среднее содержание О и Н, в 20 раз больше С, в 10 - N, меньше, чем в литосфере -Al, Fe, Ca, Na, K и Mg. Состав почв относительно почвообразующих пород более динамичен.
Таблица 4.
Среднее содержание химических элементов в литосфере и почвах, в весовых % (по Виноградову, 1950)
| Элементы
| Литосфера
| Почва
| Элементы
| Литосфера
| Почва
|
| O
| 47,2
| 49,0
| C
| (0,1)
| 2,0
|
| Si
| 27,6
| 33,0
| S
| 0,09
| 0,085
|
| Al
| 8,8
| 7,13
| Mn
| 0,09
| 0,085
|
| Fe
| 5,1
| 3,8
| P
| 0,08
| 0,08
|
| Ca
| 3,6
| 1,37
| N
| 0,01
| 0,1
|
| Na
| 2,64
| 0,63
| Cu
| 0,01
| 0,002
|
| K
| 2,6
| 1,36
| Zn
| 0,005
| 0,005
|
| Mg
| 2,1
| 0,6
| Co
| 0,003
| 0,0008
|
| Ti
| 0,6
| 0,46
| B
| 0,0003
| 0,001
|
| H
| (0,15)
| ?
| Mo
| 0,0003
| 0,0003
|
СВОЙСТВА ПОЧВЫ
Поглотительная способность. Во всех почвах содержатся коллоидные частицы (< 0,0001 мм). Они обладают многими специфическими свойствами. Поэтому от их количества зависит плодородие почвы. Содержанием коллоидных частиц прежде всего определяется поглотительная способность почвы - способность поглощать из окружающей среды и удерживать растворимые и взмученные в воде твёрдые вещества, пары воды и газа. Коллоидные и близкие к ним частицы почвы, обладающие способностью поглощения, называют почвенными поглощающим комплексом (ППК).
Учение о поглотительной способности почв разработано русским учёным К. К. Гедройцем (1872-1932). Различают несколько видов поглощения: механическое, физическое (молекулярное), химическое, физико-химическое и биологическое.
Механическое поглощение - способность почвы задерживать при фильтрации частицы, находящиеся во взвешенном состоянии, превышающее по диаметру почвенные поры. Механически задерживаются также частицы почвы, попадающие в трещины, образующиеся на поверхности почвы. Чем больше в почве тонких фракций механического состава, тем выше механическое поглощение.
Физическое поглощение (или молекулярная адсорбция) основано на способности коллоидов почвы притягивать к поверхности и удерживать на ней молекулы вещества (воды, растворов, газов, например аммиака), не изменяя их свойств.
Химическое поглощение. Вещества, входящие в почвенный раствор и твёрдую фазу почвы, вступают в химическое взаимодействие с находящимися в почве солями с образованием слаборастворимых или нерастворимых в воде соединений.
Физико-химическое поглощение, или обменная адсорбция (обменная поглотительная способность). Она основана на способности почвенных коллоидов поглощать из почвенного раствора и удерживать на поверхности катионы в обмен на другие катионы в ППК.
Энергия поглощения разных катионов зависит от их валентности и атомной массы: чем выше валентность, а в пределах одной валентности чем выше атомная масса, тем выше и энергия поглощения. Исключением является водород (Н). В порядке возрастающей энергии поглощения катионы располагаются в следующей последовательности:
Na < NH < K < Mg < H < Ca < Al < Fe
Количество катионов, которое способна поглотить почва, называется ёмкостью катионного поглощения, или ёмкостью обмена и выражается в миллиграмм-эквивалентах (мг-экв.) на 100 г почвы. Величина ёмкости поглощения (Т) у разных почв неодинакова и зависит от наличия минеральных и органических коллоидов почвы. Так, у супесчаных почв она составляет всего 5-10 мг-экв., у суглинистых малогумусных - 15-20, а у суглинистых чернозёмов - 40-50 мг-экв. и выше.
Чем больше в ночве глинистых частиц и гумуса, тем больше емкость поглощения.
Очень большое значение для плодородия почв имеет и состав поглощенных оснований. В нем могут быть кальций, магний, водород, калий, натрии, аммоний, железо и алюминий. Двухвалентные катионы (Са^, Mg^+) хорошо коагулируют коллоиды, способствуют 1от_(х)1)1^ом^1ию_с11^'кту11ь1, создают нр.йтря.цБную или близкую к ней реакцию почвы. В агрономическом отношении это наиболее ценные катионы.
Одновалентные катионы (К+, _Ма+) диспергир_уют_. цочведные коллоиды, разрушают лочвр'нные. яг.рега_ц)и-.-а_с_ними и структуру, при большом количестве вызывают щелочную реакцию..
Поглощенный водород разрушает почвенные коллоттТГы и подкисляет почву. Подкисляющее действие может оказывать на почву II алюминий. Будучи вытесненным:.; из поглощенного состояния, он в почвенном растворе переходит в соединение АlСlз, которое!! результате взаимодействия с водой образует соляную кислоту.
В зависимости от наличия в поглощенном состоянии, с одной стороны, водорода (II) и алюминия (Аl), а с другой—двухвалентных катионов (Са и Mg) различают почвы, насыщенные. основаниями и не насыщенные ими. К первым относятся ночвы, в поглощающем комплексе которых; '.находятся
только катионы кальция, магния, калия и отсутствует водород; ко вторым - почвы, в поглощающий комплекс которых наряду с другими катионами входят водород, алюминий. Насыщены основаниями черноземы, каштановые почвы, сероземы, а не насыщены дерново-подзолистые почвы, красноземы, болотные. Почвами с высокой насыщенностью натрием являются солонцы. Они бесструктурны, расплываются от дождя, а при высыхании сплываются в плотную массу.
Для характеристики агрохимических свойств почвы важное значение имеет сумма поглощенных оснований (S). При ее определении учитывают количество содержащихся в.поглощенном состоянии катионов, (в дерново-подзолистых почвах Са, Mg), за исключением водорода. Этo количество выражают также в миллиграмм-эквивалентах на 100 г почвы. У разных почв оно колеблется от 2 до 50 мг-экв. и выше. Например, на легких дерново-подзолистых почвах S может быть всего 2-5 мг-экв., на легкосуглиннстых— 5-10, на тяжелых суглинках - 15-20, на лесостепных почвах и черноземах: от 20 до 50 мг-экв. Чем больше S, тем агрономически ценнее ночва.
С суммой поглощенных оснований связано вычисление степени насыщенности почвы основаниями (V). Она показывает, какую часть от емкости поглощения почвы занимают поглощенные основания, выражается в процентах от общей емкости поглощения, включающей содержание ионов водорода (Н), и вычисляется по формуле:
V= S *100% /S+Нг
Биологическое поглощение. Этот вид поглощения в почве осуществляется жизнедеятельностью растений и микроорганизмов. Одной из важных особенностей биологического поглощения является избирательная способность микроорганизмов и растений, проявляющаяся в том, что они берут из почвы преимущественно те вещества, которые им необходимы для построения своего тела, для жизни.