

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Интересное:
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Алканы-ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации.
Присутствуют во всех нефтях и являются одной из составных ее частей.
Физические свойства.
-температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи;
-при нормальных условиях неразветвлённые алканы с CH4 до C4H10 — газы (образуют основную массу природного и попутного газа); с C5H12 до C13H28 — жидкости (составляют основную массу бензиновой и керосиновой фракций нефти); после C14H30 — твёрдые тела (входят в состав нефтяного парафина и церезина);
- температуры плавления и кипения понижаются от менее разветвленных к более разветвленным;
Химические свойства.
Алканы имеют низкую химическую активность. Это объясняется тем, что единичные связи C—H и C—C относительно прочны и их сложно разрушить.
Химические превращения метановых углеводородов могут происходить либо за счет отрыва атомов водорода с последующим замещением их другими атомами или группами, либо за счет разрыва цепи углеродных атомов (реакции замещения и расщепления).
1. Галогенирование.
CH4 + Cl2 → CH3Cl + HCl CH3Cl + Cl2 → CH2Cl2 + НCl
хлористый метил хлористый метилен
CH2Cl2 + Cl2 → CHCl3 + НCl CHCl3 + Cl2 → CCl4 + HCl
хлороформ четыреххлористый углерод
Реакция Фриделя-Крафтса (алкилирование ароматических углеводородов)

2. Нитрование. (Реакция Коновалова)
R – H + HO - NO2 → R - NO2 + H2O при температуре 140 °C
|
|
3. Окисление
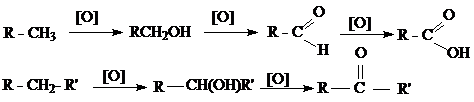
4. Дегидрирование (при высоких температурах и в присудствии катализатора)

5. Термическое расщепление (при высоких температурах и в присудствии катализатора)

Циклоалканы -циклические насыщенные углеводороды, по химическим свойствам близки к предельным углеводородам. Входят в состав нефти.
Химические свойства.
1.Реакции присоединения с раскрытием кольца и образованием ациклических (линейных) продуктов:
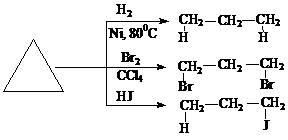
2. Дегидрирование (реакция Зелинского):

3. Реакция свободнорадикального замещения в цикле:

4. Окисление (образуются двухосновные карбоновые кислоты)

Ароматические углеводороды – это непредельные углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей. Общая формула CnH2n-6 Молекулы находятся в sp2 – гибридизации. Атомы углерода располагаются в одной плоскости (цикл имеет плоское строение).
Физические свойства
Агрегатное состояние - жидкость с различными температурами кипения. Конденсированные полициклические арены - твердые вещества с различными температурами плавления.
Химические свойства
Из-за повышенной устойчивости ароматической системы, несмотря на ненасыщенность, склонна к реакциям замещения, а не присоединения.
1. Реакции электрофильного замещения в кольце.
Нитрование

Сульфирование бензола с получением сульфокислоты:

галогенирование

2. Присоединения.

3. Окисление.

Алкены -ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации.
Физические свойства.
Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
При нормальных условиях алкены с C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
|
|
Химические свойства
1 Гидрирование.

2. Галогенирование.

3. Гидратация.

4. Алкилтрование.

Гидрогалогенирование, гидратация и сульфирование протекают по правилу Марковникова, по которому в реакциях присоединения полярных молекул (галогенводородов, воды, серной кислоты и др.) к несимметричным алкенам атом водорода присоединяется к наиболее гидрогенизированному атому углерода двойной связи:


|
|
|

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Адаптации растений и животных к жизни в горах: Большое значение для жизни организмов в горах имеют степень расчленения, крутизна и экспозиционные различия склонов...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!