классы неорг. соед: оксиды, гидрооксиды(основания), кислоты, соли.
Структурная формула — это разновидность химической формулы, графически описывающая расположение и порядок связи атомов в соединении, выраженное на плоскости. Связи в структурных формулах обозначаются валентными черточками.
Химическая формула-это условная запись состава вещества посредством химических знаков и индексов. Например: H2O-формула воды, где Н и О-химические знаки элементов, 2-индекс, который показывает число атомов данного элемента, входящих в состав молекулы воды.
?????
Стехиометрические законы (шесть) и их современное толкование.
1) закон сохр. масс в хим. реакции.(масса исходных веществ в хим. р-ции примерно равна общей массе продуктов р-ции.)
2) закон эквивалентов(В молекулярных соединениях массы составляющих их элементов относятся между собой как их эквиваленты.)
3) постоянство состава хим. соед. с молекулярной структурой.(Химическое соединение, имеющее молекулярное строение, независимо от метода получения характеризуется постоянным составом.)
4) закон кратных отношений Дальмона.(Если два элемента образуют между собой несколько молекулярных соединений, то масса одного элемента, приходящаяся на одну и ту же массу другого, относятся между собой как небольшие целые числа.)
5) закон объёмных кратных отношений (При равных условиях объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов, как небольшие целые числа.)
6) закон авагадро (В равных объемах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул.)
Химический эквивалент элемента, оксида, гидроксида и соли. Молярная масса эквивалента, молярный объём эквивалента газа. Общая и частные формулы закона эквивалентов.
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества
Эсоли=1/|Zkat||Zan|
Эгидроксид=1/n(ОН)
Эоксида=1/|ст.ок.||кол. ат. элемента|
Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности:
эквивалентный объем газа, представляет собой отношение объема порции данного газа к эквивалентному количеству вещества в этой порции
Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей, например:
М Э(оксида) = М Э(элемента) + М Э(О) = М Э(элемента) + 8
М Э(кислоты) = М Э(Н) + М Э(кислотного остатка) = 1 + М Э(кислотного остатка)
М Э(основания) = М Э(Ме) + М Э(ОН) = М Э(Ме) + 17
М Э(соли) = М Э(Ме) + М Э(кислотного остатка).
Для любых двух веществ, связанных законом эквивалентов, можно записать:
Строение атома. Ядро и электроны, протоны и нейтроны, их заряд и масса. Квантовый характер излучения и поглощения энергии. Уравнение Планка. Представление об атомных спектрах.
При химических реакциях ядра атомов остаются без изменений, изменяется лишь строение электронных оболочек вследствие перераспределения электронов между атомами. Способностью атомов отдавать или присоединять электроны определяются его химические свойства. Заряд ядра равен Ze, где e – заряд протона, Z– зарядовое число, равное порядковому номеру химического элемента Масса ядра измеряется в атомных единицах массы (а.е.м). За одну атомную единицу массы принимается 1/12 часть массы нейтрального атома углерода 12 С
Электрон имеет двойственную (корпускулярно-волновую) природу. Благодаря волновым свойствам электроны в атоме могут иметь только строго определенные значения энергии, которые зависят от расстояния до ядра. Электроны, обладающие близкими значениями энергии образуют энергетический уровень. Он содержит строго определенное число электронов - максимально 2n2. Энергетические уровни подразделяются на s-, p-, d- и f- подуровни; их число равно номеру уровня. 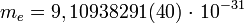 кг [1] — масса электрона.
кг [1] — масса электрона. 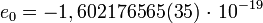 Кл [1] — заряд электрона.Нейтрон — элементарная частица, не имеющая электрического заряда. Нейтрон является фермионом и принадлежит к классу барионов. Атомные ядра состоят из нейтронов и протонов. Нейтрон (n) – нейтральная частица с массой покоя mn = 1,675·10–27кг = 1839 me, нулевой заряд.
Кл [1] — заряд электрона.Нейтрон — элементарная частица, не имеющая электрического заряда. Нейтрон является фермионом и принадлежит к классу барионов. Атомные ядра состоят из нейтронов и протонов. Нейтрон (n) – нейтральная частица с массой покоя mn = 1,675·10–27кг = 1839 me, нулевой заряд.
Протоны (вместе с нейтронами) являются основными составляющими атомных ядер. Порядковый номер химического элемента в периодической таблице (и, соответственно, все его химические свойства) полностью определяются зарядом ядра его атомов, который, в свою очередь, равен количеству протонов в ядре (протонному числу). Протон имеет положительный заряд е+=1,06·10–19 Кл и массу покоя mp = 1,673·10–27кг = 1836 me
Квантовый характер излучения и поглощения энергии электромагнитного поля был постулирован М. Планком в 1900 году для объяснения свойств теплового излучения
уравнение Планка: E=hv (h-постоянная планка =6,62 на 10 в минус 34
АТОМНЫЕ СПЕКТРЫ - оптические спектры свободных или слабо связанных атомов (одноатомных газов, паров). Обусловлены квантовыми переходами атома. Атомные спектры - линейчатые, состоят из отдельных спектральных линий, которые характеризуются определенной длиной волны и для простых атомов группируются в спектральные серии. Содержат информацию о строении атомов, используются также в спектральном анализе.



 или
или 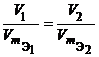 или
или 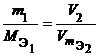 ,
,
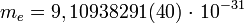 кг [1] — масса электрона.
кг [1] — масса электрона. 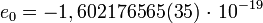 Кл [1] — заряд электрона.Нейтрон — элементарная частица, не имеющая электрического заряда. Нейтрон является фермионом и принадлежит к классу барионов. Атомные ядра состоят из нейтронов и протонов. Нейтрон (n) – нейтральная частица с массой покоя mn = 1,675·10–27кг = 1839 me, нулевой заряд.
Кл [1] — заряд электрона.Нейтрон — элементарная частица, не имеющая электрического заряда. Нейтрон является фермионом и принадлежит к классу барионов. Атомные ядра состоят из нейтронов и протонов. Нейтрон (n) – нейтральная частица с массой покоя mn = 1,675·10–27кг = 1839 me, нулевой заряд.


