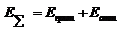Эквивалент – реальная или условная частица вещества, которая может замещать, присоединять или быть каким-либо другим способом эквивалентна одному иону водорода в ионнообменных реакциях или одному электрону в ОВР.
Пример. 
Эквивалентная масса элемента - это масса 1 эквивалента элемента.
Эквивалентная масса вещества - это масса 1 эквивалента вещества.
Другими словами, эквивалентная масса кислоты равна ее молярной массе, деленной на основность кислоты.
Пример. 
Закон химических эквивалентов. Массы реаг.вещ-в пропорциональны их экв.массам.
18.Полярность связи. Полярность молекул и дипольный момент. Предположим, что мы имеем соединение АB. Оба элемента с большими знач-миэлектроотрицательности ( ).=> общая электронная пара в молекуле смещена от атомаB к атомуА.Электронейтральностьнарушается,в мол-лепоявл-сяполож-ный(B) и отриц.(A) полюса. Такая сист.наз-ся диполь–полярная молекула (сист.из 2-х разноименных,одинак.по величине зарядов, нах-ся на малом расстоянии). Ков.св.– полярная. Осн.харак-ка диполя– дипольный момент.
).=> общая электронная пара в молекуле смещена от атомаB к атомуА.Электронейтральностьнарушается,в мол-лепоявл-сяполож-ный(B) и отриц.(A) полюса. Такая сист.наз-ся диполь–полярная молекула (сист.из 2-х разноименных,одинак.по величине зарядов, нах-ся на малом расстоянии). Ков.св.– полярная. Осн.харак-ка диполя– дипольный момент. 
 -напряж.поля,созд.диполем.
-напряж.поля,созд.диполем.
l–плечодиполя.Примеры полярных молекул-диполей:  и др.Чем больше плечо, тем полярнее молекула.
и др.Чем больше плечо, тем полярнее молекула.  можно представить как произведение некоторой величины D (единицы Дебая) на
можно представить как произведение некоторой величины D (единицы Дебая) на  Для ионных соед.D=4-11 единиц, для полярных D=0-4 единиц. Полярность св. – вектор, напр-ный от отриц-го полюса к полож-му, происходит взаимное уничтожение векторов.
Для ионных соед.D=4-11 единиц, для полярных D=0-4 единиц. Полярность св. – вектор, напр-ный от отриц-го полюса к полож-му, происходит взаимное уничтожение векторов.
Основные стехиометрические законы.
1. З.постоянства состава: в-во имеет постоянный состав независимо от способа его получения.
Пример. 2H2+O2=2H2O и 4NH3+3O2=6H2O+2N.
2. З.эквивалентов: в-ва вступают в хим. взаимодействие и замещают друг друга в соед.в весовых количествах пропорциональным хим. эквивалентам этих веществ. Хим.эквивалент - такое весовое кол-во в-ва, которое реагирует с 1.008 весовых частей H2 или 8 в.ч. О2.
3. З. простых кратных отношений: если два элемента образуют несколько соединений, то на одно и тоже весовое кол-во одного элемента приходится такие весовые кол-ва другого элемента, которые относятся между собой, как простые целые числа. Пример: H20/H2O2,CO/CO2, N2O/NO/N2O3/NO2/N2O4/N2O5.
4. З. сохранения массы и энергии: в изолированной сист. сумма m-c и E-й постоянна.
5. З. Авогадро: в равных объемах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул.
В одном моле содержится 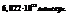
Основные газовые законы. Определение молекулярных масс газообразных веществ.
К осн. газовому з. относится уравнение состояния газа (уравнение Менделеева-Клапейрона): 
Газ, который подчиняется этому закону, называется идеальным.
Закон Авогадро.
В равных V-ах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул.
Следствие1: одинаковое число молекул различных газов при одинаковых усл-х занимают одинаковый объем
В одном моле содержится 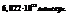 При норм.усл. моль газа занимает 22,4 л.Универсальный газовый з.
При норм.усл. моль газа занимает 22,4 л.Универсальный газовый з. 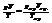
Для опр.отн.молекулярной массы в-ва обычно находят численно =ую ей мольную массу в-ва.
Единица молекулярной массы - 1/12 часть массы молекулы углерода, условно принятой равной 12.
Масса газообразных веществ опр.поз.Авогадро и уравнению Менделеева-Клапейрона.
20.Межмолекулярное взаимодействие. Водородная связь.Водородная связь наблюдается при взаимодействии атома водорода с атомами сильно электроотрицательных элементов–F,O,N,Cl,S.Природа этой связи до конца не изучена: проявление сил межмолекулярного взаимодействия, но характер сил – электростатический.В случае возникновения водородной связи водород ведет себя как двухвалентный элемент.Наличие водородных связей объясняет так называемые аномальные свойства воды:1. макс. плотность при температуре +4.
2. вода обладает наибольшей теплоемкостью из известных жидкостей.
При нагреве воды значительная часть энергии затрачивается на разрыв связей, отсюда и повышенная теплоемкость.Между молекулами в газах, жидкостях и твердых телах действуют одновременно силы отталкивания и притяжения.Проявление сил отталкивания – результат взаимодействия заполненных электронных оболочек, эти силы действуют на очень малых расстояниях и быстро убывают с увеличением расстояния. 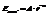 A и n (12) – эмпирические константы, r – расстояние между частицами.Теоретически лучше изложены силы притяжения. Различают ориентационное, индукционное и дисперсионное взаимодействия. Ориентационное. Имеет место между молекулами – ярко выраженными диполями.
A и n (12) – эмпирические константы, r – расстояние между частицами.Теоретически лучше изложены силы притяжения. Различают ориентационное, индукционное и дисперсионное взаимодействия. Ориентационное. Имеет место между молекулами – ярко выраженными диполями. 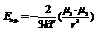 k – константа Больцмана, «ню» - дипольные моменты молекул. Индукционное. Если одна из молекул полярна, вторая – неполярна, но легко поляризуема.
k – константа Больцмана, «ню» - дипольные моменты молекул. Индукционное. Если одна из молекул полярна, вторая – неполярна, но легко поляризуема. 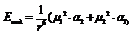 «альфа» - коэффициент поляризации. Дисперсионное. Возникновение мгновенных диполей.
«альфа» - коэффициент поляризации. Дисперсионное. Возникновение мгновенных диполей. 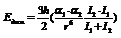 I – потенциал ионизации, h – постоянная Планка.В общем силы притяжения могут быть представлены как
I – потенциал ионизации, h – постоянная Планка.В общем силы притяжения могут быть представлены как 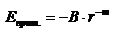 B и m (6) – константы.Суммарная энергия
B и m (6) – константы.Суммарная энергия 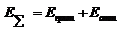





 ).=> общая электронная пара в молекуле смещена от атомаB к атомуА.Электронейтральностьнарушается,в мол-лепоявл-сяполож-ный(B) и отриц.(A) полюса. Такая сист.наз-ся диполь–полярная молекула (сист.из 2-х разноименных,одинак.по величине зарядов, нах-ся на малом расстоянии). Ков.св.– полярная. Осн.харак-ка диполя– дипольный момент.
).=> общая электронная пара в молекуле смещена от атомаB к атомуА.Электронейтральностьнарушается,в мол-лепоявл-сяполож-ный(B) и отриц.(A) полюса. Такая сист.наз-ся диполь–полярная молекула (сист.из 2-х разноименных,одинак.по величине зарядов, нах-ся на малом расстоянии). Ков.св.– полярная. Осн.харак-ка диполя– дипольный момент. 
 -напряж.поля,созд.диполем.
-напряж.поля,созд.диполем. и др.Чем больше плечо, тем полярнее молекула.
и др.Чем больше плечо, тем полярнее молекула.  можно представить как произведение некоторой величины D (единицы Дебая) на
можно представить как произведение некоторой величины D (единицы Дебая) на  Для ионных соед.D=4-11 единиц, для полярных D=0-4 единиц. Полярность св. – вектор, напр-ный от отриц-го полюса к полож-му, происходит взаимное уничтожение векторов.
Для ионных соед.D=4-11 единиц, для полярных D=0-4 единиц. Полярность св. – вектор, напр-ный от отриц-го полюса к полож-му, происходит взаимное уничтожение векторов.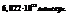

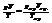
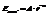 A и n (12) – эмпирические константы, r – расстояние между частицами.Теоретически лучше изложены силы притяжения. Различают ориентационное, индукционное и дисперсионное взаимодействия. Ориентационное. Имеет место между молекулами – ярко выраженными диполями.
A и n (12) – эмпирические константы, r – расстояние между частицами.Теоретически лучше изложены силы притяжения. Различают ориентационное, индукционное и дисперсионное взаимодействия. Ориентационное. Имеет место между молекулами – ярко выраженными диполями. 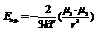 k – константа Больцмана, «ню» - дипольные моменты молекул. Индукционное. Если одна из молекул полярна, вторая – неполярна, но легко поляризуема.
k – константа Больцмана, «ню» - дипольные моменты молекул. Индукционное. Если одна из молекул полярна, вторая – неполярна, но легко поляризуема. 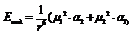 «альфа» - коэффициент поляризации. Дисперсионное. Возникновение мгновенных диполей.
«альфа» - коэффициент поляризации. Дисперсионное. Возникновение мгновенных диполей. 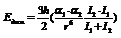 I – потенциал ионизации, h – постоянная Планка.В общем силы притяжения могут быть представлены как
I – потенциал ионизации, h – постоянная Планка.В общем силы притяжения могут быть представлены как 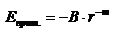 B и m (6) – константы.Суммарная энергия
B и m (6) – константы.Суммарная энергия