

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
Топ:
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Интересное:
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Термодинамическая константа равновесия может быть выражена как через активности веществ, участвующих в реакции, Ka, так и через фугитивности Kf:

 ,
,
Термодинамические константы равновесия являются безразмерными величинами.
Константа равновесия  может быть рассчитана по частному уравнению изотермы химической реакции:
может быть рассчитана по частному уравнению изотермы химической реакции:
 , ,
| (1.36) |
если известно значение изменения стандартной энергии Гиббса при данной температуре. Тогда термодинамическая константа равновесия  рассчитывается как экспонента:
рассчитывается как экспонента:
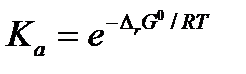 , ,
|
Термодинамическая константа равновесия зависит от природы реагирующих веществ и температуры, но не зависит от давления, поскольку изменение стандартной энергии Гиббса не зависит от давления по определению.
Величина константы равновесия может принимать значения от нуля до бесконечности: 
Пример: Рассчитаем термодинамическую константу равновесия реакции синтеза метанола при температурах 298 и 1000 К и давлении 101,325 кПа.
Решение: Рассчитаем изменение стандартной энергии Гиббса при температуре 298К, используя рассчитанные в предыдущих примерах значения  и
и  :
:
 = – 90,47∙103 – 298∙(– 218,83) = – 25258,66 Дж
= – 90,47∙103 – 298∙(– 218,83) = – 25258,66 Дж
По частному уравнению изотермы химической реакции

Для расчета константы равновесия при 1000 К воспользуемся рассчитанным в предыдущем примере значением стандартной энергии Гиббса при температуре 1000 К для реакции синтеза метанола  .
.
По частному уравнению изотермы химической реакции

Если химическая реакция протекает при давлениях меньше ≤ 50 атм, то константа равновесия, выраженная через приведенные давления  , равна термодинамической константе равновесия Ka и является безразмерной величиной.
, равна термодинамической константе равновесия Ka и является безразмерной величиной.
|
|
Практические константы равновесия
Химическое равновесие могут характеризовать практические константы равновесия. Практические константы равновесия могут быть рассчитаны, если при равновесии определить количества или концентрации веществ, участвующих в реакции тем или иным методом химического или физико-химического анализа. Они могут быть выражены
– через числа молей веществ ni,j в равновесии:
 ; ;
| (1.37) |
– через молярные концентрации веществ сi,j в равновесии:
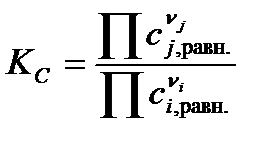 ; ;
| (1.38) |
– через мольные доли веществ xi,j в равновесии:
 ; ;
| (1.39) |
– через парциальные давления веществ pi,j в равновесии:
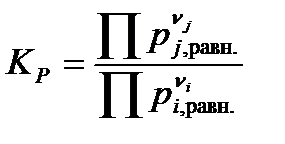
| (1.40) |
Практические константы равновесия являются размерными величинами.
Удобно использовать и безразмерные константы равновесия, например, константу, выраженную через приведенные давления 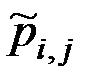 :
:
 , ,
| (1.41) |
где  , а p 0 – стандартное давление.
, а p 0 – стандартное давление.
Между практическими константами равновесия существует определенная математическая связь. Например, легко показать, что константа  связана с практической константой равновесия, выраженной через моли Kn,следующим соотношением
связана с практической константой равновесия, выраженной через моли Kn,следующим соотношением

| (1.42) |
|
|
|

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!