В первую очередь скорость газовой коррозии определяется свойствами оксидной пленки. Она препятствует окислению металла, если полностью, без разрывов, покрывает поверхность металла. Защитные свойства будут тем лучше, чем меньше коэффициент диффузии через нее реагирующих частиц. При этом пленка должна сохраняться на поверхности металла при механических воздействиях и при циклическом изменении температур. Следовательно, она должна обладать хорошими адгезионными свойствами (сцеплением с поверхностью металла), механической прочностью, иметь близкое с металлом значение величины температурного коэффициента линейного расширения.
Защитные свойства оксидных пленок в значительной степени зависят от природы металла и наличия в нем легирующих добавок. В случае сплавов на основе железа такие добавки, как хром, алюминий, кремний, углерод, сильно замедляют коррозию вследствие образования на поверхности металла соответствующих оксидов. И наоборот, элементы, образующие летучие или легкоплавкие оксиды, например ванадий и молибден, могут ускорять высокотемпературную газовую коррозию стали. Устойчивость меди к газовой коррозии увеличивают олово, цинк, алюминий и бериллий.
Скорость газовой коррозии возрастает с ростом температуры вследствие увеличения константы скорости химической реакции и увеличения коэффициента диффузии. В обоих случаях это увеличение пропорционально ~  , где Е ак – энергия активации процесса химической коррозии,поэтому зависимость скорости коррозии от температуры близка к экспоненциальной.
, где Е ак – энергия активации процесса химической коррозии,поэтому зависимость скорости коррозии от температуры близка к экспоненциальной.
При увеличении температуры может изменяться кинетический закон роста оксидной пленки. Например, если при относительно низких температурах процесс окисления лимитируется скоростью химической реакции – линейный закон роста оксидной пленки, то при увеличении температуры медленной стадией становится диффузия, а закон роста – параболическим. Это связано с тем, что при увеличении температуры скорость химической реакции возрастает быстрее, чем скорость диффузии (энергия активации химической реакции много больше энергии активации диффузии).
Циклический нагрев и охлаждение металла (колебание температур) увеличивают скорость коррозии. Это связано с тем, что защитные свойства оксидной пленки снижаются вследствие возникновения термических напряжений, приводящих к образованию в ней трещин и отслаиванию ее от металла.
Скорость газовой коррозии увеличивается с ростом парциального давления кислорода, поскольку при этом возрастают и скорость химической реакции и диффузия. Соответственно снижение концентрации кислорода уменьшает скорость окисления металла. Для предотвращения высокотемпературной коррозии используют защитные среды, например, эксплуатируют металлические изделия в инертных газах или вакууме.
Наличие в воздухе примесей таких как, например, диоксид серы (SO2), диоксид углерода (СО2), пары воды приводит к значительному увеличению скорости коррозии. Это связано с различием в химическом составе продуктов коррозии и, соответственно, защитных свойств образующихся на металле пленок.
Все разнообразные методы, используемые при защите металлов от газовой коррозии, условно можно разделить на три группы: нанесение высокотемпературных защитных покрытий, легирование, применение защитных сред.
Электрохимическая коррозия
Электрохимическая коррозия металлов – коррозия, протекающая по электрохимическому механизму, – происходит в тех случаях, когда окружающая среда является электролитом. Обычно это водные растворы солей, кислот и щелочей, пленка воды с растворенными в ней газами, влага почвы и т.д. В этом случае коррозию можно представить как результат работы короткозамкнутого гальванического элемента (рис.9.5).
Любые неоднородности поверхности металла или контактирующего с ним электролита (локальные различая концентрации растворенных веществ) приводят к образованию участков с различным значением электродных потенциалов. Вследствие электропроводности металла образуется система короткозамкнутых гальванических элементов. На участках с меньшим значением электродного потенциала (анод) происходит окисление поверхностных атомов металла:
анод (-): Ме0 ® Ме n + + nē
На участках с большим значением электродного потенциала (катод) происходит восстановление компонентов окружающей среды:
катод (+): Ox + nē ® Red
Рис. 9‑5 Схема коррозионной электрохимической системы: 1 - окисление поверхностных атомов металла; 2 – переход электронов с анодного на катодный участок; 3 – восстановление ионов или молекул среды
Отличительной особенностью коррозионного гальванического элемента является отсутствие внешней цепи. Электроны не выходят из корродирующего металла, а двигаются внутри него (рис.9.5). При этом энергия электрохимической реакции переходит только в теплоту, которая рассеивается в окружающей среде.
Анодная и катодная реакции равновероятно могут протекать в любой точке однородной поверхности металла. В этом случае коррозия называется гомогенно-электрохимической. Обычно на границе раздела «металл – электролит» существуют неоднородности поверхности металла или электролита. Это приводит к возникновению участков, на которых энергетически выгодно протекание либо анодного, либо катодного процессов. В этом случае коррозия называется гетерогенно-электрохимической.
Неоднородность системы «металл – электролит» и, как следствие, возникновение коррозионных гальванических элементов могут быть вызваны следующими причинами:
- неоднородностью металла по химическому или фазовому составу (если, например, изделие состоит из деталей, изготовленных из разнородных металлов);
- наличием на поверхности окисных пленок;
- различием концентраций растворенных в электролите веществ на отдельных участках контакта металла с электролитом;
- неодинаковой температурой различных участков металла;
- механическими напряжениями в металлической детали.
Обычно анодные и катодные участки поверхности металла имеют малые размеры. При контакте металла с электролитом возникает большое число коррозионных микроэлементов, работа которых и приводит к электрохимической коррозии.
Короткозамкнутый гальванический элемент является полностью поляризованной электрохимической системой. В результате поляризации (катода – hк и анода – hа) потенциалы анодных и катодных участков выравниваются и приобретают значение jкорр, которое называется стационарным потенциалом коррозии, которому соответствует максимальная плотность коррозионного тока i корр(рис.9.6). При этом коррозионная реакция протекает с максимальной скоростью.
Рис. 9‑6 Поляризационные кривые коррозионного гальванического элемента
Анодные и катодные реакции
При электрохимической коррозии протекают две сопряженные реакции: окисление металла и восстановление компонентов среды.
Анодная реакция, как правило, представляет собою окисление поверхностных атомов металла с образованием катионов, которые выходят в электролит и могут реагировать с его компонентами:
Ме0 ® Ме+ n + nē
Катодная реакция –восстановление компонентов электролита. Поскольку коррозионная система полностью поляризована, то протекающие катодные реакции называют реакциями деполяризации катода.
В водных растворах обычно протекают реакции с водородной (а)или кислородной (б) деполяризацией катода:
а) 2H+ + 2 ē ® H2 pH <7, б) О2 + 4H+ + 4 ē ® 2H2 pH <7,
2H2O + 2 ē ® H2 + 2OH- pH ³7 О2 + 2H2O + 4 ē ® 4OH- pH ³7.
Возможность протекания реакции определяется как водородным показателем среды (pH), так и наличием растворенного кислорода. Реакции с кислородной деполяризацией катода обычно протекают в тонкой пленке воды на поверхности металла, например, в условиях атмосферной коррозии.
Окисление атомов металла с выходом катионов в электролит и восстановление ионов или молекул среды на поверхности металла являются первичными процессами коррозии. Образовавшиеся при этом ионы Me n +, OH- и растворенные в электролите вещества могут вступать в химические реакции, представляющие собой вторичные процессы. Обычно вторичные процессы приводят к образованию труднорастворимых продуктов коррозии, чаще всего гидроксидов, основных и средних солей. Например:
Ni2+ + 2OH- ® Ni(OH)2¯
Ni2+ + S2- ® NiS¯
2Cu2+ + СО2 + 4OH- ® (CuOH)2СО3¯ + H2O
4Fe(OH)2¯+ O2 + 2H2O ® 4Fe(OH)3¯
Рассмотрим некоторые случаи электрохимической коррозии металлов.
Коррозия гетерогенных сплавов. Гетерогенный сплав – поликристалл металла, состоящий из монокристаллов, обладающих различными физико-химическими свойствами, то есть состоит из нескольких фаз. При их контакте с электролитом образуется совокупность микрогальванических коррозионных элементов.
Пример. Коррозия стального изделия в растворе соляной кислоты. Сталь – гетерогенный сплав, содержащий в своем составе микрокристаллы железа (Fe) и карбида железа (Fe3C) (рис.9.7).
Рис. 9‑7 Коррозия стали в кислоте
Поскольку электродный потенциал карбида железа больше, чем потенциал железа, то в коррозионном гальваническом элементе Fe½H+½Fe3C катодом будет карбид железа, а анодом железо. Учитывая, что  <
<  (см. таблицу электродных потенциалов) железо будет окисляться до Fe2+, а на поверхности карбида железа протекать реакция с водородной деполяризацией катода:
(см. таблицу электродных потенциалов) железо будет окисляться до Fe2+, а на поверхности карбида железа протекать реакция с водородной деполяризацией катода:
анод (Fe): Fe0 ® Fe2+ + 2 ē
катод (Fe3C): 2H+ + 2 ē ® H2
Вторичные реакции протекать не будут, поскольку нерастворимых соединений не образуется. В этом случае говорят об электрохимическом растворении стали:
Fe0 + 2H+ ® Fe2+ + H2.
Коррозия металла при неравномерной аэрации электролита. При условии неодинакового доступа кислорода к различным участкам коррозионной системы возникает концентрационный коррозионный элемент.
Пример. Коррозия меди под каплей воды на воздухе. Электродный потенциал металла будет больше на тех участках, которые контактируют с электролитом с большей концентрацией растворенного в нем кислорода. В случае капли воды концентрация кислорода будет больше на краях ( ) и меньше в центре (
) и меньше в центре (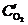 ). Поэтому под каплей центральная часть смоченной поверхности металла будет анодом, а участок поверхности в виде кольца по краям капли – катодом (рис.9.8).
). Поэтому под каплей центральная часть смоченной поверхности металла будет анодом, а участок поверхности в виде кольца по краям капли – катодом (рис.9.8).

Рис. 9‑8 Коррозия меди под каплей воды
Медь на анодном участке будет окисляться, а на катодном участке протекать реакция с кислородной деполяризацией:
анод (Cu( )): Cu0 ® Cu2+ + 2 ē
)): Cu0 ® Cu2+ + 2 ē
катод (Cu( )): О2 + 2H2O + 4 ē ® 4OH-
)): О2 + 2H2O + 4 ē ® 4OH-
Вторичной реакцией будет реакция образования нерастворимого дигидроксида меди:
Cu2+ +2OH- ® Cu(OH)2¯
Примечание. В воздухе присутствует углекислый газ, который вместе с кислородом растворен в воде. Поэтому в продуктах коррозии будет присутствовать основной карбонат меди:
2 Cu 2+ + СО2 + 4OH- ®(CuOH)2СО3¯ + H2O
Коррозия металла в напряженном состоянии. Под действием механических напряжений в металле, контактирующем с электролитом, изменяется электродный потенциал. Потенциал растянутого слоя металла уменьшается, а сжатого увеличивается. Это приводит к образованию коррозионного гальванического элемента, в котором растянутые слои металла будут анодом, а сжатые – катодом.
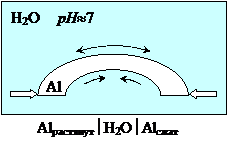
Пример. Коррозия находящейся в воде детали из дюралюмина (сплав на основе алюминия) в напряженном состоянии (рис.9.9).
Внешние слои дюралюмина в упругодеформированной пластине растянуты и при возникновении коррозионного гальванического элемента будут анодом, внутренние слои сжаты и являются катодом:
анод (Alрастянут): Al0 ® Al3+ + 3 ē
катод (Alсжат): 2H2O + 2 ē ® H2 + 2OH-
Вторичной реакцией будет реакция образования нерастворимого тригидроксида алюминия:
 Al3+ +3OH- ® Al(OH)3¯
Al3+ +3OH- ® Al(OH)3¯
Рис. 9‑9 Коррозия детали в напряженном состоянии
Контактная коррозия металлов. Если два соприкасающихся разнородных металла контактируют с электролитом, то образуется макрогальванический коррозионный элемент.
Пример. Атмосферная коррозия оцинкованного железа при нарушении покрытия.
Стандартные электродные потенциалы металлов равны: 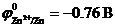 ;
;  . Следовательно, в коррозионном гальваническом элементе Zn½H2O+O2½Fe анодом будет цинк, а катодом – железо (рис.9.10). При коррозии цинк окисляется, а на поверхности железа протекает реакция кислородной деполяризации катода:
. Следовательно, в коррозионном гальваническом элементе Zn½H2O+O2½Fe анодом будет цинк, а катодом – железо (рис.9.10). При коррозии цинк окисляется, а на поверхности железа протекает реакция кислородной деполяризации катода:
анод (Zn): Zn0 ® Zn2+ + 2 ē
катод (Fe): О2 + 2H2O + 4 ē ® 4OH-.
Основной вторичной реакцией является образование нерастворимого дигидроксида цинка:
Zn2+ +2OH- ® Zn(OH)2¯
Рис. 9‑10 Коррозия оцинкованного железа при нарушении покрытия



 , где Е ак – энергия активации процесса химической коррозии,поэтому зависимость скорости коррозии от температуры близка к экспоненциальной.
, где Е ак – энергия активации процесса химической коррозии,поэтому зависимость скорости коррозии от температуры близка к экспоненциальной.


 <
<  (см. таблицу электродных потенциалов) железо будет окисляться до Fe2+, а на поверхности карбида железа протекать реакция с водородной деполяризацией катода:
(см. таблицу электродных потенциалов) железо будет окисляться до Fe2+, а на поверхности карбида железа протекать реакция с водородной деполяризацией катода: ) и меньше в центре (
) и меньше в центре (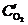 ). Поэтому под каплей центральная часть смоченной поверхности металла будет анодом, а участок поверхности в виде кольца по краям капли – катодом (рис.9.8).
). Поэтому под каплей центральная часть смоченной поверхности металла будет анодом, а участок поверхности в виде кольца по краям капли – катодом (рис.9.8).
 )): Cu0 ® Cu2+ + 2 ē
)): Cu0 ® Cu2+ + 2 ē )): О2 + 2H2O + 4 ē ® 4OH-
)): О2 + 2H2O + 4 ē ® 4OH- Al3+ +3OH- ® Al(OH)3¯
Al3+ +3OH- ® Al(OH)3¯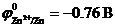 ;
;  . Следовательно, в коррозионном гальваническом элементе Zn½H2O+O2½Fe анодом будет цинк, а катодом – железо (рис.9.10). При коррозии цинк окисляется, а на поверхности железа протекает реакция кислородной деполяризации катода:
. Следовательно, в коррозионном гальваническом элементе Zn½H2O+O2½Fe анодом будет цинк, а катодом – железо (рис.9.10). При коррозии цинк окисляется, а на поверхности железа протекает реакция кислородной деполяризации катода:



