КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
1.1. Оксиды (ЭхОу).
1.2. Гидроксиды: кислоты (Н-кислотный остаток) и основания (Ме-ОН).
1.3. Соли (Ме-кислотный остаток).
Оксиды
Оксиды - сложные вещества, состоящие из кислорода и какого-либо химического элемента. Степень окисления кислорода в оксидах: -2.
|
Оксиды (ЭxОy)
|
| Солеобразующие
| Несолеобразующие
|
|
Кислотные
|
Амфотерные
|
Основные
| СО, NO, N2O, NO2
(не образуют солей)
|
| | | | |
Кислотные оксиды - это
· Оксиды неметаллов, которым соответствуют кислоты (например: CO2(H2CO3), Cl2O7 (HClO4), SO3(H2SO4) и др.);
· Оксиды металлов в высокой положительной степени
окисления (+5,+6,+7): FeO3, CrO3, Mn2O7 и др.
Химические свойства кислотных оксидов
1. Кислотные оксиды взаимодействуют с водой, образуя кислоты. Исключение составляет SiO2, Bi2O5.
SO3 + H2O = H2SO4;
Mn2O7 + H2O = 2HMnO4;
SiO2 + H2O ¹ не взаимодействует.
2. Взаимодействуют с основными оксидами, образуя соль:
N2O5 + MgO = Mg(NO3)2.
3. Взаимодействуют с основаниями, образуя соль и воду:
SO3 + Ca(OH)2 = CaSO4 + H2O.
Основные оксиды - это оксиды металлов в низкой степени окисления, которым соответствуют основания (Na2O, MgO, MnO,...).
Химические свойства основных оксидов
1. С водой взаимодействуют только оксиды щелочных (Li, Na, K, Rb, Cs) и щелочноземельных (Ca, Sr, Ba) металлов, образуя основания (щелочи). Оксиды других металлов в воде не растворяются.
BaO + H2O = Ba(OH)2.
2. Основные оксиды взаимодействуют с кислотными оксидами, образуя соли
CaO + CO2 = CaCO3.
3. Взаимодействуют с кислотами, образуя соль и воду
СuO + 2HCl = CuCl2 + Н2О.
Амфотерные оксиды - это такие оксиды, которые могут проявлять и кислотные, и основные свойства, к ним относятся
· ZnO, Al2O3,BeO, SnO, PbО
· оксиды металлов в промежуточной степени окисления (+3,+4): Cr2O3, Fe2O3 и т.д.
Химические свойства амфотерных оксидов
1. Амфотерные оксиды взаимодействуют с основаниями и основными оксидами
ZnO + 2NaOH = Na2ZnO2 + H2O;
кислотный основание
оксид
ZnO + K2O = K2ZnO2.
кислотный основной
оксид оксид
2. Взаимодействуют с кислотами и кислотными оксидами
ZnO + H2SO4 = ZnSO4 + H2O;
основной кислота
оксид
ZnO + SO3 = ZnSO4.
основной кислотный
оксид оксид
Если элемент может образовывать несколько оксидов (гидроксидов), то с увеличением степени окисления элемента кислотные свойства его оксидов (гидроксидов) усиливаются:
+2 +3 +6
CrO Cr2O3 CrO3
основной амфотерный кислотный
оксид оксид оксид
Усиление кислотных свойств
Гидроксиды
1.2.1. Кислоты - это сложные химические соединения, состоящие из катионов водорода и анионов кислотных остатков.
Таблица 1. Названия часто встречающихся кислот и их солей
|
Кислота
|
Соль
|
| Формула
| Название
| Кислотный остаток
| Название
|
| HF
| Фтороводородная (плавиковая)
| F-
| Фторид
|
| HCl
| Хлороводородная (соляная)
| Cl-
| Хлорид
|
| HBr
| Бромоводородная
| Br-
| Бромид
|
| HI
| Иодоводородная
| I-
| Иодид
|
| HCN
| Циановодородная (синильная)
| CN-
| Цианид
|
| H2S
| Сероводородная
| S2-
| Сульфид
|
| H2SO3
H2SO4
| Сернистая
Серная
| SO32-
SO42-
| Сульфит Сульфат
|
| H2S2O3
| Тиосерная
| S2O32-
| Тиосульфат
|
| HNO3
| Азотная
| NO3-
| Нитрат
|
| HNO2
| Азотистая
| NO2-
| Нитрит
|
| H2CO3
| Угольная
| CO32-
| Карбонат
|
| H2SiO3
| Кремниевая
| SiO32-
| Силикат
|
| H2CrO4
H2Cr2O7
| Хромовая
Двухромовая
| CrO42-
Cr2O72-
| Хромат
Дихромат
|
| HClO4
| Хлорная
| ClO4-
| Перхлорат
|
| HClO3
| Хлорноватая
| ClO3-
| Хлорат
|
| HClO2
| Хлористая
| ClO2-
| Хлорит
|
| HClO
| Хлорноватистая
| ClO-
| Гипохлорит
|
| H3BO3
| Борная
| BO33-
| Борат
|
| H3PO4
| Фосфорная(ортофосфорная)
| PO43-
| Фосфат
|
| HMnO4
| Марганцовая
| MnO4-
| Перманганат
|
| H2MnO4
| Марганцовистая
| MnO42-
| Манганат
|
| Кислоты
|
| С и л ь н ы е
Электролиты
| С л а б ы е и средней силы
электролиты
|
|
HCl, HBr, HI, HNO3, H2SO4, HClO4
| Все остальные
(HF, H3PO4, H2CO3 и т.д.,
а также все органические)
|
Химические свойства кислот
1. Кислоты взаимодействуют с основными и амфотерными оксидами, образуя соль и воду
2HNO3 + CuO = Cu(NO3)2 + H2O.
2. C основаниями, образуя соль и воду – это реакция нейтрализации
H2SO3 + 2LiOH = Li2SO3 + 2H2O.
3. Кислоты реагируют с солями, если в результате реакции образуется
- более слабая кислота: 3H2SO4 + 2K3PO4 = 2H3PO4 + 3K2SO4;
сильная слабая
кислота кислота
- осадок: HCl + AgNO3 = AgCl ¯+ HNO3;
осадок
- газ: H2SO4 + Li2S = Li2SO4 + H2S.
газ
4. Кислоты реагируют с металлами, которые стоят в ряду напряжений левее водорода, образуя соль и водород, исключая H2SO4 конц. и HNO3 .
Fe + 2HCl = FeCl2 + H2.
5. Действие кислоты на индикатор:
H+ + метилоранж ® красно-розовый цвет;
H+ + лакмус ® красный цвет.
6. Разложение некоторых кислот при нагревании:
t
H2SiO3 = SiO2 + H2O
1.2.2. Основания - это сложные химические соединения, состоящие из катионов металла (или аммония NH4+) и гидроксид-анионов (OH-). Гидроксиды щелочных и щелочноземельных металлов называют щелочами, они хорошо растворимы в воде. Остальные основания в воде практически не растворимы (исключая NH4OH).
|
Основания
|
| С и л ь н ы е
электролиты
| С л а б ы е
электролиты
|
| Все щелочи:(образованы металлами IA и IIA подгрупп, кроме Be и Mg)
LiOH, NaOH, KOH, RbOH, CsOH
Ca(OH)2, Sr(OH)2, Ba(OH)2
| Все остальные основания: NH4OH,
Cu(OH)2, Al(OH)3,...
|
Химические свойства оснований
1. Основания взаимодействуют с кислотами, образуя соль и воду:
Cr(OH)2 + 2HCl = CrCl2 + 2H2O.
2. C кислотными оксидами, образуя соль и воду:
Ba(OH)2 + CO2 = BaCO3 + H2O.
3. Щелочи реагируют с амфотерными оксидами и гидроксидами, образуя соль и воду:
2LiOH + Cr2O3 = 2LiCrO2 + H2O;
NaOH + Cr(OH)3 = NaCrO2 + 2H2O.
4. Щелочи взаимодействуют с растворимыми солями, если в результате образуются:
- слабое основание: 2NaOH + ZnCl2 = Zn(OH)2 + 2NaCl;
слабое
основание
- осадок: Ca(OH)2 + Na2CO3 = CaCO3¯ + 2NaOH;
осадок
- газ: Ca(OH)2 + 2NH4Cl = 2NH3 + 2H2O + CaCl2.
газ
5. Щелочи реагируют с некоторыми металлами (Zn, Al, Cr), которым соответствуют амфотерные оксиды с выделением водорода
2KOH + 2Al + 2H2O = 2KAlO2 + 3H2 или
2KOH + 2Al + 6H2O = 2K[Al(OH)4] + 3H2
6. Действие щелочи на индикатор:
OH– + фенолфталеин ® малиновый цвет;
ОН- + лакмус ® синий цвет.
ОН- + метилоранж ® желтый цвет.
7. Разложение слабых оснований при нагревании:
t
2Fe(OH)3 ® Fe2O3 + 3H2O.
1.2.3. Амфотерные гидроксиды - химические соединения, проявляющие свойства и оснований, и кислот. Амфотерные гидроксиды соответствуют амфотерным оксидам (Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2, Al(OH)3, Cr(OH)3 и др.).
Амфотерные гидроксиды записывают, как правило, в форме основания, но их можно представить и в виде кислоты:
Zn(OH)2 = H2ZnO2.
основание кислота
Химические свойства амфотерных гидроксидов
1. Амфотерные гидроксиды взаимодействуют c кислотами и кислотными оксидами:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O;
основание кислота
Zn(OH)2 + SO3 = ZnSO4 + H2O.
кислотный
оксид
2. Со щелочами и основными оксидами щелочных и щелочноземельных металлов:
Al(OH)3 + KOH = KAlO2 + 2H2O; (H3AlO3 ® HAlO2 + H2O);
кислота щелочь метаалюминат орто-форма мета-форма
H3AlO3 калия
2Al(OH)3 + K2O = 2KAlO2 + 3H2O.
основной
оксид
Соли
Соли - это сложные вещества, состоящие из ионов металла и кислотного остатка. Соли представляют собой продукты полного или частичного замещения ионов водорода ионами металла (или аммония) у кислот.
Соли
средние (нормальные) кислые основные
1.3.1. Средние соли - это продукты полного замещения катионов водорода у кислот ионами металла (или NH4+): K2CO3, CaSO4, NH4NO3.
Химические свойства средних солей
1. Соли вступают в реакцию с кислотами, щелочами и другими солями, если в результате образуются:
- осадок: Pb(NO3)2 + H2SO4 = PbSO4¯ + 2HNO3;
кислота осадок
Li2SO4 + Ba(OH)2 = BaSO4 ¯+ 2LiOH;
щелочь осадок
BaCl2 + 2AgNO3 = 2AgCl¯ + Ba(NO3)2;
соль осадок
- более слабый электролит: K2SO3 + 2HNO3 = H2SO3 + 2KNO3;
сильная слабая
кислота кислота
ZnSO4 + 2KOH = Zn(OH)2 + K2SO4;
сильное слабое
основание основание
- газ: NH4Cl + NaOH = NH3 + H2O + NaCl;
щелочь газ
Na2CO3 + 2HCl = CO2 + H2O + 2NaCl;
кислота газ
Na2CO3 + KCl ¹ не реагирует.
2. Соли взаимодействуют с металлами. Более активный металл вытесняет менее активный из раствора его соли (cм. ряд активности)
Fe + CuSO4 = FeSO4 + Cu.
более
активный Ме
3. Соли реагируют с твердыми кислотными оксидами (SiO2, P2O5), т.е. более тяжелый оксид вытесняет более летучий:
CaCO3 + SiO2 = CO2 + CaSiO3;
твердый газ
4. Соли разлагаются при нагревании на основный и кислотный оксиды: t
CaCO3 ® CaO + CO2.
1.3.2. Кислые соли - это продукты неполного замещения катионов водорода у кислот ионами металла (или аммония): Na H CO3, NH4 H S, Ca(H 2PO4)2, Na2 H PO4 и т.д. (т.е. в кислотном остатке присутствуют атомы водорода). Кислые соли могут быть образованы только многоосновными кислотами. Практически все кислые соли хорошо растворимы в воде.
Получение кислых солей и перевод их в средние
1. Кислые соли получают при взаимодействии избытка кислоты или кислотного оксида с основанием:
H2CO3 + NaOH = NaHCO3 + H2O;
кислота основание гидрокарбонат
натрия
CO2 + KOH = KHCO3.
кислотный основание
оксид
2. При взаимодействии избытка кислоты с основным оксидом:
2H2CO3 + BaO = Ba(HCO3)2 + H2O.
кислота основ. оксид
3. Переходы кислых и средних солей.
+ избыток кислоты
Средняя соль ⇄ Кислая соль
+ щелочь
(убрать избыточную кислоту)
а) Средние соли переводят в кислые, добавляя кислоту:
- одноименную: Na2CO3 + H2CO3 = 2NaHCO3;
- другую: Na2CO3 + HCl = NaHCO3 + NaCl.
б) Кислые соли переводят в средние, добавляя щелочь
NaHCO3 + NaOH = Na2CO3 + H2O.
1.3.3. Основные соли - это продукты неполного замещения гидроксо-групп (OH-) основания кислотным остатком: MgOHCl, CrOHSO4 и т.д.
Основные соли могут быть образованы только слабыми основаниями многовалентных металлов. Эти соли, как правило, труднорастворимы.
Получение основных солей и перевод их в средние
1. Основные соли получают при взаимодействии избытка основания с кислотой или кислотным оксидом
Ca(OH)2 + HCl = CaOHCl¯ + H2O;
избыток кислота гидроксо-
основания хлорид кальция
Al(OH)3 + SO3 = AlOHSO4¯ + H2O.
избыток кисл. оксид гидроксо-
основания сульфат алюминия
2. Переходы средних и основных солей
+ избыток щелочи
Средняя соль ⇄ Основная соль
+ кислота
(убрать избыточное основание)
а) Средние соли переводят в основные, добавляя щелочь
Fe2(SO4)3 + 2KOH = 2FeOHSO4 + K2SO4.
б) Основные соли переводят в средние, добавляя кислоту
(лучше одноименную)
ZnOHCl + HCl = ZnCl2 + H2O;
одноименная
кислота
2ZnOHCl + H2SO4 = ZnCl2 + ZnSO4 + 2H2O.
Домашнее задание № 1
ЭЛЕКТРОЛИТЫ
Электролиты - это вещества, распадающиеся на ионы в растворе под влиянием полярных молекул растворителя (H2O). Неэлектролиты не распадаются на ионы в растворе.
| Электролиты
| Неэлектролиты
|
| 1. Соли (Na2SO4)
2. Кислоты (HCl)
3.Основания(NaOH)
| 1. Оксиды (SO3)
2. Простые вещества (металлы, неметаллы)–(Al, O2)
3.Органические вещества, кроме кислот и солей (спирт, глюкоза, крахмал)
|
По склонности к диссоциации (распаду на ионы) электролиты условно делят на сильные и слабые. Сильные электролиты диссоциируют практически полностью (в разбавленных растворах), а слабые распадаются на ионы лишь частично.
К сильным электролитам относятся: см. табл.2.
К слабым электролитам относятся все остальные электролиты.
Таблица 2. СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ.
| Электролит
| Способ определения
| Справочные материалы
|
| Соли
| Все хорошо растворимые в воде – значок Рв таблице
| Таблица растворимости
|
| Кислоты
| H2SO4, HNO3, HClO4,
HCl, HBr, HI
| Запомнить
|
| Щелочи
| образованы металлами IA и IIA подгрупп, кроме Be и Mg
LiOH, NaOH, KOH, RbOH, CsOH
Ca(OH)2, Sr(OH)2, Ba(OH)2
| Периодическая
система химических
элементов
Д.И.Менделеева
|
Одной из основных характеристик слабого электролита является константа диссоциации – К.
Например, для одноосновной кислоты,
HA Û H + + A -,
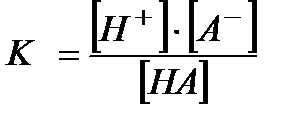 ,
,
где, [H+] – равновесная концентрация ионов H+;
[A-] – равновесная концентрация анионов кислоты А;
[HA] – равновесная концентрация молекул кислоты,
Или для слабого основания,
MеOH Û Mе + + OH -,
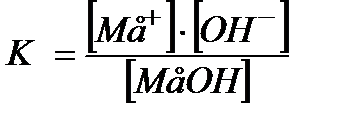 ,
,
где, [Mе+] – равновесная концентрация катионов Mе+;
[OH - ] – равновесная концентрация гидроксид- ионов ОН -;
[MеOH] – равновесная концентрация молекул слабого основания.
Правила составления уравнений диссоциации электролитов
1. а) При диссоциации сильных электролитов ставится знак “=“ (равенства). Этот знак обозначает полную диссоциацию.
б) Сильные электролиты диссоциируют нацело
2. а) При диссоциации слабых (и средней силы) электролитов -
знак “⇄“ (обратимости). Этот знак обозначает частичную диссоциацию.
б) Слабые электролиты диссоциируют по ступеням.
3. Средние соли диссоциируют нацело, кислые и средние – по ступеням.
| С и л ь н ы е электролиты
| С л а б ы е электролиты
|
| Основания:
Ba(OH)2 = Ba2+ + 2OH-.
Кислоты:
HCl = H+ + Cl-.
Соли:
· Na2CO3= 2Na+ +CO32-.
· KH2PO4= K+ + H2PO4-;
анион слабой
кислоты
H2PO4- ⇄ H+ + HPO42-;
HPO42- ⇄ H+ + PO43-.
· AlOHCl2 = AlOH2+ + 2Cl-;
растворимая катион слабого
часть основания
AlOH2+ ⇄ Al3+ + OH-.
| Основания:
Fe(OH)2 ⇄ FeOH++OH- 1 cтупень;
Растворимая
Часть
FeOH+ ⇄ Fe2+ + OH- 2 ступень.
Кислоты:
H2CO3 ⇄ H+ + HCO3- 1 ступень;
HCO3-⇄ H+ + CO32- 2 ступень.
Амфотерные гидроксиды:
1. Zn(OH)2 ⇄ OH- + ZnOH+;
основание
ZnOH+⇄ OH - + Zn2+.
2. H2ZnO2 ⇄ H+ + HZnO2-;
кислота
HZnO2- ⇄ H+ + ZnO22-.
Вода:
H2O ⇄ H+ + OH-.
|
Правила написания ионных уравнений
В ионных уравнениях на ионы расписываются:
а) сильные кислоты;
б) щелочи;
в) растворимые соли., т.е.
все сильные электролиты с учетом коэффициентов (пользуясь таблицей растворимости), все остальное (слабые электролиты и неэлектролиты) оставляют в виде молекул.
Пример 1. Написать следующие уравнения реакций в молекулярной и ионной форме: 1. CaCO3 + HCl; 2.Bi2(SO4)3 + K2S; 3. Al(OH)3 + NaOH.
1. Молекулярное уравнение: CaCO3 + 2HCl = CaCl2 + H2CO3;
полное ионное уравнение: CaCO3 + 2H+ + 2Cl- = Ca2+ + 2Cl- + H2CO3;
сокращенное ионное уравнение: СaCO3 + 2H+ = Ca2+ + H2CO3.
2. Молекулярное уравнение: Bi2(SO4)3 + 3K2S = Bi2S3¯ + 3K2SO4;
полное ионное уравнение:2Bi3++ 3SO42-+ 6K+ +3S2-=Bi2S3¯+ 6K+ + 3SO42-;
сокращенное ионное уравнение: 2Bi3+ + 3S2- = Bi2S3¯.
3. Молекулярное уравнение: Al(OH)3 + NaOH = NaAlO2 + 2H2O;
полное ионное уравнение: Al(OH)3 + Na+ + OH- = Na+ + AlO2- + 2H2O;
сокращенное ионное уравнение: Al(OH)3 + OH- = AlO2- +2H2O.
Сокращенные ионные уравнения выражают химическую сущность реакции. Однако отдельно записанные сокращенные ионные уравнения являются общими для множества подобных реакций.
Пример 2. По заданному ионному уравнению написать молекулярное:
а) Mg2+ + SO32- = MgSO3;
По левой части ионного уравнения подбираем к каждому иону противоположный по знаку ион - так, чтобы вместе они образовали молекулу сильного электролита (см. табл.2): например к иону Mg2+ подобрали ион NO3-, т.к. Mg(NO3)2 – сильный электролит; точно так же к иону SO32- подобрали ион K+ т.к. K2SO3 – сильный электролит; в итоге получаем
молекулярное уравнение: Mg(NO3)2+ K2SO3= MgSO3¯ + 2KNO3;
Проверка: Mg2+ + 2NO3- + 2K+ + SO32- = MgSO3¯ + 2K+ + 2NO3-;
Mg2+ + SO32- = MgSO3¯.
б) HSO3- + OH-= SO32- + H2O; аналогично
молекулярное уравнение:
KHSO3 + KOH = K2SO3 + H2O;
Проверка: K+ + HSO3- + K+ + OH- = 2K+ + SO32- +H2O;
HSO3- + OH- = SO32- + H2O.
в) 4OH- + Zn2+ = ZnO22- + 2H2O;
Mолекулярное уравнение:4NaOH + ZnCl2 = Na2ZnO2 + 2NaCl + 2H2O;
Проверка: 4Na+ + 4OH- + Zn2+ + 2Cl- = 2Na+ + ZnO22- + 2Na+ + 2Cl- + 2H2O;
4OH- + Zn2+ = ZnO22- + 2H2O.
Домашнее задание № 2
Тема: Электролиты
|
1. Напишите уравнения диссоциации следующих электролитов
|
| №
| Электролиты
| №
| Электролиты
|
|
| Ba(OH)2, HI, Na2HPO4
|
| MgOHNO3, HMnO4, Sn(OH)2
|
|
| CH3COOH, Ni(OH)2, KHCO3
|
| HClO4, Ca(H2PO4)2, Fe(OH)3
|
|
| H2SO4, Cd(OH)2, CsHSO3
|
| H2SiO3, Al(OH)2NO3, Cu(OH)2
|
|
| (SnOH)2SO4, K2HPO4, H2S
|
| SrCl2, Ba(OH)2, MgOHCl
|
|
| NH4HS, CoOHNO3, Fe(OH)3
|
| H3PO4, BaCl2, NiOHNO3
|
|
| Cr2(SO4)3, ZnOHCl, H2SO4
|
| HClO4, Na2SO4, NH4OH
|
|
| HClO, Pb(HSO4)2, Ba(NO3)2
|
| KHSO3, Zn(NO3)2, HClO2
|
|
| NiCl2, Ni(OH)2, HClO3
|
| HNO2, NaHSeO3, Mg(OH)2
|
|
| Fe2(SO4)3, Pb(OH)2, HNO2
|
| H2SeO3, Ca(HS)2, Sr(OH)2
|
|
| CdOHBr, HF, Sr(OH)2
|
| LiOH, H2SO4, Ba(HSiO3)2
|
|
| Zn(OH)2, MnOHCl, Ba(HSO3)2
|
| LiHSe, HNO3, K3PO4
|
|
| KHS, HNO2, Al(OH)3
|
| FeCl3, Mg(HCO3)2, HClO
|
|
| Ca(HCO3)2, HCOOH, Fe(OH)2
|
| Mn(NO3)2, Bi(OH)3, HSCN
|
|
| Cr(OH)2NO3, Fe2(SO4)3, H2Se
|
| Fe(NO3)3, H3PO4, KHSiO3
|
|
| HCN, FeOHCl, KI
|
| ZnSO4, MnOHCl, H2SO3
|
|
№
п/п
|
2. Напишите в молекулярной и ионной формах уравнения следующих реакций
|
3. По заданным ионным уравнениям напишите соответствующие молекулярные уравнения
|
|
| NaHSO3+ NaOH; BaCO3 + H2SO4
| SO32- + H+ = HSO3-
|
|
| LiOH + HCl; Ba(OH)2 + CO2
| 3Ag+ + PO43- = Ag3PO4
|
|
| MgS + H2SO4; CuCl2 + AgNO3
| Al3+ + 3OH- = Al(OH)3
|
|
| NH4NO3 + KOH; HNO3 + Na2SO3
| CN- + H+ = HCN
|
|
| Ba(NO3)2 + K2SO4; MgCO3 + HCl
| Co2+ +S2- = CoS
|
|
| Zn(OH)2 + NaOH; Ca(OH)2 + CO2
| CuO + 2H+ = H2O + Cu2+
|
|
| Cr(OH)3 + NaOH; BaCO3 + HCl
| 2H+ + SO32- = H2SO3
|
|
| Hg(NO3)2 + KI; Zn(OH)2 + HCl
| Mg2+ + Cl- + OH- = MgOHCl
|
|
| Na3PO4 + AgNO3; Mg(OH)2 + CO2
| HCO3- + OH- = CO32- + H2O
|
|
| Ba(OH)2 + HCl; K3PO4 + H2SO4
| SO42- + Ba2+ = BaSO4
|
|
| Na2S + H2SO4; K2(SO4) +Ba(NO3)2
| Cd2+ + 2OH- = Cd(OH)2
|
|
| Cd(OH)2 + H2S; Al2(SO4)3 + KOH
| Zn2+ +S2- = ZnS
|
|
| AgNO3 + NaCl; Ni(OH)2 +HCl
| Mg2+ + CO32- = MgCO3
|
|
| AlCl3 + KOH; Na2S + HCl
| Cl- + Ag+ = AgCl
|
|
| K3PO4 + H3PO4; Pb(NO3)2 + KI
| S2- + H+ = HS-
|
|
| KOH + H2CO3; Fe(OH)2 + H2SO4
| Bi3+ + 3OH- = Bi(OH)3
|
|
| K2CO3 + BaCl2; Na2CO3 + H2CO3
| S2- + Fe2+ = FeS
|
|
| MgCl2 + KOH; CH3COOH+KOH
| FeO + 2H+ = H2O + Fe2+
|
|
| CaS + HCl; CrCl3 + AgNO3
| Co2+ + CO32- = CoCO3
|
|
| CoSO4 + NaOH; CaSO4 + HNO3
| H+ + OH- = H2O
|
|
| Sr(OH)2 + H2SO4; NiCl2 + NaOH
| 3H+ + PO43- = H3PO4
|
|
| Pb(CH3COO)2 + NaJ;H2SO3 +Na2O
| Cu2+ + 2OH- = Cu(OH)2
|
|
| H3PO4 + LiOH; Ca(OH)2 + H2CO3
| 2I- + Pb2+ = PbI2
|
|
| Cr(OH)3 + HCl; K2SO3 + H2SO4
| 2H+ + SiO32- = H2SiO3
|
|
| Sn(OH)2 + KOH; NaHSiO3 +NaOH
| 3Ca2+ + 2PO43- = Ca3(PO4)2
|
|
| MnS + HCl; Ca(HCO3)2 + NaOH
| Ni2+ SiO32- = NiSiO3
|
|
| Fe(OH)3 + H2SO4; Zn(OH)2 + NH3
| Zn2+ + NO3- + OH- = ZnOHNO3
|
|
| Na2SiO3 + HCl; Cu(OH)2 + HCl
| 3Cu2+ + 2PO43- = Cu3(PO4)2
|
|
| FeS + HCl; NaH2PO4 + NaOH
| Ag+ + Br- = AgBr
|
|
| Al(OH)3 + KOH; AgNO3 + Na3PO4
| Zn2+ + 4OH- =ZnO22- + 2H2O
|
ГИДРОЛИЗ СОЛЕЙ
Гидролиз - это взаимодействие соли с водой, в результате которого происходит смещение ионного равновесия воды и изменение значения рН раствора. Возможность и характер протекания гидролиза определяется природой основания и кислоты, образующих соль.
Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются. Их водные растворы нейтральны.
NaNO3 + H2O ¹; pH = 7.
| Гидролизу подвергаются ионы слабого основания и слабой кислоты
|
.
3.1. Соли, образованные сильной кислотой и слабым основанием
Пример: NH4Cl.
Диссоциация соли в растворе: NH4Cl = NH4 + + Cl-.
Гидролизу подвергается катион слабого основания NH4+:
NH4+ + HOH ⇄ NH4OH + H+ (ионы H+ в избытке).
Молекулярное уравнение:
NH4Cl + H2O⇄NH4OH + HCl - кислая среда (pH < 7).
3.2. Соли, образованные слабой кислотой и сильным основанием
Пример: Na2СO3.
Диссоциация соли в растворе:
Na2СO3 = 2Na+ + СO3 2-.
Гидролизу подвергается анион слабой кислоты СO32-:
1 ступень СO32- + HOH ⇄ HСO3- + OH- (ионы OH- в избытке).
Молекулярное уравнение 1 ступени:
Na2СO3 + H2O ⇄ NaHСO3 + NaOH - щелочная среда (pH > 7).
При обычных условиях гидролиз протекает, главным образом, по первой ступени.
3.3. Соли образованные слабым основанием и слабой кислотой ((NH4)2CO3, Al2S3 и т.д.), гидролизуются как по катиону, так и по аниону. В этом случае гидролиз соли протекает до конца: в уравнении происходит замена знака “⇄” на “=”, а рН среды определяется силой кислоты и основания:
Пример: NH4ClO
Диссоциация соли в растворе: NH4ClO = NH4+ + ClO -
Гидролизу подвергается катион слабого основания NH4+ и анион с слабой кислоты ClO -:
NH4+ + ClO - + HOH = NH4OH + HClO
Молекулярное уравнение:
NH4ClO + H2O = NH4OH + HClO
K (HClO) = 3×10-8 < K (NH4OH) = 1,8×10-5 (см. приложение 4), так как основание является более сильным электролитом, чем кислота, среда слабощелочная рН > 7.
3.4. Совместный гидролиз двух солей протекает необратимо с образованием слабого основания и слабой кислоты:
Пример: Al2(SO4)3 + K2S
Диссоциация солей:
Al2(SO4)3 = 2Al3+ + 3SO42 - – гидролиз по катиону
K2S = 2K+ + S2 - – гидролиз по аниону
Итоговое ионное уравнение:
2Al3+ + 3S2 - + 6H2O = 2Al(OH)3 + 3H2S
Молекулярное уравнение:
Al2(SO4)3 + 3K2S + 6H2O = 2Al(OH)3 + 3H2S + 3К2SO4
Домашнее задание № 3
Тема: Гидролиз солей
| Напишите в молекулярной и ионной формах уравнения гидролиза солей, укажите значения рН растворов этих солей (больше или меньше)
| Напишите в молекулярной и ионной формах уравнения реакций совместного гидролиза солей.
|
| 1. Ba(CH3COO)2, CoSO4, SrCl2
| 1. Fe2(SO4)3 + Na2CO3
|
| 2. AlCl3, NaHCO3,CH3COOK
| 2. K2SO3 + AlBr3
|
| 3. Na3PO4, ZnCl2, Fe(NO3)3
| 3. AlCl3 + Na2SO3
|
| 4. Cr(NO3)3, K2CO3, (NH4)2SO4
| 4. SnCl2 + K2CO3
|
| 5. K2SO3, ZnSO4, BaCl2
| 5. K2CO3 + Bi(NO3)3
|
| 6. NH4Cl, KClO, NiBr2
| 6. Na2S + AlCl3
|
| 7. Na2Se, MnCl2, Sr(NO3)2
| 7. FeCl3 + K2CO3
|
| 8. ZnSO4, BaS, NaCl
| 8. Cr2(SO4)3 + Na2SO3
|
| 9. Ni(NO3)2, KNO2, KHSiO3
| 9. BeCl2 + Na2S
|
| 10. NaCN, FeSO4, CaBr2
| 10. Na2S + Al2(SO4)3
|
| 11. Na2HPO4, Mg(NO3),CrCl3
| 11. SnCl2 + K2SO3
|
| 12. Al2(SO4)3, Na2SeO3, KNO3
| 12. Na2CO3 + Cr(NO3)3
|
| 13. NaNO2, Cu(NO3)2, K3PO4
| 13. K2СO3 + Bi(NO3)3
|
| 14. Na2SO3, Fe2(SO4)3, Li2SO4
| 14. (NH4)2SO4 + K2СO3
|
| 15. Ca(HCO3)2, CuBr2, SnBr2
| 15. NH4NO3 + Na2SO3
|
| 16. FeCl2, K2S, Ca(HCO3)2
| 16. SnCl2 + Na2СO3
|
| 17. NiSO4, NaF, CaCl2
| 17. Na2SO3 + CrCl3
|
| 18. Pb(NO3)2, Ba(NO3)2, PbCl2
| 18. Na2S + Al2(SO4)3
|
| 19. Cr2(SO4)3, NaCH3COO, Li2S
| 19. Fe(NO3)3 + K2CO3
|
| 20. KHS, MgSO4, NaNO3
| 20. Al2(SO4)3 + Na2CO3
|
| 21. CdCl2, NaClO, CrCl3
| 21. Na2SO3 + SnCl2
|
| 22. NH4Br, Na2S, AlCl3
| 22. NH4Cl + Na2SO3
|
| 23. KHSO3, KJ, MnSO4
| 23. K2SO3 + CrCl3
|
| 24. Li2S, CrCl3, KCN
| 24. AlBr3 + Na2SO3
|
| 25. SrS, SnBr2, LiNO3
| 25. SnCl2 + Na2CO3
|
| 26. CuSO4, K3PO4, Ca(NO3)2
| 26. Cr2(SO4)3 + K2S
|
| 27. Li2SO3, AlCl3, ZnSO4
| 27. Bi(NO3)3 + Na2CO3
|
| 28. Zn(NO3)2, NaH2PO4, NH4NO3
| 28. Na2S + Al(NO3)3
|
| 29. (NH4)2ClO4, RbHSiO3, LiHS
| 29. CrCl3 + K2S
|
| 30. SnSO4, KF, KClO4
| 30. SnCl2+ K2CO3
|
РЕАКЦИИ (ОВР)
Окислительно-восстановительными называются реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ. Например:
+4 -1 +2 0
MnO2 + 4 HCl = MnCl2 + Cl2 + 2 H2O.
Реакций
Существуют разные методы составления уравнений ОВР. Для реакций, протекающих в растворах электролитов, используют метод электронно-ионного баланса. Рассматривают реакции в кислой, щелочной и нейтральной средах. Важно учитывать, что при составлении уравнений этим методом соблюдаются правила написания ионных уравнений (см. раздел “Электролиты”).
Пример 1. ОВР в кислой среде.
Как правило, среда создается добавлением разбавленной H2SO4.
K2Cr2O7 + Na2SO3 + H2SO4 ® Cr+3 + SO42-
ОВР- пара среда
Рассмотрим порядок расстановки коэффициентов:
1. Записываем левую часть уравнения в ионном виде согласно правилам написания ионных уравнений:
2 K+ + Cr2O72- + 2Na+ + SO32- + 2H+ + SO42- ® Cr+3 + SO42-.
Такая запись необходима для того, чтобы увидеть реально существующие частицы в растворах и использовать их при составлении полуреакций.
2. Записываем схемы полуреакций для реально существующих частиц:
Cr2O72- ® Cr+3;
SO32- ® SO42-.
3. Уравниваем число атомов элементов, изменяющих степень
окисления:
Cr2 O7 2- ® 2 Cr+3;
SO32- ® SO42-.
4. Уравниваем число атомов кислорода в левой и правой частях полуреакций, при этом учитываем, что в кислой среде присутствуют ионы H+ и молекулы H2 O, в состав которых входят атомы кислорода.
Таблица 3. УРАВНИВАНИЕ КИСЛОРОДА В РАЗНЫХ СРЕДАХ
| среда
| схема уравнивания кислорода
| примечание
|
| кислая
| nO-2 + 2nH+ ® nH2O
| лишний кислород убирается в воду
|
| щелочная
| nO-2 + nH2O ® 2nOH-
| лишний кислород убирается в два гидроксид-иона (2OH-)
|
| нейтральная
| nO-2 + 2nH+ ® nH2O или
nO-2 + nH2O ® 2nOH-
| лишний кислород убирается либо в воду как в кислой среде, либо в 2OH- как в щелочной среде, лишь бы в левой части уравнения была вода.
|
Правило: в кислой среде в ту часть уравнения полуреакций, в которой недостает “n” атомов кислорода, добавляем “n” молекул H2O, а в противоположную часть записываем суммарное количество ионов H+
Cr 2 O7 2+ 14H+ ® 2Cr+3 + 7H2 O;
SO32- + H2 O ® SO4 2- + 2H+.
5. Записываем число электронов, отданных восстановителем и
принятых окислителем, для этого считается суммарный заряд в левой и правой частях полуреакций и сравнивается:
Cr 2 O7 2+ 14H+ ® 2Cr+3 + 7H2O -2 + 14 ® 2*



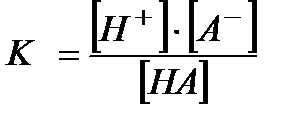 ,
,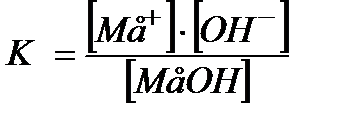 ,
,


