Химическая термодинамика, кинетика, равновесие
Задача 1. Вычислите удельную теплоту сгорания (кДж/м3) газовой смеси (н.у.) следующего объёмного состава (см. таблицу), считая состояния веществ стандартными и температуру, равной 298К.
Задача 2. Для Вашей обратимой химической реакции:
1) рассчитайте стандартную энтальпию и стандартную энтропию реакции при 298К,
2) определите, в каком направлении будет протекать реакция при стандартных состояниях всех участников и 298К,
3) рассчитайте температуру, при которой равновероятны прямая и обратная реакции и область температур, при которых наиболее вероятно протекание прямой реакции,
4) определите, изменится ли направление протекания процесса при 298К с увеличением парциальных давлений исходных газообразных веществ до 3 атмосфер,
5) выберите любую температуру из области самопроизвольного протекания прямой реакции (п.3) и рассчитайте стандартное изменение энергии Гиббса с учётом зависимости энтальпии и энтропии реакции от температур и предполагая, что теплоемкость веществ постоянна в интервале температур
(298-T) K,
6) рассчитайте значения констант равновесия Кр и Кс и равновесные давления и концентрации всех веществ при этой температуре (п.5), если начальные парциальные давления исходных веществ равнялись 3 атм., а продуктов -1 атм.
7) предложите способы увеличения выхода продуктов в равновесной смеси.
Задача 3. Для гомогенной химической реакции А+ В = АВ, имеющей общий порядок, равный 2, запишите кинетическое уравнение и рассчитайте:
1) энергию активации, используя значения констант скоростей k1, k2 (л∙ моль-1с-1) при двух соответствующих температурах Т1, Т2 (К) и предложите способ ее уменьшения,
2) предэкспоненциальный множитель уравнения Аррениуса,
3) начальную скорость данной реакции при Т2 и начальной концентрации исходных вещества, равной С (моль/л),
4) рассчитайте период полупревращения вещества при Т2,
5) определите концентрацию исходного вещества и скорость реакции через 60 минут от начала ее протекания при Т2,
6) рассчитайте, во сколько раз изменилась скорость данной реакции при Т2 после введения катализатора, снизившего величину энергии активации на 15 кДж/моль.
Исходные данные к расчетному заданию №2 «Химическая термодинамика, кинетика, равновесие»
| в
| Задача 1
| Задача 2
| Задача 3
|
|
k 1
|
k 2
| Т1
| Т2
|
С
|
|
| 80%СН4, 20%С2Н6
| CT + 2H2 =CH4
| 1,1∙ 10-2
| 2,2 ∙102-
|
|
|
|
|
| 80%СН4, 20%С3Н8
| N2 +3H2 = 2NH3
| 1,4∙ 10-2
| 2,8 ∙102-
|
|
| 0.1
|
|
| 80%СН4, 20%С4Н10
| SO2+ Cl2 =SO2Cl2
| 1,3∙ 10-2
| 3,9 ∙102-
|
|
| 0,1
|
|
| 70%СН4, 30%С2Н6
| 2NO + O2 =2NO2
| 1,2∙ 10-3
| 3,6 ∙102-
|
|
| 0,5
|
|
| 70%СН4, 30%С3Н8
| 2NO2 = N2O4
| 1,1∙ 10-2
| 4,4 ∙102-
|
|
| 0,3
|
|
| 70%СН4, 30%С4Н10
| PCl5 = PCl3 + Cl2
| 3,1∙ 10-2
| 9,3 ∙102-
|
|
|
|
|
| 90%СН4, 10%С2Н6
| CH4+H2O = CO2+3H2
| 1,1∙ 10-4
| 1,1 ∙102-
|
|
| 0,4
|
|
| 90%СН4, 10%С3Н8
| CO + H2O = CO2 + H2
| 1,4∙ 10-4
| 2,8 ∙103-
|
|
| 0,5
|
|
| 90%СН4, 10%С4Н10
| CO2 +4H2=CH4+2H2O
| 1,3∙ 10-2
| 3,9 ∙102-
|
|
| 0,7
|
|
| 80%СН4, 20%С5Н12
| CH4+ 2O2=CO2+2H2O
| 1,1∙ 10-4
| 3,3 ∙104-
|
|
| 0,1
|
|
| 70%СН4, 30%С5Н12
| H2 + Cl2 = 2HCl
| 2,5∙ 10-2
| 7,5 ∙102-
|
|
| 0,8
|
|
| 90%СН4, 10%С2Н2
| H2 +I2= 2HI
| 2,1∙ 10-3
| 2,1 ∙102-
|
|
| 0,5
|
|
| 85%СН4, 15%С2Н6
| C2H4 = C2H2+ H2
| 4,1∙ 10-2
| 8,2 ∙102-
|
|
| 0,7
|
|
| 95%СН4,
5%С2Н6
| CO +Cl2 = COCl2
| 1,6∙ 10-4
| 6,4 ∙103-
|
|
| 0,5
|
|
| 85%СН4, 15%С3Н8
| H2 + Br2 = 2HBr
| 3,1∙ 10-2
| 9,3 ∙102-
|
|
| 0,8
|
|
| 85%СН4, 15%С4Н10
| C2H6 = C2H4 + H2
| 1,7∙ 10-2
| 3,4 ∙102-
|
|
| 0,5
|
|
| 95%СН4,
5%С3Н8
| 2NO = N2 + O2
| 2,1∙ 10-2
| 6,3 ∙102-
|
|
|
|
|
| 95%СН4,
5%С4Н10
| 2NO2 = N2 +2O2
| 1,1∙ 10-3
| 3,3 ∙102-
|
|
| 0,6
|
|
| 95%СН4,
5%С2Н2
| SO2Cl2 = SO2+ Cl2
| 1,5∙ 10-2
| 6,0 ∙102-
|
|
| 0,5
| |
|
| 60%СН4, 40%С2Н6
| N2O5= N2O4 + 1|2O2
| 1,2∙ 10-2
| 4,8∙102-
|
|
|
| |
|
| 60%СН4, 40%С3Н8
| CH3COCH3 =C2H4+CO+H2
| 1,1∙ 10-3
| 3,3 ∙103-
|
|
| 0,5
| |
|
| 60%СН4, 40%С4Н10
| CO2 + CT = 2CO
| 4,1∙ 10-3
| 8,2 ∙103-
|
|
| 0,9
| |
|
| 60%СН4, 40%С5Н12
| 2SO2 + O2 =2SO3
| 2,2∙ 10-4
| 2,2 ∙102-
|
|
| 0,7
| |
|
| 75%СН4, 25%С5Н12
| C3H6 + H2 = C3H8
| 1,8∙ 10-2
| 3,6 ∙102-
|
|
|
| |
|
| 75%СН4, 25%С2Н6
| Cl2 +2HI= I2 +2HCl
| 1,9∙ 10-2
| 7,6∙102-
|
|
| 0,8
| |
Методические указания по выполнению расчетного задания №2
1.Перед выполнением задач прочтите материал лекций, учебника [2] и главы 3-5 пособия [3].
2. Разберите примеры аналогичных задач в сборнике [4].
3.Справочные данные Вы найдете в [1].
Рекомендуемая литература
1.Краткий справочник физико - химических величин./ Под ред. Равделя и Пономаревой.2010.
2.Н.В.Коровин Н.В. Общая химия: учебник -13 изд., - М.: Изд.центр Академия, 2011.
3. Общая химия. Теория и задачи: Учебное пособие / Под ред. Н.В. Коровина и Н.В. Кулешова – СПб.: Изд. Лань, 2014.
4.Задачи и упражнения по общей химии. Под ред. Н.В.Коровина. М.:Высшая школа, 2006.
Некоторые примеры решения задач по теме
Задача 1
Рассчитать Кр и Кс реакции
С(к) + СО2(г) = 2СО(г)
При 298 К и 1000 К, если
∆ rG0298 = 120,15 кДж; ∆ rG01000 = -3,16 кДж.
Сделайте вывод о выходе продукта реакции
Решение
Кр =  ; Кр = Кс (R*T)∆n, Кс =
; Кр = Кс (R*T)∆n, Кс = 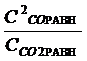
∆ rG0Т = - RT ln Кр Þ Kp =exp(- ∆G0Т / RT)
Кр 298 = exp(-120.103/8,31.298) = ехр(-48,5) = 8×10-22;
Kp 1000 = exp(+3160/8,31.1000) = ехр(0,38) = 1, 46.
Кс = 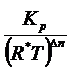 ∆n = 2-1=1
∆n = 2-1=1
Кс 298 = 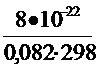 = 3×10-23 Кс 1000 =
= 3×10-23 Кс 1000 =  = 0,018
= 0,018
При 298 К - Кр < 0 Þ в равновесной смеси практически отсутствуют продукты и смещение Þв сторону получения исходных веществ.
При 1000 К - Кр > 1 Þ в равновесной смеси преобладают продукты, их выход растет с ↑Т,
Задача 2
Определить равновесные концентрации веществ для реакции: С(к) + СО2(г) = 2СО(г), если Сисх СО2 = 0,5 моль/л; р еакция протекает при:Т = 1000 К в закрытом сосуде и в начальный момент:
продукт отсутствовал; уголь - в избытке и К с1000 = 0,018
Задача 4
Рассчитать ∆r H0298 и ∆r H01000 реакции
С (к) + СО2 (г) = 2СО (г),
считая постоянными теплоемкости реагентов в данном температурном интервале.
Решение
∆rН0Т = ∆rН0298 + ∆rС0р (Т - 298)
Справочные данные:
| Вещество
| Δ fН 0298, кДж/моль
| С0р 298,Дж/(моль.К)
|
| С(графит)
| 0,0
| 8,54
|
| СО2 (г)
| -393,5
| 37,41
|
| СО (г)
| -110,5
| 29,14
|
ΔrН0298 = 2ΔfН0298 СО (г) - ΔfН0298 С (к) - ΔfН0298 СО2 (г) =
= 2(-110,5) – 0 – (-393,5) = 172,5 кДж.
ΔrН0298 >0 - реакция эндотермическая
∆rС0р = 2С0р298 СО (г) – С0р298 С (к) – С0р298 СО2 (г) =
= 2.(29,14) – 8,54 – 37,41 = 12,33 Дж/К.
∆ rН 01000 =172,5 + 12,33.10-3.(1000 - 298) = 181,16 кДж.
Задача 5
Рассчитать ∆ r S0Т реакции
С (к) + СО2 (г) = 2СО (г),
при 298К и при 1000К, считая С0pi = const в рассматриваемом температурном интервале.
Решение
∆r S0Т = ∆r S0298 + ∆rС0р ln 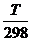
Справочные данные:
| Вещество
| S0298, кДж/(моль.K)
| С0р 298,Дж/(моль.К)
|
| С(графит)
| 5,74
| 8,54
|
| СО2 (г)
| 213,68
| 37,41
|
| СО (г)
| 197,54
| 29,14
|
Δr S0298 = 2S0298 СО (г) - S0298 С (к) - S0298 СО2 (г) =
= 2(197,54)–5,74–213,68=175,66 Дж/K
∆rС0р = 2С0р298 СО (г) – С0р298 С (к) – С0р298 СО2 (г) =
= 2.(29,14) – 8,54 – 37,41 = 12,33 Дж/К.
∆ r S0 1000 = 175,66 + 12,33.10-3. ln (1000 / 298) = 190,59 Дж/К
Задача6 Определить температурную область самопроизвольного протекания реакции
С (к) + СО2 (г) = 2СО (г),
при стандартных состояниях компонентов.
Решение
Реакция протекает самопроизвольно при стандартных состояниях компонентов, если:
∆ r G0Т =∆ r H 0298+ 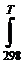 ∆ rС0p dT+Т ∆ r S0 298+ Т
∆ rС0p dT+Т ∆ r S0 298+ Т  ∆ rС0p / T) dT < 0
∆ rС0p / T) dT < 0
Допустим: ∆r H0 и ∆r S0 не зависят от температуры:
∆ r G0Т = ∆ r H0298 - T ∆ r S0298 < 0
Тогда подставив найденные в задачах4 и5 ∆r H0 и ∆r S0 получаем:
(172,5 – Т ∙175,66∙10-3) < 0 Тр = 982 К
Т > 982 К
Справочные данные:
| Вещество
| Интервал температур, .К
|
| С(графит)
| (298 – 2300) К
|
| СО2 (г)
| (298 – 2500) К
|
| СО (г)
| (298 – 2500) К
|
Следовательно: Область температур протекания реакции: 982 ÷ 2300
Химическая термодинамика, кинетика, равновесие
Задача 1. Вычислите удельную теплоту сгорания (кДж/м3) газовой смеси (н.у.) следующего объёмного состава (см. таблицу), считая состояния веществ стандартными и температуру, равной 298К.
Задача 2. Для Вашей обратимой химической реакции:
1) рассчитайте стандартную энтальпию и стандартную энтропию реакции при 298К,
2) определите, в каком направлении будет протекать реакция при стандартных состояниях всех участников и 298К,
3) рассчитайте температуру, при которой равновероятны прямая и обратная реакции и область температур, при которых наиболее вероятно протекание прямой реакции,
4) определите, изменится ли направление протекания процесса при 298К с увеличением парциальных давлений исходных газообразных веществ до 3 атмосфер,
5) выберите любую температуру из области самопроизвольного протекания прямой реакции (п.3) и рассчитайте стандартное изменение энергии Гиббса с учётом зависимости энтальпии и энтропии реакции от температур и предполагая, что теплоемкость веществ постоянна в интервале температур
(298-T) K,
6) рассчитайте значения констант равновесия Кр и Кс и равновесные давления и концентрации всех веществ при этой температуре (п.5), если начальные парциальные давления исходных веществ равнялись 3 атм., а продуктов -1 атм.
7) предложите способы увеличения выхода продуктов в равновесной смеси.
Задача 3. Для гомогенной химической реакции А+ В = АВ, имеющей общий порядок, равный 2, запишите кинетическое уравнение и рассчитайте:
1) энергию активации, используя значения констант скоростей k1, k2 (л∙ моль-1с-1) при двух соответствующих температурах Т1, Т2 (К) и предложите способ ее уменьшения,
2) предэкспоненциальный множитель уравнения Аррениуса,
3) начальную скорость данной реакции при Т2 и начальной концентрации исходных вещества, равной С (моль/л),
4) рассчитайте период полупревращения вещества при Т2,
5) определите концентрацию исходного вещества и скорость реакции через 60 минут от начала ее протекания при Т2,
6) рассчитайте, во сколько раз изменилась скорость данной реакции при Т2 после введения катализатора, снизившего величину энергии активации на 15 кДж/моль.
Исходные данные к расчетному заданию №2 «Химическая термодинамика, кинетика, равновесие»
| в
| Задача 1
| Задача 2
| Задача 3
|
|
k 1
|
k 2
| Т1
| Т2
|
С
|
|
| 80%СН4, 20%С2Н6
| CT + 2H2 =CH4
| 1,1∙ 10-2
| 2,2 ∙102-
|
|
|
|
|
| 80%СН4, 20%С3Н8
| N2 +3H2 = 2NH3
| 1,4∙ 10-2
| 2,8 ∙102-
|
|
| 0.1
|
|
| 80%СН4, 20%С4Н10
| SO2+ Cl2 =SO2Cl2
| 1,3∙ 10-2
| 3,9 ∙102-
|
|
| 0,1
|
|
| 70%СН4, 30%С2Н6
| 2NO + O2 =2NO2
| 1,2∙ 10-3
| 3,6 ∙102-
|
|
| 0,5
|
|
| 70%СН4, 30%С3Н8
| 2NO2 = N2O4
| 1,1∙ 10-2
| 4,4 ∙102-
|
|
| 0,3
|
|
| 70%СН4, 30%С4Н10
| PCl5 = PCl3 + Cl2
| 3,1∙ 10-2
| 9,3 ∙102-
|
|
|
|
|
| 90%СН4, 10%С2Н6
| CH4+H2O = CO2+3H2
| 1,1∙ 10-4
| 1,1 ∙102-
|
|
| 0,4
|
|
| 90%СН4, 10%С3Н8
| CO + H2O = CO2 + H2
| 1,4∙ 10-4
| 2,8 ∙103-
|
|
| 0,5
|
|
| 90%СН4, 10%С4Н10
| CO2 +4H2=CH4+2H2O
| 1,3∙ 10-2
| 3,9 ∙102-
|
|
| 0,7
|
|
| 80%СН4, 20%С5Н12
| CH4+ 2O2=CO2+2H2O
| 1,1∙ 10-4
| 3,3 ∙104-
|
|
| 0,1
|
|
| 70%СН4, 30%С5Н12
| H2 + Cl2 = 2HCl
| 2,5∙ 10-2
| 7,5 ∙102-
|
|
| 0,8
|
|
| 90%СН4, 10%С2Н2
| H2 +I2= 2HI
| 2,1∙ 10-3
| 2,1 ∙102-
|
|
| 0,5
|
|
| 85%СН4, 15%С2Н6
| C2H4 = C2H2+ H2
| 4,1∙ 10-2
| 8,2 ∙102-
|
|
| 0,7
|
|
| 95%СН4,
5%С2Н6
| CO +Cl2 = COCl2
| 1,6∙ 10-4
| 6,4 ∙103-
|
|
| 0,5
|
|
| 85%СН4, 15%С3Н8
| H2 + Br2 = 2HBr
| 3,1∙ 10-2
| 9,3 ∙102-
|
|
| 0,8
|
|
| 85%СН4, 15%С4Н10
| C2H6 = C2H4 + H2
| 1,7∙ 10-2
| 3,4 ∙102-
|
|
| 0,5
|
|
| 95%СН4,
5%С3Н8
| 2NO = N2 + O2
| 2,1∙ 10-2
| 6,3 ∙102-
|
|
|
|
|
| 95%СН4,
5%С4Н10
| 2NO2 = N2 +2O2
| 1,1∙ 10-3
| 3,3 ∙102-
|
|
| 0,6
|
|
| 95%СН4,
5%С2Н2
| SO2Cl2 = SO2+ Cl2
| 1,5∙ 10-2
| 6,0 ∙102-
|
|
| 0,5
| |
|
| 60%СН4, 40%С2Н6
| N2O5= N2O4 + 1|2O2
| 1,2∙ 10-2
| 4,8∙102-
|
|
|
| |
|
| 60%СН4, 40%С3Н8
| CH3COCH3 =C2H4+CO+H2
| 1,1∙ 10-3
| 3,3 ∙103-
|
|
| 0,5
| |
|
| 60%СН4, 40%С4Н10
| CO2 + CT = 2CO
| 4,1∙ 10-3
| 8,2 ∙103-
|
|
| 0,9
| |
|
| 60%СН4, 40%С5Н12
| 2SO2 + O2 =2SO3
| 2,2∙ 10-4
| 2,2 ∙102-
|
|
| 0,7
| |
|
| 75%СН4, 25%С5Н12
| C3H6 + H2 = C3H8
| 1,8∙ 10-2
| 3,6 ∙102-
|
|
|
| |
|
| 75%СН4, 25%С2Н6
| Cl2 +2HI= I2 +2HCl
| 1,9∙ 10-2
| 7,6∙102-
|
|
| 0,8
| |
Методические указания по выполнению расчетного задания №2
1.Перед выполнением задач прочтите материал лекций, учебника [2] и главы 3-5 пособия [3].
2. Разберите примеры аналогичных задач в сборнике [4].
3.Справочные данные Вы найдете в [1].
Рекомендуемая литература
1.Краткий справочник физико - химических величин./ Под ред. Равделя и Пономаревой.2010.
2.Н.В.Коровин Н.В. Общая химия: учебник -13 изд., - М.: Изд.центр Академия, 2011.
3. Общая химия. Теория и задачи: Учебное пособие / Под ред. Н.В. Коровина и Н.В. Кулешова – СПб.: Изд. Лань, 2014.
4.Задачи и упражнения по общей химии. Под ред. Н.В.Коровина. М.:Высшая школа, 2006.
Некоторые примеры решения задач по теме
Задача 1
Рассчитать Кр и Кс реакции
С(к) + СО2(г) = 2СО(г)
При 298 К и 1000 К, если
∆ rG0298 = 120,15 кДж; ∆ rG01000 = -3,16 кДж.



 ; Кр = Кс (R*T)∆n, Кс =
; Кр = Кс (R*T)∆n, Кс = 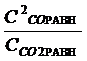
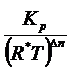 ∆n = 2-1=1
∆n = 2-1=1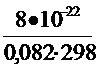 = 3×10-23 Кс 1000 =
= 3×10-23 Кс 1000 =  = 0,018
= 0,018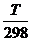
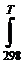 ∆ rС0p dT+Т ∆ r S0 298+ Т
∆ rС0p dT+Т ∆ r S0 298+ Т  ∆ rС0p / T) dT < 0
∆ rС0p / T) dT < 0


