Подгруппа азота – пятая группа, главная подгруппа периодической системы Д.И. Менделеева. В нее входят элементы: азот (N); фосфор (P); мышьяк (As); сурьма (Sb); висмут (Bi). Общая электронная формула элементов подгруппы азота: ns2np 3 – на внешнем энергетическом уровне эти элементы содержат пять валентных электронов, на что указывает номер группы – два электрона на s-подуровне и три не-спаренных электрона на р-подуровне. Это р-эле-менты. У каждого последующего нижестоящего атома нарастает энергетический уровень (N – 2 s2 2p3; P – 3 s2 3p3; As – 4 s2 4p3; Sb – 5 s2 5p3; Bi – 6 s2 6p3), в связи с чем увеличивается радиус атома, уменьшается энергия ионизации, энергия сродства к электрону, электроотрицательность, ослабевают неметаллические свойства – усиливаются металлические.
Характерны следующие степени окисления: N – +1, +2, +3, +4, +5, 0, -1, -3, -5; P – от +1 до +5 (кроме +2), 0, -2, -3; все остальные: +3, +5, -3. Характерные валентности: 3, 4, 5.
Азот пятивалентным быть не может – максимальная его валентность равна четырем, т. к. наивысшая валентность равна числу возможных квантовых ячеек на внешнем уровне – у азота их четыре (одна s– и три р-орбитали), следовательно, число ковалентных связей тоже четыре.
Итак, азот в невозбужденном состоянии имеет валентность три, а в возбужденном (при переходе электронов с s-подуровня) – четыре.
У фосфора и всех последующих элементов подгруппы имеется d-подуровень, куда могут переходить электроны с s– и р-подуровней, и в возбужденном состоянии они имеют валентность пять.
Водородные соединения элементов соответствуют формуле: RН3: NН3 – аммиак; РН3 – фосфин; AsН3 – арсин; SbН – стибин; BiН – висмутин. Все соединения – газы, химическая стойкость каждого последующего ослабевает, что связано с ростом порядкового номера элементов, ослабевания неметаллических свойств и усиления металлических.
Кислородные соединения подгруппы азота отвечают составу: R2О3, R2О5, которые соответствуют кислотам типа: НRО2; НRО3; Н3RO4 – ортокислоты (азот ортокислоты не образует).
Характер оксидов элементов в направлении сверху вниз закономерно изменяется: N2О3, Р2О 3 обладают кислотными свойствами; As2О3, Sb2О3 имеют амфотерные свойства; Bi2О3 – основные свойства. R2О5 образуют только кислотные оксиды и соответствуют кислотам: НRО3, Н3RO4 (кроме азота). Сила кислот НRО3 сверху вниз убывает.
Резкие изменения наблюдаются и у простых веществ элементов подгруппы азота: азот, фосфор, мышьяк – неметаллы; сурьма и висмут – металлы.
Азот.
Азот (N) стоит во 2 периоде, V группе главной подгруппы. Порядковый номер – 7, Ar – 14,008. Строение молекулы::N = N: молекула N2 – самая прочная из всех двухатомных за счет наличия тройной связи малой длины (энергия связи – 946 кДж). Связь в молекуле ковалентная неполярная. Самая короткая и прочная, соединяющая центры атомов –?-связь, расположенная на пересечении плоскостей рх– и рz– орбиталей, которые, перекрываясь, образуют 2, более длинные?-связи, расположенные в 2-х взаимно перпендикулярных плоскостях по отношению друг к другу.
Физические свойства: бесцветный газ, без запаха и вкуса; малорастворим в воде: в 1 л H2O растворяется 15,4 мл N2 при t° = 20 °C и p = 1 атм; t кипения =-196 °C; t плавления =-210 °C. Природный азот состоит из двух изотопов с атомными массами: 14 и 15.
Химические свойства: электронная конфигурация: 1s2 2 s2 2 p 3 – на внешнем уровне 5 валентных электронов. Характерная валентность – 3 и 4. Наиболее характерные степени окисления: -3, -2, -1, +2, +3, +4, +5, 0. Вобычных условиях N2 подобен инертному газу.
При обычной температуре азот реагирует только с литием: 6Li + N20= 2Li3N-3; с остальными металлами реагирует при высоких температурах: 3Mg + N20= MgЗN2-3; 2Аl + N2 = 2АlN.
В реакциях с металлами азот проявляет окислительные свойства: N20= 2N-3.
Реагирует c водородом (500 °C, kat, p):
N20+ 3H2 = 2N-3HЗ, здесь азот также окислитель.
При высокой температура (электрическая дуга, 3000–4000 °C) взаимодействует с кислородом воздуха: N20+ O2 = 2N+2O (в природе – во время грозы).
Азот при этом проявляет свойства восстановителя: N20?2N+2.
С кислородом азот образует несколько оксидов: N2O, NO, N2O3, N O2, N2O5 и NO3.
Получение.
1. В промышленности азот получают путем сжижения воздуха с последующим испарением и отделением азота от других газовых фракций воздуха. Полученный азот содержит примеси благородных газов (аргона).
2. В лаборатории получают чистый азот термическим разложением нитрата аммония:
Нахождение в природе: в природе азот встречается в основном в свободном состоянии. Основное природное содержание азота в воздухе – объемная доля его в воздухе?=78,09 %. В небольшом количество соединения азота находится в почве; азот входит в состав аминокислот, образующих через посредство пептидных связей белки; содержится в молекулах нуклеиновых кислот – ДНК и РНК – в составе азотистых оснований (нуклеотидов): гуанина, аденила, тимидила, цити-зила и уридила. Общее содержание азота в земной коре – 0,01 %.
Аммиак
Физические свойства: аммиак (NH3) – бесцветный газ с резким запахом, растворим в воде, в 2 раза легче воздуха; при охлаждении до -33,4 °C и нормальном давлении превращается в прозрачную жидкость, при 77,8 °C затвердевает. Массовая доля аммиака в концентрированном растворе – 25 %. Раствор NH3 в воде – аммиачная вода или нашатырный спирт. Медицинский нашатырный спирт – 10 %. При низкой температуре образует в растворе кристаллогидрат NH3? Н2О. Строение молекулы: характерна sp3-гибридизация. В образовании молекулы участвуют 3 неспаренных р-электрона азота и 1s – атомов водорода. Молекула имеет форму правильной пирамиды, в вершине которой стоят атомы азота, а в углах – водорода.
Химические свойства:
1) при растворении NH3 в воде образуются гидратированные молекулы аммиака и частично ионы аммония – NH4+ и ОН-ионы – водный раствор аммиака имеет слабощелочную реакцию.
2) NH3 взаимодействует с кислотами: NH3 + Н2SO4 = NH4НSO4;
3) аммиак – сильный восстановитель. Из СuО при нагревании восстанавливает Сu: 3СuО + 2NH3 = Сu + N2 + 3Н2О;
4) в кислороде NH3 горит желтым пламенем: 4NH3 + 3О2 = 2N2? + 6Н2О;
5) кислородом воздуха NH3 окисляется в присутствии катализаторов: Pt, Cr2O3, Rh: 4NH3 + 5О2 = 4NО? + 6Н2О;
6) при замещении водорода на металлы образуются амиды: Na + NH3 = NaNH2 + 1/2 Н2;
7) водород в NH3 может замещаться на галогены. При действии на раствор хлорида аммония газообразным хлором образуется хлорид азота: NH4Cl + 3Cl2 = 4HCl + NCl3.
Нашатырь (хлорид азота).
Получение: в промышленности до концаХ1Х века аммиак получали как побочный продукт при коксовании каменного угля, который содержит до 1–2 % азота.
В начале XX века были разработаны новые промышленные способы получения аммиака, основанные на связывании или фиксации атмосферного азота.
В 1904 году появился циамидный способ, основанный на способности азота при высокой температуре взаимодействовать с карбидом кальция, образуя циамид кальция CaCN2, который при воздействии с водяным паром при давлении 0,6 МПа легко разлагается на аммиак и карбонат кальция:
Позднее появился другой способ получения аммиака – прямое взаимодействие азота и кислорода под воздействием электрических разрядов, но эта реакция была обратимой, пока для нее не нашли оптимальные условия. Этими условиями явились высокое давление и низкая температура, использование катализаторов – губчатого железа с добавками активаторов (оксиды алюминия, калия, кальция, кремния, магния).
Гидрази́н (диамид) H2N—NH2 — Гидразин N2H4 — бесцветная жидкость, кипящая при 113,5°С, получается при действии гипохлорита натрия NaCIO на концентрированный раствор аммиака.
В молекуле гидразина атомы азота имеют неподеленные пары электронов. Это обусловливает способность гидразина к реакциям присоединения. Гидразин хорошо растворяется в воде, а при взаимодействии с кислотами присоединяет по донорно-акцепторному способу один или два иона водорода, образуя два ряда солей — например хлориды гидразония N2H4-HC1 и I^H^H'Cl. Таким образом, гидразин обладает основными свойствами.
Гидразин — хороший восстановитель. При его горении в атмосфере воздуха или кислорода выделяется очень большое количество теплоты, вследствие чего гидразин нашел применение в качестве составной части топлива ракетных двигателей. Гидразин.и всего производные сильно ядовиты.
Азо́тистоводоро́дная кислота́, азоими́д, Азидоводород, или азотистоводородная кислота, HN3 может быть получен действием азотистой кислоты HNO2 на водный раствор гидразина; он представляет собой бесцветную жидкость (темп. кип. 36 °С) с резким запахом.
Азидоводород принадлежит к числу слабых кисллот (К=3*10-5). В водном растворе он диссоциирует на ионы Н+ и N3. Анион азидоводорода N3 имеет линейное строение. Его электронную структуру можно выразить схемой:
[:N=N=N:]-
Соли аммония
Соли аммония – сложные вещества, включающие катионы аммония NH4+ и кислотные остатки.
Физические свойства: соли аммония – твердые кристаллические вещества, хорошо растворимые в воде.
Химические свойства: аммоний обладает свойствами металла, поэтому строение его солей подобно солям щелочных металлов, т. к. ионы NH4+и ионы щелочных металлов (калия) имеют примерно одинаковые радиусы. В свободном виде аммоний не существует, т. к. он химически нестоек и мгновенно разлагается на аммиак и водород. Доказательством металлического характера аммония является наличие амальгамы аммония – сплав аммония с ртутью, схожего с таковой щелочных металлов. При обработке амальгамы аммония холодным раствором сульфата меди, амальгама вытеснит n-е количество меди:
Соли аммония имеют ионную решетку и обладают всеми свойствами типичных солей:
1) являются сильными электролитами – подвергаются диссоциации в водных растворах, образуя катион аммония и анион кислоты:
2) подвергаются гидролизу (соль слабого основания и сильной кислоты):
среда кислая, рН<7, лакмус красный;
3) вступают в обменную реакцию с кислотами и солями:
4) взаимодействуют с растворами щелочей с образованием аммиака – качественная реакция на ион аммония:
соли аммония определяют по запаху выделившегося в результате реакции аммиака, а также по синей окраске лакмуса;
5) разлагаются при нагревании:
Получение: NH3 + HNO3 = NH4NO3 (нитрат аммония); 2NH4OH + H2SO4 = (NH4)2SO4 (cульфат аммония) + 2Н2O.
Применение: соли аммония широко применяются на практике: сульфат аммония – (NH4)2SO4, нитрат аммония – NH4NO3, дигидрофосфат аммония – NH4Н2РO4 и гидрофосфат аммония – (NH4)2НРO4 используются в качестве минерального удобрения. Преимущество удобрения – повышенное содержание в нем аммиака. Используется хлорид аммония (NH4Cl) – нашатырь.
Круговорот азота в природе
Фиксация атмосферного азота в природе происходит по двум основным направлениям — абиогенному и биогенному. Первый путь включает главным образом реакции азота с кислородом. Так как азот химически весьма инертен, для окисления требуются большие количества энергии (высокие температуры). Эти условия достигаются при разрядах молний, когда температура достигает 25000 °C и более. При этом происходит образование различныхоксидов азота. Существует также вероятность, что абиотическая фиксация происходит в результате фотокаталитических реакций на поверхности полупроводников или широкополосных диэлектриков (песок пустынь).
Однако основная часть молекулярного азота (около 1,4×108 т/год) фиксируется биотическим путём. Долгое время считалось, что связывать молекулярный азот могут только небольшое количество видов микроорганизмов (хотя и широко распространённых на поверхности Земли): бактерии Azotobacter и Clostridium, клубеньковые бактерии бобовых растений Rhizobium, цианобактерии Anabaena, Nostoc и др. Сейчас известно, что этой способностью обладают многие другие организмы в воде и почве, например, актиномицеты в клубнях ольхи и других деревьев (всего 160 видов). Все они превращают молекулярный азот в соединения аммония (NH4+). Этот процесс требует значительных затрат энергии (для фиксации 1 г атмосферного азота бактерии в клубеньках бобовых расходуют порядка 167,5 кДж, то есть окисляют примерно 10 г глюкозы). Таким образом, видна взаимная польза от симбиозарастений и азотфиксирующих бактерий — первые предоставляют вторым «место для проживания» и снабжают полученным в результате фотосинтеза «топливом» — глюкозой, вторые обеспечивают необходимый растениям азот в усваиваемой ими форме.
Азот в форме аммиака и соединений аммония, получающийся в процессах биогенной азотфиксации, быстро окисляется до нитратов и нитритов (этот процесс носит название нитрификации). Последние, не связанные тканями растений (и далее по пищевой цепи травоядными и хищниками), недолго остаются в почве. Большинство нитратов и нитритов хорошо растворимы, поэтому они смываются водой и в конце концов попадают в мировой океан (этот поток оценивается в 2,5—8×107 т/год).
Азот, включённый в ткани растений и животных, после их гибели подвергается аммонификации (разложению содержащих азот сложных соединений с выделением аммиака и ионов аммония) и денитрификации, то есть выделению атомарного азота, а также его оксидов. Эти процессы целиком происходят благодаря деятельности микроорганизмов в аэробных и анаэробных условиях.
В отсутствие деятельности человека процессы связывания азота и нитрификации практически полностью уравновешены противоположными реакциями денитрификации. Часть азота поступает в атмосферу из мантии с извержениями вулканов, часть прочно фиксируется в почвах и глинистых минералах, кроме того, постоянно идёт утечка азота из верхних слоёв атмосферы в межпланетное пространство.
Азотная кислота
Азотная кислота – бесцветная, «дымящаяся» на воздухе жидкость с едким запахом. Химическая формула HNO3.
Физические свойства. При температуре 42 °C застывает в виде белых кристаллов. Безводная азотная кислота закипает при атмосферном давлении и 86 °C. С водой смешивается в произвольных соотношениях.
Под воздействием света концентрированная HNO3 разлагается на оксиды азота:
HNO3 хранят в прохладном и темном месте. Валентность азота в ней – 4, степень окисления – +5, координационное число – 3.
HNO3 – сильная кислота. В растворах полностью распадается на ионы. Взаимодействует с основными оксидами и основаниями, с солями более слабых кислот. HNO3 обладает сильной окислительной способностью. Способна восстанавливаться с одновременным образованием нитрата до соединений, в зависимости от концентрации, активности взаимодействующего металла и условий:
1) концентрированная HN03, взаимодействуя с малоактивными металлами, восстанавливается до оксида азота (IV) NO2:
2) если кислота разбавленная, то она восстанавливается до оксида азота (II) NO:
3) более активные металлы восстанавливают разбавленную кислоту до оксида азота (I) N2O:
До солей аммония восстанавливается очень разбавленная кислота:
Au, Pt, Rh, Ir, Ta, Ti не реагируют с концентрированной HNO3, а Al, Fe, Co и Cr – «пассивируются».
4) с неметаллами HNO3 реагирует, восстанавливая их до соответствующих кислот, а сама восстанавливается до оксидов:
5) HNO3 окисляет некоторые катионы и анионы и неорганические ковалентные соединения.
6) вступает во взаимодействие со многими органическими соединениями – реакция нитрования.
Промышленное получение азотной кислоты: 4NH3 + 5O2 = 4NO + 6H2O.
Аммиак – NO переходит в NO2, который с водой в присутствии кислорода воздуха дает азотную кислоту.
Катализатор – платиновые сплавы. Получаемая HNO3 не более 60 %. При необходимости ее концентрируют. Промышленностью выпускается разбавленная HNO3 (47–45 %), а концентрированная HNO3 (98–97 %). Концентрированную кислоту перевозят в алюминиевых цистернах, разбавленную – в цистернах из кислотоупорной стали.
Химические свойства
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
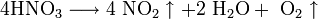
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:


б) с основаниями:

в) вытесняет слабые кислоты из их солей:

При кипении или под действием света азотная кислота частично разлагается:
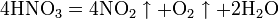
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3
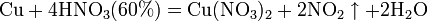
Разбавленная HNO3

б) с металлами, стоящими в ряду напряжений левее водорода:

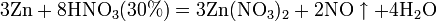
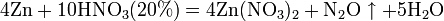


Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение концентрации кислоты 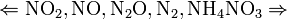 увеличение активности металла
увеличение активности металла
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:


Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:




и сложные вещества, например:

Некоторые органические соединения (например амины и гидразин, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Некоторые металлы (железо, хром, алюминий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж».
Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:



Нитраты
HNO3 — сильная кислота. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде.
Соли азотной кислоты — нитраты — при нагревании необратимо разлагаются, продукты разложения определяются катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:
2NaNO3 = 2NaNO2 + O2
б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:
4Al(NO3)3 = 2Al2O3 + 12NO2 + 3O2
в) нитраты металлов, расположенных в ряду напряжений правее ртути:
2AgNO3 = 2Ag + 2NO2 + O2
г) нитрат аммония:
NH4NO3 = N2O + 2H2O
Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии нитраты — сильные окислители, например:
Fe + 3KNO3 + 2KOH = K2FeO4 + 3KNO2 + H2O — при сплавлении твердых веществ.
Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:

Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно.
С азотной кислотой не реагируют стекло, фторопласт-4.
Азотные удобрения — неорганические и органические азотосодержащие вещества, которые вносят в почву для повышения урожайности. К минеральным азотным удобрениям относят амидные, аммиачные и нитратные. Азотные удобрения получают главным образом из синтетического аммиака. Из-за высокой мобильности соединений азота его низкое содержание в почве часто лимитирует развитие культурных растений, поэтому внесение азотных удобрений вызывает большой положительный эффект.
Из всех типов удобрений азотные наиболее подвержены воздействию со стороны почвенных микроорганизмов. В первую неделю после внесения до 70 % массы удобрения потребляется бактериями и грибами (иммобилизуются), лишь после их гибели входящий в их состав азот может использоваться растениями. Большие потери азота удобрений происходят из-за выноса легкорастворимых нитратов и солей аммония из почвенного профиля, а также в ходе денитрификации (газообразные потери) и из-за нитрификации (образование нитратов и их вынос). В итоге коэффициент использования удобрений растениями редко достигает 50 %, их применение может вызывать эвтрофикацию близлежащих водоёмов. Образующийся в ходе денитрификации N2O является сильным парниковым газом.
Фосфор
Фосфор (Р) находится в 3-м периоде, в V группе, главной подгруппы периодической системы Д.И. Менделеева. Порядковый номер 15, заряд ядра +15, Аr = 30,9738 а.е. м... имеет 3 энергетических уровня, на энергетической оболочке 15 электронов, из них 5 валентных. У фосфора появляется d-подуровень. Электронная конфигурация Р: 1 s2 2 s2 2p63 s2 3p33d0. Характерна sp3-гибридизация, реже sp3d1. Валентность фосфора – III, V. Наиболее характерная степень окисления +5 и -3, менее характерные: +4, +1, -2, -3. Фосфор может проявлять и окислительные и восстановительные свойства: принимать и отдавать электроны.
Строение молекулы: способность образования?-связи менее выражена, чем у азота – при обычной температуре в газовой фазе фосфор представлен в виде молекул Р4, имеющих форму равносторонних пирамид с углами по 60°. Связи между атомами ковалентные, неполярные. Каждый атом Р в молекуле связан стремя другими атомами?-связями.
Физические свойства: фосфор образует три аллотропных модификации: белый, красный и черный. Каждая модификация имеет свою температуру плавления и замерзания.
Химические свойства:
1) при нагревании Р4 обратимо диссоциирует:
2) свыше 2000 °C Р2 распадается на атомы:
3) фосфор образует соединения с неметаллами:
Непосредственно соединяется со всеми галогенами: 2Р + 5Cl2 = 2РCl5.
При взаимодействии с металлами фосфор образует фосфиды:
Соединяясь с водородом, образует газ фос-фин: Р4 + 6Н2 = 4РН3?.
При взаимодействии с кислородом образует ангидрид Р2О5: Р4 + 5О2 = 2Р2О5.
Получение: фосфор получают прокаливанием смеси Са3(Р O4 )2 с песком и коксом в электропечи при температуре 1500 °C без доступа воздуха: 2Са3(РO4)2 + 1 °C + 6SiO2 = 6СаSiO3 + 1 °CO + P4?.
В природе фосфор в чистом виде не встречается, а образуется в результате химической активности. Основными природными соединениями фосфора являются минералы: Са3(РO4)2 – фосфорит; Са3(РO4)2?СаF2 (или СаCl) или Са3(РO4)2?Са(ОН)2 – апатит. Велико биологическое значение фосфора. Фосфор входит в состав некоторых растительных и животных белков: белок молока, крови, мозговой и нервной ткани. Большое его количество содержится в костях позвоночных животных в виде соединений: 3Са3(РO4)2?Са(ОН)2 и 3Са3(РO4)2?СаСО3?Н2О. Фосфор является обязательным компонентом нуклеиновых кислот, играя роль в передачи наследственной информации. Фосфор содержится в зубной эмали, в тканях в форме лецитина – соединения жиров с фосфорноглицериновыми эфирами.



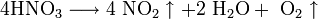




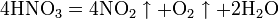
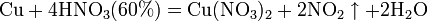


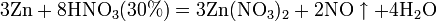
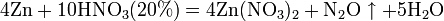


 увеличение активности металла
увеличение активности металла













