Для определения оптической плотности или величины поглощения раствора используют приборы различных типов – фотоколориметры однолучевые КФО, КФК-2, КФК-2МП, КФК-3МП, двухлучевые - ФЭК-М, ФЭК-56, ФЭК-57н, ФЭК-60 и др.; спектрофотометры – СФ-4, СФ-26 и др. Турбидиметрические измерения можно проводить на приборах указанных типов. Для измерения интенсивности рассеянного света обычно используют нефелометры типа ЛМФ.
Порядок работы на приборах различных типов и их оптические схемы имеются на рабочих местах у соответствующих установок.
Каждое определение вещества с помощью оптических методов состоит из следующих этапов:
1. образование окрашенного соединения;
2. выбор длины волны;
3. построение калибровочного графика;
4. определение содержания искомого вещества в пробе по калибровочному графику или по методу добавок;
5. расчет концентрации искомого вещества.
1. При приготовлении растворов окрашенного соединения следует тщательно ознакомиться с методикой анализа, обращая особое внимание на условия получения окраски. Необходимая по условиям работы мерная посуда должна быть тщательно промыта и ополоснута дистиллированной водой. Несоблюдение условий анализа и неаккуратность на рабочем месте приводит к заведомо неверным результатам даже при условиях технически правильно выполненного измерения.
2. Выбор длины волны проводится с целью уменьшения величины возможной погрешности, вызванной немонохроматичность излучения.
Для этого проводят измерение оптической плотности раствора средней концентрации на всех светофильтрах данного типа фотоколориметра. Спектральная характеристика светофильтров приведена в инструкции к прибору. По результатам измерений строят кривую зависимость оптической плотности (D) от длины волны (λ). Для дальнейшего анализа используют светофильтр, измерения с которым дало максимальное значение оптической плотности (рис. 3).

Рисунок 3 – Зависимость оптической плотности от длины волны
3. Для построения калибровочного графика используется раствор вещества, содержание которого необходимо определить в данном образце точно известной концентрации. Для построения калибровочного графика строго определенные объемы этого раствора помещают в мерные колбы, приливают все необходимые реактивы и доводят растворы в мерных колбах до метки, так же как это обычно делается при количественных определениях. Для построения калибровочного графика используют среднеарифметическое из полученных 6 значений. Калибровочный график строят в координатах оптическая плотность (D) – концентрация (рис. 4). Как было показано выше он должен представлять собой прямую, проходящую через начало координат.
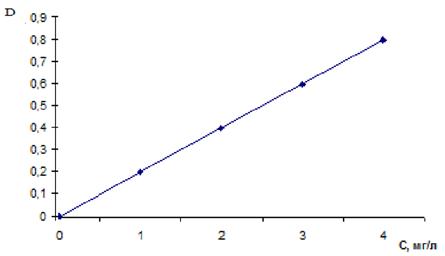
Рисунок 4 – Калибровочный график
Концентрацию выражают либо в мг/пробе, либо в мг/л. Для определения концентрации в каждой точке калибровочного графика, при построении графика в координатах D – концентрация (мг/пробе), содержание в 1 мл пробы на объем пробы, взятой для анализа. При построении графика в координатах D – концентрация (мг/л) расчет проводят по формуле:
 , (17)
, (17)
где а – содержание данного компонента в 1 мл;
v1 – объем пробы для анализа, мл;
v2 – объем мерной колбы, мл.
4. После построения калибровочного графика приступают к анализу раствора данного вещества, концентрация которого неизвестна. При анализе раствора, концентрация которого неизвестна, следует иметь в виду, что оптическая плотность анализируемого раствора должна находиться в пределах от 0,2 до 0,7. При меньших или больших значениях относительная ошибка измерений превышает допустимую погрешность. Так как концентрация анализируемого раствора обычно превышает концентрации, для которых построен калибровочный график, анализируемый раствор необходимо разбавлять. При определении концентрации исследуемого раствора это разбавление необходимо учитывать.
Анализ раствора неизвестной концентрации выполняют точно так же как и при построении калибровочного графика. Измерив оптическую плотность, находят по графику соответствующую ей концентрацию раствора. Содержание искомого компонента (мг/л) находят по формуле:
 , (18)
, (18)
где в – концентрация по графику, мг/л;
v1 – объем мерной колбы, в которой предварительно разводили анализируемый раствор;
v2 – объем пробы анализируемого раствора, взятый для разведения, мл;
v3 – объем пробы, взятой для анализа, мл;
v4 – объем мерной колбы, в которой готовится анализируемый раствор.
Результаты определения обрабатываются методами математической статистики по стандартной методике.
Метод добавок
Это метод применяется при анализе растворов сложного состава, так как он позволяет автоматически учесть влияние «третьих» компонентов, а также в тех случаях, когда концентрация искомого компонента ниже определяемого по данной методике, что приводит к недостоверности полученных результатов или высокой погрешности.
Сущность метода заключается в следующем. Вначале в соответствии с методикой определения данного компонента измеряют оптическую плотность – Dх анализируемого раствора. Затем в анализируемый раствор добавляют известное количество определяемого компонента (Сст) и вновь измеряют оптическую плотность – Dх-ст.
Оптическая плотность Ах стандартного раствора равна:
Dх = εlcx (19)
Оптическая плотность анализируемого раствора с добавкой стандартного соответственно:
Dх-ст = εl(cx + сст) (20)
Сравнение уравнений (19) и (20) дает:
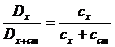 (21)
(21)
или Dх(cx + сст)= Dх-ст cx (22)
отсюда концентрация анализируемого раствора:
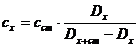 (23)
(23)
Примеры научно-исследовательских работ по
Оптическим методам анализа
1. Определение железа сульфосалициловой кислотой (ССК)
Железо встречается в больших концентрациях в технических растворах и сточных водах травильных отделений, производства солей железа, в сточных водах металлургических, целлюлозно-бумажных производств, шахтных водах. В природных поверхностных водах концентрация железа редко превышает 1 мг/л. Предельно допустимая концентрация (ПДК) в воде питьевого качества не должна превышать 0,3 мг/л. Превышение ПДК ухудшает потребительские качества воды, придавая ей «железистый» вкус, оказывает отрицательное влияние на цветность, прозрачность воды.
Сульфосалициловая кислота (2-окси-5-сульфобензойная кислота) дает с ионами Fe (III) несколько комплексов, отличающихся друг от друга по составу и окраске.
При рН=2-3 в растворе существует красно-фиолетовый комплекс с соотношением железо: ССК = 1: 1.
При рН=4-7 преобладает коричнево-оранжевый комплекс с соотношением компонентов 1: 2.
При рН=8-10 устойчив комплекс с соотношением компонентов 1: 3
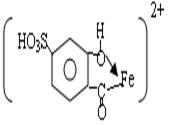
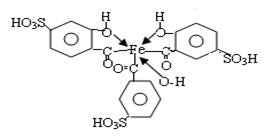
Максимум поглощения этого комплекса находится в области 420-430 нм. молярный коэффициент погашения равен 5,8*103. Растворы устойчивы.
По указанию преподавателя определить содержание железа с помощью сульфосалициловой кислоты при различных значениях рН среды. Результаты сопоставить между собой. Оценить их воспроизводимость. Сравнить данный метод с другими методами определения железа. Изучить влияние мешающих ионов (фосфатов, ацетатов, боратов, меди) на воспроизводимость анализа. Отработать методы устранения мешающих влияний.
Реактивы:
- сульфосалициловая кислота -10% раствор;
- буферный раствор рН=4,5;
- аммиак – 10% раствор;
- стандартный раствор железа – 0,05 мг/см3.
Ход определения
В мерные колбы по 25 см3 помещают от 1 до 5 см3 стандартного раствора соли железа. В зависимости от полученного задания, в колбы вводят 3 см3 ССК (рН=2-3), 3 см3 ССК+ 3 см3 буферной смеси (рН=4-7), 3 см3 ССК + 1 см3 аммиака (рН=8-10). Растворы доводят в колбах до метки. Измеряют оптическую плотность при λ=400-450 нм. Строят калибровочный график. Аналогично готовят раствор исследуемого образца. Концентрацию находят по калибровочному графику. Расчет концентрации выполняют по вышеприведенным формулам. В качестве раствора сравнения используют воду.
2. Определение железа (III) c роданидом
Железо (III) образует с роданид-ионом комплексы с координационным числом от 1 до 6. Интенсивность окраски образующегося комплексного соединения зависит от количества роданид иона и увеличивается в зависимости от его содержания.
Fe3+ + 6 SCN- = [ Fe (SCN)6]3-
Определить содержание железа (III) роданидным методом. Оценить воспроизводимость методики и сопоставить полученные результаты с другими методами определения железа.
Реактивы:
- роданид аммония -10% раствор;
- азотная кислота – 1: 1;
- стандартный раствор железа (III) – 0,05 мг/см3
Ход определения
Для построения калибровочного графика в мерные колбы емкостью 25 см3 помещают от 1 до 5 см3 стандартного раствора соли железа. В раствор добавляют по 2 см3 NH4SCN и каплю HNO3. доводят до метки и колориметрируют при λ=400-450 нм. Строят калибровочный график. В качестве раствора сравнения используют дистиллированную воду. Аналогично поступают с исследуемыми растворами.
3. Определение титана
Определение титана основано на реакции с перекисью водорода. Титан в растворе находится в виде иона титанила. При добавлении Н2О2 к кислому раствору соли титана образуется окрашенный в желтый цвет продукт присоединения:
TiO2+ + H2O2 = [ TiO·H2O2]2+, Кдис.=1·10-4
Определить содержание титана в анализируемом образце. Оценить стабильность соединения в зависимости от кислотности и содержания перекиси. Рассчитать воспроизводимость метода. Изучить влияние примесей и способа их маскирования.
Реактивы:
- перекись водорода – 30% раствор;
- серная кислота – 5 % раствор;
- стандартный раствор титана – 0,1 мг/см3.
Ход определения
В мерные колбы емкостью 50 см3, помещают от 1 до 5 см3, стандартного раствора титана, прибавляют 20 см3, серной кислоты, 5 см3 перекиси водорода, разбавляют раствор до метки и колориметрируют при λ=410 нм и l =2,0 см. В качестве раствора сравнения используют воду. Аналогично поступают с исследуемым раствором.
4. Определение фосфатов
Фосфаты присутствуют в воде в различных формах. Вещества, содержащие фосфор используют для предупреждения образования накипи, они входя в состав многих моющих средств. Фосфор также входит в состав органических соединений (нуклеиновые кислоты, фосфорлипиды и т.д.). В твердой фазе фосфор может быть в виде различных труднорастворимых фосфатов – природных минералов. Присутствие значительных количеств соединений фосфора в воде увеличивает антропогенную нагрузку на водоемы, способствует развитию сине-зеленых и других водорослей, поглотителей кислорода.
Определение фосфатов основано на том, что желтое комплексное соединение, образующееся при взаимодействии ортофосфат-ионов с молибдат-ионами в кислой среде под действием восстановителей, превращается в интенсивно окрашенное синее соединение.
Определить содержание фосфатов в органических и неорганических объектах. Отработать методы перевода органического фосфора в ортофосфаты с помощью различных окислителей (H2O2, (NH4)2S2O3 и др.). проверить воспроизводимость методики, используя различные восстановители фосфор-молибденового комплекса (SnCl2, аскорбиновая кислота). Оценить влияние примесей железа и силикатов на воспроизводимость методики, отработать методы их маскирования.
Реактивы:
- стандартный раствор КН2РО4 – 0,005 мг/см3;
- молибдат аммония (NH4)6Mo7O24 – 2,5 % раствор;
- хлористое олово SnCl2·2H2O – 2,5% раствор;
- аскорбиновая кислота – 10% раствор;
- аммоний надсернокислый (NH4)2S2O8 – 10% раствор;
- перекись водорода Н2О2 – 30% раствор.
Ход определения
В мерные колбы емкостью 100 см3 помещают от 2 до 20 см3 стандартного раствора однозамещенного фосфорнокислого калия. В каждую колбу наливают по 1 см3 молибдата аммония, через 5 минут 0,1 см3 рабочего раствора хлорида олова (исходный раствор разбавляют 1: 1). Перемешивают и раствор доводят в мерно колбе до метки. Интенсивность окраски замеряют через 10 мин при λ= 640-670 нм.
Аналогично поступают с исследуемым раствором, предварительно, в случае определения органического фосфора, его в соответствии с заданием, переводят в ортофосфат.
5. Турбидиметрическое определение сульфат-ионов
Сульфат-ион образует с солями бария малорастворимый осадок сульфат бария (ПР=1·10-10).
SO42- + Ba2+ = BaSO4
В определяемом диапазоне концентраций осадок сульфата бария стабилизируется поверхностно-активными веществами (в частности, желатином).
Определить содержание сульфат-иона. Оценить воспроизводимость полученных результатов в зависимости от различных факторов (скорости и порядка сливания реактивов, присутствия ПАВ, концентрации растворов и т.д.).
Реактивы:
- барий хлористый – 0,5 н. раствор;
- желатин – 0,5 % раствор;
- стандартный раствор серной кислоты – 2 мг/см3 в пересчете на SO32-
Ход определения
Для построения калибровочного графика в мерную колбу на 250 см3 помещают 6,25 см3 исходного стандартного раствора и доводят в колбе до метки.
В мерные колбы на 50 см3 помещают от 5 до 20 см3 полученного раствора (содержание SO32- в 1 см3 0,05 мг), разбавляют водой до одинакового объема, приливают по 1 см3 хлорида бария и 3 см3 желатина. Раствор доводят в мерных колбах до метки и измеряют мутность полученного раствора на нефелометре «ЛМФ-69». Длина волы значения не имеет. Аналогично поступают с исследуемым раствором.
6. Определение кальция методом фотоэлектрического титрования
Кальций является одним из основных компонентов, определяющих воды. Высокая жесткость воды является определяющим фактором для использования воды в системах отопления, горячего и питьевого водоснабжения. Лимитирующей концентрацией для воды питьевого качества является жесткость не более 7,5 мг-экв/дм3 (150 мг). Вода для питания водогрейных и паровых котлов должна быть значительно мягче этого показателя, т.к. жесткость воды влияет на интенсивность накипеобразования и как следствие, определяет эффективность работы оборудования.
Ход определения
Определение кальция в воде проводят комплексонометрическим методом. Пробу воды, объемом 5,0-20,0 см3 помещают в стакан для титрования, прибавляют 5 см3 аммиачного буферного раствора, индикатор хром темно-синий на кончике шпателя. Раствор приобретает малиново-красную окраску. Параллельно готовят «холостую» пробу. В деминерализованную пробу воды прибавляют 5 см3 аммиачного буфера, индикатор хром темно-синий. Обе пробы разбавляют деминерализованной водой до объема на 2-5 мм выше уровня «окна» регистрирующего прибора. Последовательно измеряют пропускание на всех светофильтрах прибора ЛМФ-69. При каждой смене светофильтра при закрытой шторке прибора устанавливают показания его на ноль. Для выполнения анализа используют светофильтр, при использовании которого получена максимальная разность показаний между «холостой» и анализируемым раствором. Показания для анализируемого устанавливают в пределах шкалы регистрирующего прибора.
После выбора светофильтра проводят титрование анализируемого раствора 0,1 N раствором комплексона (III). Точку эквивалентности находят по пересечению касательных нисходящего участка кривой титрования и минимального значения показаний прибора.
Расчет содержания кальция в растворе выполняют по формуле:

где Vэкв – объем комплексона (III), пошедший на титрование, см3;
N – нормальность комплексона (III), г-экв/л;
мЭСа – мг-эквивалент кальция, 0,02;
Vпробы – объем пробы, взятой для анализа, см3.
Вопросы для самопроверки
1. Как графически описывается зависимость D=ε·c·l?
2. Как изменится оптическая плотность окрашенного раствора, если его концентрация уменьшится вдвое?
3. Как изменится оптическая плотность и пропускание при увеличении толщины поглощающего слоя?
4. Будет ли сохраняться линейная зависимость D – c, если происходит диссоциация:
 [Fe (SCN)6]3- [ Fe (SCN)4]- + 2 SCN-
[Fe (SCN)6]3- [ Fe (SCN)4]- + 2 SCN-
5. Чем обусловлены отклонения от закона Бугера-Ламберта-Бера?
6. Оптическая плотность трех исследуемых растворов 0,05; 0,40; 1,0. В каком случае ошибка измерения будет минимальная?
7. Какие из указанных соединений будут поглощать в видимой области спектра K2Cr2O7, CuSO4, KCl?
8. Какой из методов предпочтительнее – прямая или дифференциальная фотометрия, если исследуемый раствор имеет оптическую плотность больше 1?
9. Какой вид имеет кривая фотометрического титрования, если:
а) поглощает продукт реакции и не поглощает титрант и определяемое вещество;
б) поглощает определяемый компонент, не поглощает титрант и продукт реакции;
в) поглощает определяемое вещество и титрант, продукт реакции не поглощает.
10. В чем физический смысл молярного коэффициента светопоглощения?
11. Как выбирают длину волны в спектрофотометрии, фотоколориметрии?
Решение типовых задач
1. В мерные колбы емкостью 100,0 см3 поместили соответственно 1,0; 2,0; 3,0; 4,0; 5,0 см3 стандартного раствора Al3+ с концентрацией 0,1 мг/см3. После проведения реакции с алюминатом оптические плотности равны 0,12; 0,24; 0,36; 0,50; 0,63.оптические плотности анализируемых растворов 0,30 и 0,55. Вычислить концентрации растворов в мг/дм3.
Решение: рассчитаем концентрацию (мг/дм3) Al3+ в стандартных растворах
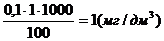




Построим график

Градуировочный график линеен и выходит из начала координат. По графику найдем содержание Al3+ соответственно 2,5 мг/дм3 и 4,5 мг/дм3.
3. При фотометрическом титровании 10,00 см3 раствора NaNO2 раствором KMnO4 с N = 0,05 получили следующие данные:
| V(KMnO4), см3
|
| 0,5
| 1,0
| 1,25
| 1,50
| 1,75
| 2,0
|
| D
| 0,11
| 0,11
| 0,11
| 0,11
| 0,15
| 0,18
| 0,23
|
Вычислить концентрацию NaNO3, г/л.
Решение: при титровании протекает реакция:
2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
NO2- - 2e- + H2O = NO3- + 2H+
MnO4- + 5e- + 8H+ = Mn2+ + 4H2O
Такой вид титрования называется реверсным. При титровании, до наступления эквивалентной точки оптическая плотность не меняется, так как KMnO4 восстанавливаясь NaNO2 переходит в неокрашенный Mn2+. После эквивалентной точки в растворе появляется избыток KMnO4, придающий раствору малиновую окраску, которая увеличивается по мере добавления новых порций титранта.
По результатам титрования строят кривую титрования. Точку эквивалентности находят по пересечению линейных участков кривой титрования.

Точка эквивалентности соответствует излому кривой V(KMnO4)=1,25 см3. Содержание NaNO2, г/л вычисляют по формуле:

РАЗДЕЛ 2. ЭЛЕКТРОХИМИЯ
В современной аналитической химии все методы анализа можно разделить на три большие группы: химические, физические и физико-химические.
Химические методы анализа основаны на химических реакциях, протекающих в растворах, расплавах, твердых телах и газах, – реакциях нейтрализации, осаждения, комплексообразования и окисления – восстановления.
Под термином “физические методы анализа” объединяют все методы, в которых не применяются химические или электрохимические реакции. При анализе многими физическими методами анализируемое вещество не меняет свой состав.
В физико-химических методах анализа используют химические или электрохимические реакции и анализ ведется на основе исследования зависимости между химическим составом и каким-либо физико-химическим свойством равновесной или неравновесной химической системы. Так как для проведения анализа в физических или физико-химических методах используются измерительные приборы, то данные методы иногда объединяют под общим названием – инструментальные.
Среди физико-химических методов анализа большое место занимают электрохимические методы вследствие их многообразия, высокой чувствительности и точности результатов, безынерционности, экспрессности и возможности автоматизации.
Электрохимические методы – это методы качественного и количественного анализа веществ, основанные на электрохимических явлениях в исследуемой среде или на границе соприкасающихся фаз и связанные с изменением структуры, химического состава или концентрации. В зависимости от измеряемого параметра в современной электрохимии выделяют следующие группы методов:
· потенциометрию и потенциометрическое титрование (методы, основанные на измерении потенциала электрода);
· кондуктометрические методы (измерение электропроводности);
· кулонометрические методы (определение концентрации по количеству электричества);
· электрогравиметрия (выделение вещества на электроде в процессе электролиза);
· вольтамперометрические методы (определение вещества по величине тока).
· Электрохимические методы являются не только методами анализа, но и методами физико-химического исследования. Благодаря им можно изучать термодинамические равновесие, кинетику и механизм протекания химических и электрохимических реакций, строение и состав неорганических и органических соединений. В качестве аналитических методов электрохимические методы используют при анализе различных объектов (экология, медицина, промышленность, технология и т. д.).
ПОТЕНЦИОМЕТРИЧЕСКИЙ АНАЛИЗ
Потенциометрия является одним из основных методов электрохимического анализа и основана на измерении потенциала электрода, погруженного в анализируемый раствор. Потенциал электрода меняется при изменении концентрации (точнее активности) ионов, которыми обменивается электрод с раствором. На этом основании можно получить количественную информацию о составе раствора в соответствии с уравнением Нернста:
 (1)
(1)
Необходимая для измерения установка состоит из пары электродов - электрода сравнения и индикаторного электрода, а также прибора для измерения потенциала.
Широкое распространение получили приборы для измерения разности потенциалов, представляющие собой высокоомные вольтметры.
Такие приборы заводского изготовления обычно называют рН-метрами или иономерами, поскольку они предназначены для измерения потенциала ячеек, содержащих рН-чувствительный стеклянный электрод высокого сопротивления или соответствующий ионоактивный электрод. Шкала этих приборов калибруется как в милливольтах, так и единицах рН.
Интенсивное развитие потенциометрии связано с появлением разнообразных типов ионоселективных электродов, позволяющих проводить прямое определение концентрации многих ионов в растворе.
Потенциометрические методы анализа подразделяют на прямую потенциометрию (ионометрию), основанную на использовании уравнения Нернста (1) для нахождения активности или концентрации участника электродной реакции по экспериментально измеренной ЭДС цепи потенциал у соответствующего электрода и потенциометрическое титрование. В этом методе эквивалентную точку определяют по резкому изменению (скачку) потенциала вблизи эквивалентной точки.
Для измерения потенциала используют пару подходящих электродов, один из которых называется электродом сравнения, а другой - индикаторным.
Электроды сравнения. Для многих электрохимических методов желательно иметь полуэлимент, потенциал которого был бы известен, постоянен и совершенно не зависел от состава изучаемого раствора. Он называется электродом сравнения, сохраняет практически постоянный и воспроизводимый потенциал при прохождении достаточно малых токов. К числу электродов сравнения относят каломельный и хлорсеребряный электроды.
Каломельный электрод можно представить в виде:
||Hg2Cl2 нас, KCl(x)|Hg,
где х – молярная концентрация хлорида калия.
Электродная реакция описывается уравнением:
 Hg2Cl2 тв + 2е- 2Hg0 + 2Cl-
Hg2Cl2 тв + 2е- 2Hg0 + 2Cl-
Потенциал каломельного электрода относительно стандартного водородного электрода равен 0,242 В при 250С.
Серебряный электрод, погруженный в раствор KCl, насыщенный хлоридом серебра, образует систему, аналогичную каломельному электроду:
||AgClТВ, KCl(x)|Ag,
где х – молярная концентрация KCl.
 Электродная реакция описывается уравнением: AgCl тв+е- Ag0 + Cl-
Электродная реакция описывается уравнением: AgCl тв+е- Ag0 + Cl-
Потенциал хлорсеребряного электрода относительно стандартного водородного электрода равен 0,1976 В при 250С.
Индикаторные электроды. Электрод, используемый в анализируемом растворе в паре с электродом сравнения, называется индикаторным, его потенциал зависит от концентрации определяемого вещества. Индикаторные электроды бывают двух типов – металлические и мембранные.
В качестве индикаторных электродов можно использовать металлы, способные давать обратимые полуреакции, например: Ag, Cu, Hg, Pb, Cd. потенциалы этих металлов воспроизводимы и предсказуемо отражают активности их ионов в растворе. Однако не все металлы пригодны для изготовления индикаторных электродов, поскольку для них характерны невоспроизводимые потенциалы, зависящие от напряжений или кристаллических деформаций в их структуре и от образования окисных слоев на их поверхности. К таким металлам относят Fe, Ni, Co, W, Cr.
Металлические индикаторные электроды служат не только для определения собственных ионов, косвенно они чувствительны к анионам, образующим малорастворимые соли с катионами. В этом случае необходимо только насытить изучаемый раствор малорастворимой солью. Например, потенциал серебряного электрода будет правильно отражать концентрацию Cl- ионов в растворе, насыщенном AgCl.
В зависимости от материала мембраны электроды удобно разделить на четыре категории:
1) стеклянные электроды;
2) электроды с жидкими мембранами;
3) электроды с твердыми мембранами;
4) электроды с газочувствительными мембранами.
Более детально рассмотрим стеклянный электрод. Он изготавливается из рН-чувствительного стекла, припаянного к концу толстостенной стеклянной трубки. Образующуюся грушу заполняют раствором HCl (0,1 M), насыщенным AgCl. В раствор погружают серебряную проволоку, которая служит внешним выводом к одному из полюсов прибора для измерения потенциала. Серебряный электрод селективен по отношению к ионам водорода. Фактически чувствительной к измерению рН среды является тонкая стеклянная мембрана на кончике электрода. Для изготовления рН-чувствительного стекла используют составы, содержащие 22% Na2O, 6% CaO, 72% SiO. Стекло такого состава обладает высокой специфичностью до рН=9. При более высоких рН мембрана становится чувствительной по отношению к ионам Na+.
Следует отметить, что негигроскопичные стекла не обладают селективностью по отношению к ионам водорода. Поэтому электрод перед настройкой должен вымачиваться в течение 8 ч. По окончании работы он вновь должен быть погружен в воду.
Применение жидких мембран основано на том, что они обладают потенциалом, устанавливающимся на поверхности между анализируемым раствором и несмешивающейся жидкостью, селективно реагирующей с определенным ионом. Электрод с жидкой мембраной отличается от стеклянного только тем, что раствор с известной и постоянной активностью отделен от анализируемого раствора тонким слоем несмешивающейся с водой органической жидкостью.
Органическая жидкость представляет собой нелетучий несмешивающийся с водой органический ионит, содержащий кислотные, основные или хелатообразующие функциональные группы. Если устанавливается равновесие с водным раствором двухзарядного катиона, то этот процесс можно представить следующим образом:

 RH2x + xMe2 + RMex + 2xH+
RH2x + xMe2 + RMex + 2xH+
органическая фаза водная фаза органическая фаза водная фаза
Путем многократной обработки жидкий ионит можно практически полностью превратить в катионную форму RMex, и в таком виде он применяется в электродах для определения Меn+.
Наибольший интерес с практической точки зрения представляют Са и К – электроды. Эти электроды имеют большое значение как для технологических и научных исследований, так и в медицине.
В Са-электроде ионитом служит эфир фосфорной кислоты с двумя алифатическими радикалами, растворенный в полярном растворителе. сродство эфира с кальцием определяет селективность электрода. Чувствительность электрода к ионам кальция в 50 раз превышает его чувствительность к ионам Mg2+ и в 1000 раз к Na+ и К+. Электрод может применяться для определения активности ионов кальция в растворах с концентрацией 10-5 г-ион/л и выше.
К-электрод должен определять малые количества калия на фоне значительных количеств натрия. В К-электроде в качестве жидкой мембраны используется антибиотик валиномицин, обладающий значительно большим сродством с калием, чем с натрием. Применяют раствор валиномицина в дифениловом эфире. При определении калия в присутствии натрия такая жидкая мембрана характеризуется коэффициентами селективности больше 10000.
Отечественной промышленностью освоен выпуск селективных электродов с жидкими мембранами на Ca2+, K+, Cl-, NO3-, ClO4-.
Перспективно применение электродов с твердыми мембранами. Подобно тому, как некоторые стекла селективны к катионам, мембрана, обладающая катионными пустотами, селективна к анионам. Описаны и используются электроды с твердыми мембранами на Cl-, Br-, J-, Cd2+, Cu2+, CN-, S2-, SCN-.





 , (17)
, (17) , (18)
, (18)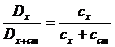 (21)
(21)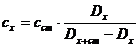 (23)
(23)


 [Fe (SCN)6]3- [ Fe (SCN)4]- + 2 SCN-
[Fe (SCN)6]3- [ Fe (SCN)4]- + 2 SCN-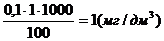







 (1)
(1) Hg2Cl2 тв + 2е- 2Hg0 + 2Cl-
Hg2Cl2 тв + 2е- 2Hg0 + 2Cl- Электродная реакция описывается уравнением: AgCl тв+е- Ag0 + Cl-
Электродная реакция описывается уравнением: AgCl тв+е- Ag0 + Cl-
 RH2x + xMe2 + RMex + 2xH+
RH2x + xMe2 + RMex + 2xH+


