

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
Топ:
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Интересное:
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Стандартная энтальпия образования DНообр. – тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Например, для реакций:
Na2O(т) + Н2О(ж) = 2NaOH(т), DНо1
1/2 Na2O(т) + 1/2 Н2О(ж) = NaOH(т), DНо2
Na(т) + 1/2O2(г) + 1/2H2(г) = NaOH(т), DНо3
Na(т) + O(г) + H(г) = NaOH(т), DНо4
Только DHо3является стандартной энтальпией образования NaOH.
Энтальпия образования простых веществ принята равной нулю, причем нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому при Т=298К. Так, для йода ΔHI20(Т) = 0 кДж∙моль–1, DНI20(ж)=22 кДж∙моль–1, DНI20(г) = 62,3 кДж∙моль–1.Для углерода DН0(графит) = 0 кДж∙моль–1, DН0(алмаз) = 1,83 кДж∙моль–1.
Стандартная энтальпия сгорания D Носгор. – тепловой эффект реакции сгорания одного моля вещества до образования высших оксидов. Для органических веществ – до СО2 (г) и Н2О(ж). Теплота сгорания негорючих веществ принимается равной нулю. Теплота сгорания топлива характеризует его теплотворную способность.
Стандартная энтальпия разрыва связи DНосв – энергия, поглощаемая при разрыве одного моля связей двух атомов, находящихся в газообразном состоянии при 298К, (называемая также энергией связи Есв)
НCl(г) ® Н(г) + Cl(г), DН0 = 429,7кДж
Средние стандартные энтальпии связи могут быть определены для индивидуального соединения или путем усреднения значений, найденных для целых классов соединений.
Энтальпия растворения складывается из теплоты разрушения кристаллической решетки (DНреш. > 0) и теплоты гидратации (сольватации для неводных растворов), выделяющейся в результате взаимодействия молекул растворителя с молекулами или ионами растворяемого вещества с образованием соединений переменного состава – гидратов (сольватов) (DНгидр. < 0).
|
|
В зависимости от соотношения значений DНреш. и DНгидр. энтальпия растворения может иметь как положительное, так и отрицательное значение.
Так, энтальпия растворения КОН –отрицательная величина и характеризует экзотермический процесс:
DНраств.= DН0реш. + DН0гидр.К+ + DН0гидр.ОН– =DН0реш + DН0гидр.КОН
–59 790,5 –339 –510,5 кДж∙моль–1
Растворение KNO3(к) – эндотермический процесс (35,9 кДж∙моль–1), так как на разрушение кристаллической решетки (DНореш =684,5 кДж∙моль–1) затрачивается больше энергии, чем выделяется при гидратации ионов K+ и NO3¯: –339 кДж∙моль–1 и –309,6 кДж∙моль–1 соответственно.
Стандартная энтальпия нейтрализации DНонейтр. – энтальпия реакции взаимодействия сильных кислот и оснований с образованием одного моль Н2О при стандартных условиях.
HCl + NaOH = NaCl + Н2О
H+ + OH– = Н2О, DНо = – 55,9 кДж∙моль–1
Для концентрированных растворов сильных электролитов DНонейтр. может несколько отличаться из-за эффекта гидратации DНгидр. их ионов при разбавлении.
При нейтрализации слабой кислоты (диссоциирующей не полностью) сильным основанием тепловой эффект будет меньше, чем в случае сильной кислоты и сильного основания, так как часть выделяющейся теплоты тратится на ионизацию слабого электролита.
СH3COOH + NaOH = Н2О + СH3COONa
СH3COOH + OH– = СH3COO– + Н2О
Стандартная энтальпия реакции DНо – тепловой эффект реакции определенного числа моль реагентов, задаваемого уравнением реакции при стандартных условиях. Например, для реакции:
4Н2О(ж) + 2Fe(т) ® Fe2О3(т) + 4Н2(г), DНо = 321,3кДж
DН0 относится целиком к реакции, как она записана.
Табулированы стандартные термодинамические функции Sо, DНообр., DGообр. (DHоf, DGоf), DНосгор, Есв.
Пользуясь табличными значениями DНообр., DНосгор. и Есв. , можно рассчитывать энтальпии различных химических процессов и фазовых превращений. Основанием для таких расчетов является закон Гесса, сформулированный петербургским профессором Г.И.Гессом (1841 г.) “Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния системы и не зависит от пути перехода её из одного состояния в другое”.
|
|
|
|
|

|
|

 II. 1) С(гр) + ½О2 (г) = СО(г) ΔН01 = –110,6 кДж
II. 1) С(гр) + ½О2 (г) = СО(г) ΔН01 = –110,6 кДж
2) СО(г) + ½О2 (г) = СО2 (г) ΔН02 = –283,2 кДж
ΔН0I = ΔН0II = ΔН01 + ΔН02 = –393,8 кДж
Энтальпия первого пути равна сумме энтальпий отдельных стадий второго пути. Анализ закона Гесса позволяет сформулировать следующие следствия:
1. Энтальпия реакции равна разности сумм энтальпий образованияконечных и начальных участников реакции с учетом их стехиометрических коэффициентов.
DН0 = åDН0обр. конечн. – åDН0обр.нач.
Поскольку DН0обр приводится в расчете на один моль, то при вычислении åDН0обр. соответствующее значение DН0обр умножается на число моль вещества, участвующего в реакции (на стехиометрический коэффициент).
Например, для реакции
4 Н3РО3 (т) = 3 Н3РО4 (ж) + РН3 (г)
DН0 = 3DН0обр. Н3РО4+ DН0обр. РН3– 4DН0обр. Н3РО3.
2. Энтальпия реакции равна разности сумм энтальпий сгорания начальных и конечных реагентов с учетом их стехиометрических коэффициентов.
DН0 = åDН0сгор.нач – åDН0сгор.конечн.
3. Энтальпия реакции – равна разности сумм энергий связей Есв.исходных и конечных веществ с учетом их стехиометрических коэффициентов.
В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах (åЕисх.) и выделяется при образовании продуктов реакции (– åЕпрод.). Отсюда
DН = åЕисх. – åЕпрод.
Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества.
При определении энтальпии реакции по энергиям связей, уравнение реакции пишут с помощью структурных формул для удобства определения числа и характера связей.
4. Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.
∆Hобр. = – ∆Hразл.
5. Энтальпия гидратации равна разности энтальпий растворения безводной соли (ΔΗ0раств.б/с) и кристаллогидрата (ΔΗ0раств. крист.), что иллюстрирует схема
|
|
ΔΗ0раств. б/с
 CuSO4 (т) CuSO4 (р)
CuSO4 (т) CuSO4 (р)
 | |||
 | |||
+5 Н2О(ж)
ΔΗ0гидр. ΔΗ0раств. крист
CuSO4 · 5Н2О(т)
Отсюда ΔΗ0раств. б/с = ΔΗ0гидр. + ΔΗ0раств. крист
ΔΗ0гидр. = ΔΗ0раств. б/с – ΔΗ0раств. крист
6. Закон Гесса и его следствия распространяются и на остальные функции состояния (S0, ∆G0).
∆Ф0 = Σ∆Ф0обр.пр. – Σ∆Ф0обр.исх.
Из вышесказанного видно, что закон Гесса позволяет обращаться с термохимическими уравнениями как с алгебраическими, т.е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям.
Анализ уравнения Гиббса
Как было сказано раньше, в химических процессах одновременно изменяются энергетический запас системы и степень её беспорядка. Эта тенденция отражается вторым началом термодинамики, математическим выражением которого является уравнение Гиббса:
∆G = ∆H – T ∆S
Из уравнения Гиббса следует:
Если ∆H<0 и ∆S>0, то всегда ∆G<0, то есть реакция возможна при любой температуре;
если ∆H>0 и ∆S<0, то всегда ∆G>0, то есть реакция с поглощением теплоты и уменьшением энтропии невозможна ни при каких условиях;
в остальных случаях (∆H<0, ∆S<0 и ∆H>0, ∆S>0) знак ∆G зависит от соотношения ∆H и Т∆S. Реакция возможна, если она сопровождается уменьшением изобарного потенциала;
при комнатной температуре, когда значение Т невелико, значение T∆S также невелико, и обычно изменение энтальпии больше T∆S. Поэтому большинство реакций, протекающих при комнатной температуре, экзотермичны. Чем выше температура, тем больше T∆S и даже эндотермические реакции становятся осуществимыми.
Для оценки знака ∆G реакции полезно знать порядок величин ∆H и ∆S для этой реакции.
∆H образования и ∆H реакций обычно составляют 80–800 кДж · моль–1, редко меньше 40 и больше 4000 кДж · моль–1, ∆Hобр. не всегда < 0. ∆H сгорания всегда < 0 и составляет тысячи кДж · моль–1.
Энтальпия фазовых превращений обычно значительно меньше энтальпии химических реакций. В частности, ∆Hпарообр.. составляют несколько десятков кДж · моль–1, ∆Hкрист. и ∆Hплавл. – 5 – 25 кДж · моль–1.
|
|
Зависимость ∆H от температуры выражается соотношением ∆HТ = ∆H0 + ∆СР · ∆Т, где ∆СР – изменение теплоемкости системы. Если в интервале температур 298 К – Т реагенты не претерпевают фазовых превращений, то ∆СР = 0, и для расчетов можно пользоваться значениями ∆H0.
Энтропия индивидуальных веществ всегда >0 и составляет от десятков до сотен Дж · моль–1 · К–1 (табл. 3.1). Наибольшие значения ∆S имеют фазовые переходы (рис. 3.1).
Итак, если реакция экзотермична, то знак и величину ∆G определяет энтальпийный фактор. При низких температурах вклад энтропийного фактора мал, и о направлении процесса можно судить по его тепловому эффекту, т.е. по ∆H.
Эндотермические реакции осуществляются за счет энтропийного фактора и тем успешнее, чем выше температура. Влияние энтропийного фактора, с другой стороны, определяется также величиной ∆S и поэтому в случае фазовых переходов (∆Н мало, а ∆S относительно велико) эндотермический процесс может осуществляться даже при низких температурах (например плавление льда).
Знак ∆G определяет направление реального процесса. Однако для оценки осуществимости процесса обычно пользуются значениями стандартной энергии Гиббса ∆G0. Величина ∆G0 не может использоваться в качестве критерия вероятности в эндотермических процессах со значительным возрастанием энтропии (фазовые переходы, реакции термического разложения с образованием газообразных веществ и др.). Такие процессы могут быть осуществлены за счёт энтропийного фактора при условии  (см. задачу 5).
(см. задачу 5).
В заключение следует отметить, что неравенства ΔG0<<0 и ΔG0>>0 свидетельствуют о принципиальной возможности осуществимости и неосуществимости процессов, но аналогичные выводы относительно неравенств ΔG0 < 0 и ΔG0 > 0 сделать затруднительно. В большинстве случаев «порогом» реакционной способности можно считать значения ΔG 0> 25 кДж/моль. Это значит, что, при ΔG0 < 25 кДж/моль, процесс можно осуществить, изменяя условия проведения процесса.
Изотерма Вант-Гоффа
Для определения величины ∆G в условиях, отличных от стандартных, используют уравнение зависимости изобарно-изотермического потенциала от концентрации и температуры.
Если исходное вещество находится в нестандартном состоянии, то есть его концентрация больше 1 моль, реакционная способность этого вещества больше, увеличивается способность реакции идти в прямом направлении, что соответствует изменению G этой реакции до некоторого более отрицательного значения. Иначе говоря, причина изменения изобарного потенциала реакции связана с изменением G исходного вещества.
|
|
Изобарный потенциал любого вещества i в реакционной смеси выражается уравнением:
Gi=Gi0+RTlnai (3.5),
где Gi0 – стандартный изобарный потенциал образования вещества с активной концентрацией (активностью) ai. Произведение RT необходимо для приведения логарифма активности к единицам кДж/моль (при 298 К RT=2,479 кДж/моль).
Активность «а» - это расчетная величина, с помощью которой учитывается отклонение в поведении реального раствора от идеального.
Когда система переходит из состояния 1 в состояние 2 для i-го компонента можно записать:
Gi,1=Gi,10+RTlnai,1
Gi,2=Gi,20+RTlnai,2.
Тогда изменение изобарного потенциала i-го компонента в ходе реакции:
Gi,(1-2)=Gi,20- Gi,10, то есть
Gi,(1-2)=Gi,(1-2)0+RTln  (3.6).
(3.6).
Если система переходит в состояние 2 из стандартного, то ai,1=1 моль/л, а под знаком логарифма стоит активная концентрация, определяемая как отношение активности этого вещества к его активности в стандартных условиях, и ai становится безразмерной величиной, а уравнение (3.6) принимает вид:
Δ Gi=Δ Gi0+RTlnai (3.7)
Для произвольной химической реакции
аА + вВ = lL + mM
согласно закону Гесса
Δ G0реакции = Σ∆G0обр.пр. – Σ∆ G0обр.исх.
Решая это уравнение совместно с 3.7, получаем:

(3.8)
 |
где āА, āВ, āL, āM, – равновесные значения активных концентраций.
Выражение под знаком логарифма, представляющее собой отношение произведения равновесных активностей продуктов к произведению активностей исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия К:
DGo = – RT ln К (3. 9)
Подставив (3.9) в (3.8), получим уравнение, носящее название изотермы Вант- Гоффа:
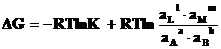
(3.10)
Для окислительно-восстановительной реакции, протекающей в гальваническом элементе, DG определяют по уравнению:
DG = –Аmax = –nFE, (3.11)
где Е – ЭДС (разность потенциалов) элемента в вольтах;
F – число Фарадея;
n – число моль электронов, переходящих от восстановителя к окислителю в соответствии с уравнением реакции.
Уравнения (3.10) и (3.11) являются основными для экспериментального определения DGчерез константу равновесия или через ЭДС окислительно-восстановительной реакции.
Значения стандартного изобарного потенциала реакции зависит от того, в каком направлении и для каких количеств написано уравнение реакции:
1) N2 + 3H2 ↔ 2NH3 Δ G10
2) 2NH3 ↔ N2 + 3H2 Δ G20
3) 1/2N2 + 3/2H2 ↔ NH3 Δ G30
Между значениями стандартного изобарного потенциала имеется следующее соотношение:
Δ G10 = - Δ G20 = 2 Δ G30,
а между константами равновесия:
К1 = К2-1 = К32.
Примеры решения задач
Задача 1. Вычислите стандартную энтальпию образования ацетальдегида, СН3СНО, если энтальпии сгорания ацетальдегида, графита и водорода до диоксида углерода и жидкой воды равны соответственно –1165, –304 и ‑286 кДж∙моль–1.
Запишем уравнение гипотетической реакции образования ацетальдегида согласно определению стандартной энтальпии образования
2С(гр.) + 2Н2(г) + 1/2О2(г) = СН3СНО
В соответствии со вторым следствием из закона Гесса
DН0 = å DН0сгор.исх. – å DН0сгор.прод.
находим Н0р = DН0обр. СН3СНО = 2(–304) + 2(–286) – (–1165) = = – 15 кДж∙моль–1
Задача 2. Из каких тепловых эффектов складывается теплота растворения? Определите энтальпию гидратации Na2CO3 · H2O до Na2CO3 · 10H2O, если при растворении первого кристаллогидрата выделяется 10,5 кДж · моль–1, а при растворении второго поглощается 67 кДж · моль–1 тепла
|
 Na2CO3 · Н2О Na2CO3 (р)
Na2CO3 · Н2О Na2CO3 (р)
 | |||
 | |||
Na2CO3 · 10Н2О
ΔHраств. Na2СО3.Н2О = ΔНгидр. + ΔHраств. Na2СО3. 10Н2О
DН0гидр. = ΔH0раств. Nа2СО3.Н2О – ΔH0раств. Na2СО3. 10Н2О=
= –10,5 – 67,0 = – 77,5 кДж · моль–1
Задача 3. а) Энтальпии образования С2Н5ОH(г), CO2(г) и H2O(г) в стандартных условиях равны –235, –393,8 и –241,8 кДж · моль–1 соответственно. Рассчитайте DНсгор. С2Н5ОH(г). б) Вычислите энтальпию сгорания С2Н5ОН(г), используя энергии связей (кДж · моль–1): ЕС‑Н = 412; ЕС-С = 348; ЕС‑О = 360; ЕО-Н = 460; ЕО=О = 490; ЕС=О = 790. Сравните эту величину с величиной, рассчитанной с помощью DН0обр.
а) С2Н5ОH(г) + 3О2 (г) = 2СО2 (г) + 3H2O(г)
DН0 = 2 DН0обр.СО2 + 3DН0обр.H2О –DН0обр.С2Н5ОH =
= –2 · 393,8 – 3 · 241,8 + 235 = –1278 кДж · моль–1
б) СН3СН2ОН(г) + 3О2(г) = 2СО2 (г) + 3H2O(г)
H H H
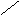




 Н-С-С-ОН + 3 О=О → 2 О=С=О + 3О
Н-С-С-ОН + 3 О=О → 2 О=С=О + 3О
H H H
DН0 = 5ЕС-Н + ЕС-С + ЕС-О + ЕО-Н + 3ЕО=О – 4ЕС=О – 6ЕО-Н =
=5 · 412 + 348 + 360 + 3 · 490 – 4 · 790 – 5 · 460 =
= 2060 + 348 + 360 + 1470 – 3160 – 2300 =
= –1222 кДж · моль–1.
Как видно, значения DН0 , рассчитанные двумя методами, отличаются на 56 кДж · моль–1, так как использование средних энергий связи для определения энтальпий реакций дает лишь приближенные значения последних.
Задача 4. Определите энергию двойной связи С=С, если известна энтальпия реакции:
С2Н4(г) + Н2(г) = С2Н6(г) , DН = –137 кДж · моль–1
и средние энергии связей: ЕС-Н = 412 кДж · моль–1; ЕС‑С=348 кДж · моль–1; ЕН-Н = 430 кДж · моль–1.
Н2С=СН2 + Н2 → Н3С-СН3
DН = 4ЕС-Н + ЕС=С + ЕН-Н – 6ЕС-Н – ЕС-С
ЕС=С = DН+ 2ЕС-Н + ЕС-С – ЕН-Н = –137 + 2 · 412 + 348 – 430 =
= 605 кДж · моль–1.
Задача 5. Вычислите изменение стандартной энергии Гиббса и определите возможность протекания реакции при стандартных условиях:
Fe2O3(т) + 3Н2(г) = 2Fe(т) + 3Н2О(г)
Определите условия, при которых ее можно осуществить.
| Fe2O3(т) | Н2(г) | Fe(т) | Н2О(г) | |
| DН0обр., кДж·моль–1 | –822,7 | –242 | ||
| S0обр., Дж· моль–1 ·К–1 | 87,5 | 130,7 | 27,2 |
DG0 = DH0 – T DS0
DН0 = –3 · 242 + 822,7 = 96,7 кДж · моль–1
DS0 = 3 · 189 + 2 · 27,2 – 3 · 130,7– 87,5 = 567 + 54,4 – 392,1 – 87,5=
= 141,8 Дж · моль–1 · К–1
DG0 = 96,7 – 298 · 0,1418 = 54,4 кДж · моль–1
 |
 .
.
Если T > 682 K, реакция осуществима
Вопросы для самопроверки
1. Дайте определение энтальпии (Н), энтропии (S), потенциала Гиббса (G) и их стандартных величин.
2. Напишите уравнения, связывающие следующие величины:
DG и Т, DН и DS; DG и К равновесия; DG0 и Е0.
3. Что характеризуют равенство DG0 = 0 и неравенства DG0 < 0, DG0 > 0?
4. При каких условиях и агрегатных состояниях энтальпийный фактор определяет самопроизвольное протекание химического процесса?
5. При каких условиях энтропийный фактор определяет самопроизвольное протекание химического процесса?
6. Предскажите знак DS0 для реакции:
Ba2+(nH2O) + SO42– (mH2O) = BaSO4(т) + (n+m) H2O.
7. Закон Гесса и его следствия.
8. Определите энергию связи H-F, если DН0 реакцииН2+ F2 = 2HFсоставляет –542 кДж · моль–1, а энергии связей Н-Н и F-F равны соответственно 430 и 156 кДж · моль–1
9. При комнатной температуре олово существует в двух модификациях: серое (a) и белое (b). Термодинамические характеристики модификаций:
| ∆H0, кДж·моль–1 | S0, Дж·моль–1· К–1 | |
| β – белое | 51,55 | |
| α – серое | –2092 | 44,14 |
Какая из модификаций более устойчива?
10. Вычислите DН0обр. кристаллогидрата хлористого кальция в реакции CaCl2 + 6H2O = CaCl2 · 6H2O по следующим данным: DНраств. безводной соли CaCl2 равна -72,84 кДж · моль-1, а теплота растворения кристаллогидрата CaCl2 · 6H2O равна 18,03 кДж · моль-1.
11. Какой термодинамический фактор DН или ТDSопределяет протекание реакций при 298К
а) ВаО(т) + СО2 (г) = ВаСО3(т)
б) ВаСО3(т) = ВаО(т) + СО2 (г)
| ВаО(т) | СО2 (г) | ВаСО3 (т) | |
| DН0обр., кДж·моль–1 | –554 | –393,8 | –1217 |
| S0, Дж·моль–1·К–1 | 213,8 |
Пойдет ли разложение карбоната бария при 1600К? Значения энтальпии и энтропии процесса считать стандартными.
12. Напишите уравнение изотермы Вант-Гоффа для реакции: FeO(т) + H2(г) = Fe(т) + H2O(г)
 |
13. Для процессов, протекающих в прямом направлении
MgO(т) + CO2 (г)= MgCO3 (т),
CaO(т) + H2O(ж) = Cа(ОН)2(т) ,
2Na(т) + 2H2O(ж) = 2NaOH(т) + H2 (г)
предскажите знаки термодинамических функций DH0, DS0,DG0.
Уравнения (3.9) и (3.11) являются основными для экспериментального определения DGчерез константу равновесия или через ЭДС окислительно-восстановительной реакции
Экспериментальная часть
|
|
|

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!