Химическая связь в молекулах обусловлена перекрыванием валентных орбиталей взаимодействующих атомов и сопровождается уменьшением полной энергии системы. Пара электронов, связывающих два атома, находится в области перекрывания их атомных орбиталей.
Поскольку электронные облака имеют различную форму и направление, их взаимное перекрывание может осуществляться разными способами. В зависимости от способа перекрывания и симметрии образующегося облака различают σ -, π - и δ - связи.
σ- Связь (сигма-связь) осуществляется при перекрывании облаков вдоль линии соединения атомных центров.
Между двумя атомами возможна только одна σ-связь. Все σ-связи обладают осевой симметрией относительно межъядерной оси. Совокупность направленных, строго ориентированных в пространстве σ-связей создает структуру (геометрию) химической частицы.

| 
|
| σ-Связь между s-орбиталями
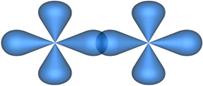
| σ-Связь между d-орбиталями
|

|
| σ-Связь между p-орбиталями
|
π- Связь (пи-связь) возникает при перекрывании атомных орбиталей, перпендикулярных линии σ- связи.
С появлением π- связи, не имеющей осевой симметрии, свободное вращение фрагментов химической частицы вокруг σ- связи становится невозможным, так как оно должно привести к разрыву π- связи

| 
|
| π- Связь между p-
орбиталями
| π- Связь между d-орбиталями
|
При дополнительном перекрывании атомных орбиталей, за счёт π- связи между атомами возникают кратные связи:
| Одинарная (σ)
| Двойная (σ +π)
| Тройная (σ + π + π)
|
| F−F
| O=O
| N≡N
|
δ- Связь (Дельта-связь) обязана перекрыванию всех четырех лопастей d - электронных облаков, расположенных в параллельных плоскостях
Исходя из условий симметрии, можно сказать, что электроны s -орбиталей могут участвовать лишь в σ - связывании, p -электроны – уже в σ - и π - связывании, а d - электроны – как в σ - и π -, так и в δ - связывании.
Максимальное перекрывание облаков осуществляется при σ - связи.
Химическая ковалентная связь характеризуется длиной, валентным углом и энергией.
Длиной связи является расстояние между ядрами атомов, образующих соединение. Длины связей обычно лежат в пределах от 0,1 до 0,27 нм (Н2 – 0,075; N2 – 0,110; О2 – 0,121, I2 – 0,267). Изменение длин связей в сходных соединениях связано с изменением эффективных радиусов элементов, входящих в эти соединения, так, для HF, HCl, HBr и HI длины связей меняются соответственно: 0,100; 0,127; 0,141; 0,162 нм.
Валентный угол – угол между воображаемыми линиями, соединяющими центры атомов в направлении действия химической связи, и отражает геометрию молекул. Валентные углы, как и длины связей, определяют с высокой точностью.
Мерой прочности химической связи является энергия связи Есв., обратно пропорциональная длине связи. Это энергия, необходимая для разрыва связей в молекуле с получением нейтральных атомов. Измеряется в электронвольтах (эВ) для одной связи или в кДж/моль для одного моля связей. Так, энергия связи Н – Н в молекуле Н2 равна 435 кДж∙моль‾¹, а средняя энергия одной связи С – Н в многоатомной молекуле СН4 равна Едисс. СН4/4 = 1648/4 = 412 кДж∙моль‾¹.
Метод валентных связей
Совокупность химически связанных атомов (молекула, кристалл) представляет собой систему ядер и электронов. Экспериментально можно определить довольно точно положение атомных ядер и несколько менее точно – распределение электронной плотности. Принципиально эти величины можно вычислить с помощью квантовой механики. Однако реализовать эту принципиальную возможность довольно трудно, так как уравнение Шредингера решается точно только для простейших систем. Поэтому, как и для многоэлектронного атома, используются различные методы приближенных решений. Рассмотрим наиболее часто применяемые метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
Метод валентных связей иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними. В отличие от ММО, в котором простейшая химическая связь может быть как двух-, так и многоцентровой, в МВС она всегда двухэлектронная и обязательно двухцентровая. Число элементарных химических связей, которое образует атом, определяет его валентность в данном соединении. Так же, как и в ММО, в образовании химической связи принимают участие валентные электроны. Волновая функция, описывающая состояние электронов, образующих связь, называется локализованной орбиталью (ЛО).
Отметим, что электроны, описываемые ЛО, в соответствии с принципом Паули должны иметь противоположно направленные спины, т.е. в МВС все электроны спарены, и все молекулы должны быть диамагнитны. Следовательно, МВС принципиально не может объяснить магнитные свойства молекул.
Тем не менее, принцип локализованных связей имеет ряд важных преимуществ, одно из которых – его чрезвычайная наглядность. МВС достаточно хорошо, например, предсказывает валентные возможности атомов и геометрию молекул.
Обменный и донорно-акцепторный механизмы образования связи
В МВС различают два механизма образования ковалентной связи – обменный и донорно-акцепторный.
При обменном (спиновом) механизме в оразовании связи участвуют неспаренные электроны взаимодействующих атомов. Каждый атом дает по одному неспаренному электрону c противоположно направленными спинами в общую электронную пару, обеспечивающую единичную связь: A∙ + ∙B → A:B (A─B)



Число неспаренных электронов может увеличиться при возбуждении (промотировании) атома. Например, атом углерода за счёт двух неспаренных электронов может образовать только две ковалентные связи. Но если атому углерода сообщить некоторую дополнительную энергию, то один из 2 s - электронов переходит на свободную 2 р - орбиталь и неспаренных электронов станет уже четыре. В этом состоянии атом углерода может образовать четыре ковалентные связи, например, с атомами водорода.

Образовывать ковалентные связи в возбужденном состояния могут атомы, у которых в валентном уровне есть неподеленные пары электронов и одновременно свободные орбитали, например, атомы бора, кремния и бериллия:

В МВС считается приближенно, что возбуждение электрона возможно, когдаоно компенсируется энергией, выделяемой при образовании связи.
У атомов N, O, F такой возможности нет из-за отсутствия вакантных орбиталей в валентном слое и поэтому их максимальная валентность по обменному механизму (спин-валентность) соответственно равна 3, 2, 1.
С позиции промотирования в рамках модели ковалентной связи объясняют образование связей и тогда, когда электрон при возбуждении атомов р - элементов должен переходить на d - подуровень. Квантово-механическими расчетами эта модель не подтверждается, но хорошо пока-зывает, сколько валентных электронов атома принимает участие в образовании связей.

Итак, валентность элемента при обменном механизме образования связи определяется числом неспаренных электронов в основном и возбуждённом состояниях (Э*) атома.
Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
Донорно-акцепторныймеханизмреализуюется, например, при взаимодействии молекулы ВН3 с анионом Н– (рис 2.12).
 Рис. 2.12 .Обменный и донорно-акцепторный механизм образования связи в МВС
Рис. 2.12 .Обменный и донорно-акцепторный механизм образования связи в МВС
 Максимальная спин-валентность атома В равна трем. Тем не менее, молекула ВН3 остается чрезвычайно реакцион-носпособной и в свободном состоянии неизвестна, несмотря на кажущееся насыщение ее валентных возможностей. Причина высокой реакционноспособности кроется в наличии у бора вакантной p - орбитали, и молекула ВН3 выступает как акцептор электронной пары, а гидрид-ион: Н- в качестве «поставщика» электронов – донора. Т.о. в комплексном ионе ВН4- атом бора образует ещё одну четвёртую ковалентную связь по донорно-акцепторному механизму.
Максимальная спин-валентность атома В равна трем. Тем не менее, молекула ВН3 остается чрезвычайно реакцион-носпособной и в свободном состоянии неизвестна, несмотря на кажущееся насыщение ее валентных возможностей. Причина высокой реакционноспособности кроется в наличии у бора вакантной p - орбитали, и молекула ВН3 выступает как акцептор электронной пары, а гидрид-ион: Н- в качестве «поставщика» электронов – донора. Т.о. в комплексном ионе ВН4- атом бора образует ещё одну четвёртую ковалентную связь по донорно-акцепторному механизму.
По донорно-акцепторному механизму образуется ион аммония из молекулы аммиака (донор) и протона (акцептор).

| ®
| 
|
Отметим, что сами молекулы, конечно, «не знают», с помощью какого механизма образовалась ковалентная связь. В катионе NН4+ три связи образованы по обменному механизму, а одна – по донорно-акцепторному, но эксперимент показывает, что все они абсолютно равноценны.
Максимальная валентность (ковалентность) атомов проявляется при использовании обоих механизмов образовании связи и называется насыщаемостью.
У элементов 2-го периода насыщаемость равна сумме неспаренных электронов, неподелённых электронных пар и вакантных АО внешней электронной оболочки, т.е. числу валентных АО. Поскольку во 2-м периоде имеется четыре таких АО –2 s, 2 рх, 2 ру, 2 рz, то и насыщаемость связи всех элементов этого периода равна четырем.
У элементов 3 – 7 периодов роль валентных могут играть (n‑1) d -, n s - и n p - орбитали, а у f - элементов в образовании связи участвуют электроны условно валентной f -орбитали.
Во всех приведенных примерах рассматривались одинарные связи.
Согласно МВС между двумя атомами могут образовываться одинарные, двойные и тройные связи.
Число общих электронных пар между двумя взаимодействующими атомами называется кратностью связи (К). Так, в молекуле диоксида углерода О = С = О связи двойные (1σ- и 1π-, К=2), в молекуле оксида углерода
C ≡ О кратность связи равнна 3 (1σ- и 2π-).














 Рис. 2.12 .Обменный и донорно-акцепторный механизм образования связи в МВС
Рис. 2.12 .Обменный и донорно-акцепторный механизм образования связи в МВС Максимальная спин-валентность атома В равна трем. Тем не менее, молекула ВН3 остается чрезвычайно реакцион-носпособной и в свободном состоянии неизвестна, несмотря на кажущееся насыщение ее валентных возможностей. Причина высокой реакционноспособности кроется в наличии у бора вакантной p - орбитали, и молекула ВН3 выступает как акцептор электронной пары, а гидрид-ион: Н- в качестве «поставщика» электронов – донора. Т.о. в комплексном ионе ВН4- атом бора образует ещё одну четвёртую ковалентную связь по донорно-акцепторному механизму.
Максимальная спин-валентность атома В равна трем. Тем не менее, молекула ВН3 остается чрезвычайно реакцион-носпособной и в свободном состоянии неизвестна, несмотря на кажущееся насыщение ее валентных возможностей. Причина высокой реакционноспособности кроется в наличии у бора вакантной p - орбитали, и молекула ВН3 выступает как акцептор электронной пары, а гидрид-ион: Н- в качестве «поставщика» электронов – донора. Т.о. в комплексном ионе ВН4- атом бора образует ещё одну четвёртую ковалентную связь по донорно-акцепторному механизму.




